Karcinom plic: Porovnání verzí
m Robot: sl:Pljučni rak je na seznamu nejlepších článků; kosmetické úpravy |
Translated from English by Pavla Dohnalova & Zbynek Taborsky at Translators Without Borders |
||
| Řádek 1: | Řádek 1: | ||
{{Infobox disease |
|||
| Název = Karcinom plic |
|||
| Obrázek = LungCACXR.PNG |
|||
|Popis = Klasický [[rentgenový snímek hrudníku]] vykazující karcinom plic (označen šipkou) |
|||
|DiseasesDB = 7616 |
|||
|ICD10 = {{ICD10|C|33||c|30}}-{{ICD10|C|34||c|30}} |
|||
|ICD9 = {{ICD9|162}} |
|||
|ICDO = |
|||
|OMIM = |
|||
|MedlinePlus = 007194 |
|||
|eMedicineSubj = med |
|||
|eMedicineTopic = 1333 |
|||
|eMedicine_mult = {{eMedicine2|med|1336}} {{eMedicine2|emerg|335}} {{eMedicine2|radio|807}} {{eMedicine2|radio|405}}{{eMedicine2|radio|406}} |
|||
|MeshID = D002283 |
|||
}} |
|||
'''Karcinom plic''' je onemocnění, při kterém dochází k nekontrolovanému [[buněčnému růstu]] v [[tkáň (biologie)|tkáni]] [[plic]]. Pokud není léčen, může se tento růst v rámci procesu zvaného [[metastázování]] rozšířit i mimo plíce do okolních tkání nebo dalších částí těla. Většina případů rakoviny, které začínají v plicích a jsou známy jako primární rakovina plic, jsou [[karcinomy]] vznikající z buněk [[epitel|epitelové]] tkáně. Hlavními typy rakoviny plic jsou malobuněčný karcinom plic (SCLC), rovněž známý jako „karcinom ovesných buněk“ (zhoubné buňky připomínají zrnka ovsa), a nemalobuněčný karcinom plic (NSCLC). Mezi nejběžnější [[symptomy]] onemocnění patří kašel (včetně [[Hemoptýza|vykašlávání krve]]), úbytek váhy a dechová nedostatečnost.<ref name="Harrison" /> |
|||
Nejběžnější příčinou nemoci je dlouhodobé vystavení [[kouření tabáku|tabákovému kouři]],<ref name="Merck" /> které stojí za 80–90 % případů rakoviny plic.<ref name="Harrison" /> K 10–15 % případů tohoto onemocnění dochází u nekuřáků,<ref name="Thun" /> přičemž tyto případy jsou často přičítány kombinaci [[genetika|genetických faktorů]],<ref name="MurrayNadel46" /> vystavení vlivu [[radonu]],<ref name="MurrayNadel46" /> [[azbestu]]<ref name="O'Reilly" /> a [[znečištění vzduchu]],<ref name="MurrayNadel46" /> včetně [[pasivní kouření|kouře z pasivního kouření]].<ref name="AUTOREF" /><ref name="AUTOREF1" /> Karcinom plic lze zobrazit pomocí [[rentgenu hrudníku]] a [[počítačové tomografie]] (CT snímek). [[Lékařská diagnóza|Diagnóza]] je potvrzována prostřednictvím [[biopsie]],<ref name="Holland-Frei78" /> která se obvykle provádí za využití [[bronchoskopie]] nebo kontrolovaným CT vyšetřením. Léčba a dlouhodobé výsledky závisí na typu rakoviny, [[stanovení pokročilosti (patologie)|fázi]] (stupni rozšíření) a celkovém zdravotním stavu nemocného měřeném prostřednictvím hodnocení jeho [[celkového fyzického stavu]]. |
|||
Mezi běžné způsoby léčby patří [[chirurgický zákrok]], [[chemoterapie]] a [[radiační terapie|radioterapie]]. Nemalobuněčné karcinomy jsou někdy odstraňovány chirurgickým zákrokem, kdežto malobuněčné karcinomy obvykle lépe reagují na chemoterapii a radioterapii.<ref>{{cite book |last=Chapman | first=S | coauthors=Robinson G, Stradling J, West S | title=Oxford Handbook of Respiratory Medicine |edition=2nd | chapter=Chapter 31 | publisher=Oxford University Press | year=2009 | isbn=9-780199-545162 }}</ref> 15 % osob ve Spojených státech, u nichž je diagnostikována rakovina plic, [[přežití|přežije]] dalších pět let po stanovení diagnózy.<ref name="Collins" /> Celosvětově je [[rakovina]] plic nejběžnější příčinou úmrtí žen i mužů souvisejících s rakovinou a přičítá se jí [[:Kategorie:Úmrtí na rakovinu plic|1,38 milionu úmrtí]] ročně (údaj k roku 2008).<ref name="GLOBOCAN" /> |
|||
==Příznaky a symptomy== |
|||
Mezi příznaky a symptomy, které mohou rakovinu plic naznačovat, patří:<ref name="Harrison" /> |
|||
* respirační symptomy: [[kašel]], [[hemoptýza|vykašlávání krve]], [[sípání|sípání]] nebo [[dyspnoe|dýchavičnost]] |
|||
* systémové symptomy: úbytek hmotnosti, [[horečka]], [[vypouklé nehty|paličkovité prsty]] nebo [[vyčerpání (tělesné)|únava]] |
|||
* symptomy způsobené místním tlakem: [[bolest na prsou]], [[bolesti v kostech]], [[syndrom horní duté žíly]], [[dysfágie|potíže s polykáním]] |
|||
Pokud se karcinom tvoří v [[dýchacích cestách]], může ztěžovat proudění vzduchu a zapříčinit tak [[dyspnoe|dýchavičnost]]. Ucpání dýchacích cest může vést k nahromadění sekretu za místem ucpání a způsobit [[zápal plic]].<ref name="Harrison" /> |
|||
V závislosti na typu tumoru může na možnost karcinomu plic zpočátku ukázat tzv. [[Paraneoplastický syndrom|paraneoplastický syndrom]].<ref name="Honnorat" /> V případě karcinomu plic mohou projevy tohoto syndromu zahrnovat [[Lambert–Eatonův myastenický syndrom]] (svalová slabost způsobená [[autoimunitní porucha|autoprotilátkami]]), [[hyperkalcemii]] nebo [[syndrom nedostatečné produkce antidiuretického hormonu]] (SIADH). Tumory v [[Plicní apex|horní části plic]], známé jako [[Pancoastovy tumory]], mohou narušit místní část [[sympatického nervového systému]] a vést tak k [[Hornerově syndromu]] (pokles očního víčka a malá oční panenka na postižené straně) a k poškození [[brachiálního plexu]].<ref name="Harrison" /> |
|||
Mnoho ze symptomů karcinomu plic (nechuť k jídlu, úbytek hmotnosti, horečka, únava) není specifických.<ref name="Holland-Frei78" /> U mnoha osob, které v okamžiku projevu symptomů vyhledají lékařskou pomoc, je již rakovina rozšířena i mimo původní ložisko. Mezi běžná místa, kam se rakovina dále šíří, patří mozek, kosti, [[nadledvinky]], druhá plíce, játra, [[osrdečník]] a [[ledviny]].<ref name="ajcc" /> Přibližně 10 % osob s karcinomem plic nemá v okamžiku diagnózy žádné symptomy; k nálezu karcinomu obvykle dochází náhodně při rutinním rentgenu hrudníku.<ref name="Collins" /> |
|||
==Příčiny== |
|||
K rozvoji karcinomu dochází v důsledku genetického poškození [[DNA]]. Toto genetické poškození postihuje normální funkci buňky včetně její schopnosti množení, programované buněčné smrti ([[apoptózy]]) a schopnosti opravy DNA. Čím větší je poškození, tím vyšší je riziko vzniku karcinomu.<ref name="Holland-Frei8">{{Cite book | last=Brown | first=KM | coauthors=Keats JJ, Sekulic A et al. |title=Holland-Frei Cancer Medicine | publisher=People's Medical Publishing House USA | year=2010 | chapter=8 | edition=8th| isbn=978-1607950141 }}</ref> |
|||
===Kouření=== |
|||
[[Image:Cancer smoking lung cancer correlation from NIH.svg|thumb|Graf znázorňující, jak celkový nárůst prodeje tabákových výrobků v USA v prvních čtyřiceti letech 20. století (počet cigaret na osobu a rok) vedl k odpovídajícímu rychlému nárůstu počtu karcinomu plic během 30., 40. a 50. let 20. století (počet úmrtí v důsledku karcinomu plic na 100 000 mužů a rok)]] |
|||
[[File:cancerous lung.jpg|thumb|Příčný řez lidskou plící: Bílá oblast v horní části laloku je karcinom; černé oblasti jsou výsledkem změny zabarvení způsobené [[kouření tabáku|kouřením]].]] |
|||
[[Kouření tabáku|Kouření]], zejména pak kouření [[cigaret]], přispívá ke vzniku karcinomu plic zdaleka nejvíce.<ref name="AUTOREF5" /> Cigaretový kouř obsahuje více než 60 známých [[karcinogenů]],<ref name="Hecht" /> mezi něž patří [[radioizotopy]] z rozpadové řady [[radonu]], z [[nitrosaminu]] a [[benzopyrenu]]. Rovněž se zdá, že nikotin potlačuje imunitní odezvu na rakovinotvorný růst ve tkáni vystavené těmto vlivům.<ref name="AUTOREF6" /> V rozvinutých zemích bylo 90 % úmrtí mužů na karcinom plic v roce 2000 přičítáno kouření (70 % u žen).<ref name="Peto" /> Kouření se přičítá 80–90 % všech případů karcinomu plic.<ref name="Harrison" /> |
|||
U nekuřáků je příčinou vzniku karcinomu plic [[pasivní kouření]] - vdechování kouře vznikajícího při kouření jiných osob. Jako pasivního kuřáka lze označit člověka, který žije nebo pracuje v blízkosti kuřáka. Studie provedené ve Spojených státech,<ref name="AUTOREF7">{{Cite journal | last=California Environmental Protection Agency | title=Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency |journal=Tobacco Control | volume=6 | issue=4 | pages=346–353 |year=1997 | url=http://www.druglibrary.org/schaffer/tobacco/caets/ets-main.htm | pmid=9583639 | doi=10.1136/tc.6.4.346 |pmc=1759599 }}<br />* {{Cite journal | last=CDC | authorlink=Centers for Disease Control and Prevention | title=State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000 | journal=Morbidity and Mortality Weekly Report | volume=50 | issue=49 | pages=1101–1106 | publisher=CDC|location=Atlanta, Georgia| month=December | year=2001 | url=http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5049a1.htm |pmid=11794619 | author1=Centers for Disease Control and Prevention (CDC) }}</ref><ref name="Alberg">{{Cite journal |last=Alberg | first=AJ | coauthors=Samet JM | title=Epidemiology of lung cancer | journal=Chest | volume=132 | issue=S3 |pages=29S–55S | publisher=American College of Chest Physicians | month=September | year=2007 |url=http://chestjournal.chestpubs.org/content/132/3_suppl/29S.long | pmid=17873159 | doi=10.1378/chest.07-1347 }}</ref>Evropě,<ref>{{Cite journal | last=Jaakkola | first=MS | coauthors=Jaakkola JJ | title=Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention |journal=European Respiratory Journal | volume=28 |issue=2 | pages=397–408 | year=2006 | month=August | url=http://erj.ersjournals.com/content/28/2/397.long | pmid=16880370| doi=10.1183/09031936.06.00001306 }}</ref> Spojeném království<ref>{{Cite journal | last=Parkin | first=DM |title=Tobacco—attributable cancer burden in the UK in 2010 | journal=British Journal of Cancer | volume=105 | issue=Suppl. 2 | pages=S6–S13 | month=December | year=2011 | pmid=22158323 | doi=10.1038/bjc.2011.475 |url=http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3252064/?tool=pubmed | pmc=3252064}}</ref> a v Austrálii<ref name="NHMRC" /> konzistentně prokázaly značně zvýšené riziko vzniku rakoviny u osob vystavených pasivnímu kouření.<ref name="Taylor">{{Cite journal | last=Taylor | first=R | coauthors=Najafi F, Dobson A | title=Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent |journal=International Journal of Epidemiology | volume=36 | issue=5 |pages=1048–1059 | year=2007 | month=October | url=http://ije.oxfordjournals.org/content/36/5/1048.long | pmid=17690135 |doi=10.1093/ije/dym158 }}</ref> U těch, kdo žijí s kuřákem, je riziko vyšší asi o 20–30 %, zatímco u osob, které pracují v prostředí ovlivňovaném kouřem z cigaret jiných lidí, je riziko vyšší o 16–19 %.<ref>{{cite web|title=Frequently asked questions about second hand smoke|url=http://www.who.int/tobacco/research/secondhand_smoke/faq/en/index.html|work=World Health Organization|accessdate=25 July 2012}}</ref> Výzkum vlivu [[postranního proudu kouře]] naznačuje, že tento kouř je ještě nebezpečnější než kouř přímo vdechovaný kuřákem.<ref name="Schick" /> Ve Spojených státech je pasivní kouření příčinou přibližně 3 400 úmrtí na karcinom plic ročně.<ref name="Alberg" /> |
|||
===Radon=== |
|||
[[Radon]] je [[plyn]] bez barvy a zápachu vznikající rozpadem radioaktivního [[rádia]], které je pro změnu produktem rozpadu [[uranu]] vyskytujícího se v zemské [[kůra (geologie)|kůře]]. Produkty rozpadu radioaktivních látek [[ionizují]] genetický materiál a způsobují mutace, které se někdy stávají rakovinnými. Po kouření je radon druhou nejběžnější příčinou karcinomu plic ve Spojených státech.<ref name="Alberg" /> S každými 100 [[becquerel|becquerely]]/[[kubický metr|m³]] koncentrace radonu se riziko zvyšuje o 8-16 %.<ref>{{cite journal |author=Schmid K, Kuwert T, Drexler H |title=Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine |journal=Dtsch Arztebl Int |volume=107|issue=11 |pages=181–6 |year=2010 |month=March |pmid=20386676 |pmc=2853156 |doi=10.3238/arztebl.2010.0181 |url=}}</ref>Množství radonu se liší v závislosti na lokalitě a složení půdy a hornin v podloží. Například v oblastech, jako je [[Cornwall]] ve Spojeném království (kde je [[žulové]] podloží), je radon velkým problémem. Pro snížení koncentrace radonu musí být budovy uměle větrány. Americká [[Agentura pro ochranu životního prostředí]] (EPA) odhaduje, že v jednom z 15 domů ve Spojených státech je hladina radonu vyšší než je doporučený limit 4 [[pikocurie]] na litr (pCi/l) (148 Bq/m³).<ref name="EPA radon" /> |
|||
===Azbest=== |
|||
[[Azbest]] může způsobit řadu onemocnění plic, včetně karcinomu plic. Kouření tabáku a vystavení azbestu má na tvorbu karcinomu plic [[synergie|synergický]] efekt.<ref name="O'Reilly" /> Azbest může rovněž způsobit rakovinu [[pohrudnice]], která se nazývá [[mezoteliom]] (a která se od karcinomu plic liší).<ref>{{Cite book | last=Davies | first=RJO |coauthors=Lee YCG | title=Oxford Textbook Medicine | publisher=OUP Oxford | year=2010 | chapter=18.19.3 | edition=5th |isbn=978-0199204854 }}</ref> |
|||
===Znečištění vzduchu=== |
|||
Znečištění vzduchu má na zvýšení rizika karcinomu plic malý účinek.<ref name="MurrayNadel46">{{Cite book |author=Alberg AJ, Samet JM | title=Murray & Nadel's Textbook of Respiratory Medicine | publisher=Saunders Elsevier |year=2010 | chapter=Chapter 46 | edition=5th | isbn=978-1-4160-4710-0 }}</ref> Jemné [[Částice pevných látek v atmosféře|částice]] (PM<sub>2,5</sub>) a [[stratosférické aerosoly kyseliny sírové|sulfátové aerosoly]], které se mohou dostávat do ovzduší ve výfukových plynech, jsou spojovány s mírně zvýšeným rizikem.<ref name="MurrayNadel46" /><ref>{{cite journal |last=Chen | first=H | coauthors=Goldberg MS, Villeneuve PJ | journal=Reviews on Environmental Health | year=2008 |month=Oct-Dec | volume=23 |issue=4 | pages=243–297 | title=A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases | pmid=19235364 }}</ref> U [[oxidu dusičitého]] každý přírůstek 10 [[částic na jednu miliardu částic vzduchu]] zvyšuje riziko karcinomu plic o 14 %.<ref>{{cite journal | last=Clapp | first=RW |coauthors=Jacobs MM, Loechler EL | journal=Reviews on Environmental Health | year=2008 | month=Jan-Mar | volume=23|issue=1 | pages=1–37 | title=Environmental and Occupational Causes of Cancer New Evidence, 2005–2007 | pmid=18557596 |url=http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2791455/?tool=pubmed | pmc=2791455}}</ref> Znečištění vzduchu se připisuje 1–2 % případů karcinomu plic.<ref name="MurrayNadel46" /> |
|||
Předběžné důkazy podporují hypotézu zvýšeného rizika vzniku karcinomu plic v důsledku [[znečištění vzduchu v interiéru]] v souvislosti se spalováním dřeva, uhlí, zvířecího trusu nebo zbytků rostlin při vaření nebo topení.<ref name=Lim2012>{{cite journal|last=Lim|first=WY|coauthors=Seow, A|title=Biomass fuels and lung cancer.|journal=Respirology (Carlton, Vic.)|date=2012 Jan|volume=17|issue=1|pages=20-31|pmid=22008241}}</ref> U žen, které jsou v interiéru vystaveny kouři z uhlí, je riziko přibližně dvojnásobné; řada vedlejších produktů spalování [[biomasy]] je známými nebo domnělými karcinogeny.<ref name=Sood2012/> Toto riziko se týká přibližně 2,4 miliardy lidí na celém světě<ref name=Lim2012/> a má se za to, že stojí za 1,5 % úmrtí na karcinom plic.<ref name=Sood2012>{{cite journal|last=Sood|first=A|title=Indoor fuel exposure and the lung in both developing and developed countries: an update.|journal=Clinics in chest medicine|date=2012 Dec|volume=33|issue=4|pages=649-65|pmid=23153607}}</ref> |
|||
===Genetika=== |
|||
Odhaduje se, že 8 až 14 % případů karcinomu plic je způsobeno [[dědičnost|dědičnými]] faktory.<ref>{{cite book|last=Dudley|first=Joel|title=Exploring Personal Genomics|year=2013|publisher=Oxford University Press|isbn=9780199644483|page=25|url=http://books.google.ca/books?id=arCnThIq9LcC&pg=PA25}}</ref> U osob příbuzných nemocnému s karcinomem plic je riziko 2,4 krát vyšší. Je tomu tak pravděpodobně v důsledku [[genetický polymorfismus|kombinace genů]].<ref name="Fishman1802">{{Cite book | author=Kern JA, McLennan G | title=Fishman's Pulmonary Diseases and Disorders |publisher=McGraw-Hill | year=2008 | page=1802 | edition=4th | isbn=0-07-145739-9 }}</ref> |
|||
===Další příčiny=== |
|||
S karcinomem plic je spojována řada dalších látek, povolání a vystavení vlivům okolního prostředí. [[Mezinárodní agentura pro výzkum rakoviny]] (IARC) uvádí, že existují „dostatečné důkazy“ pro to, že přítomnost následujících látek v plicích je karcinogenní:<ref name='WHOListLungCancer'>{{cite journal|last=Cogliano|first=VJ|coauthors=Baan, R; Straif, K; Grosse, Y; Lauby-Secretan, B; El Ghissassi, F; Bouvard, V; Benbrahim-Tallaa, L; Guha, N; Freeman, C; Galichet, L; Wild, CP|title=Preventable exposures associated with human cancers.|journal=Journal of the National Cancer Institute|date=2011 Dec 21|volume=103|issue=24|pages=1827-39|pmid=22158127|url=http://monographs.iarc.fr/ENG/Classification/Table4.pdf}}</ref> |
|||
*Některé kovy (výroba hliníku, [[kadmium]] a sloučeniny kadmia, sloučeniny [[chromu]] (VI), [[berylium]] a sloučeniny berylia, železné a ocelové slitiny, sloučeniny niklu, [[arsen]] a anorganické sloučeniny arsenu, podzemní těžba [[hematitu]]) |
|||
*Některé produkty spalování (nedokonalé spalování, uhlí (emise ze spalování uhlí v domácnostech), uhelné plyny, černouhelná smůla, [[Koks (palivo)|výroba koksu]], saze, výfukové plyny z naftových motorů) |
|||
* Ionizující záření (rentgen, radon 222 a produkty jeho rozpadu, [[gama záření]], [[plutonium]]) |
|||
* Některé toxické plyny (metyléter (technický stupeň čistoty), bis(chlormetyl)éter, [[yperit]], MOPP ([[Mustargen-Oncovin-Procarbazin-Prednison|směs vinkristin-prednison-dusíkatý yperit-prokarbazin]]), výpary z nátěrů) |
|||
* Výroba pryže a krystalický [[Oxid křemičitý|křemenný prach]] |
|||
==Patogeneze== |
|||
Podobně jako u mnoha dalších typů rakoviny začíná karcinom plic aktivací [[onkogenů]] nebo deaktivací [[genů bránících vzniku tumoru]].<ref name="Fong" /> Má se za to, že onkogeny činí člověka náchylnějším k rozvoji rakoviny, a zdá se, že [[protoonkogeny]] se po vystavení působení konkrétních karcinogenů mění právě na onkogeny.<ref name="Salgia" /> [[Mutace]] protoonkogenu ''[[Ras (protein)|K-ras]]'' způsobují 10–30 % případů adenokarcinomu plic.<ref name="NEJM-molecular" /><ref name="Aviel-Ronen" /> [[Receptor pro epidermální růstový faktor]] (EGFR) reguluje množení buněk, [[apoptózu]], [[angiogenezi]] a invazi tumoru.<ref name="NEJM-molecular" /> Mutace a zvětšení receptorů EGFR jsou běžné u nemalobuněčného karcinomu plic a představují základ pro léčbu pomocí inhibitorů EGFR. Receptor [[Her2/neu]] je postihován méně častěji.<ref name="NEJM-molecular" /> Poškození [[Chromozom|chromozomů]] může vést ke [[ztrátě heterozygozity]], a tedy potenciálně k deaktivaci genů zabraňujících vzniku tumoru. Pro malobuněčný karcinom plic je běžné poškození zejména chromozomů 3p, 5q, 13q a 17p. Gen ''[[p53]]'', který zabraňuje vzniku tumoru a který se nachází na chromozomu 17p, je postihován v 60-75 % případů.<ref name="Devereux" /> Mezi další geny, k jejich mutaci či změnám často dochází, patří ''[[c-MET]]'', ''[[NKX2-1]]'',''[[LKB1]]'', ''[[PIK3CA]]'' a ''[[BRAF (gene)|BRAF]]''.<ref name="NEJM-molecular" /> |
|||
==Diagnóza== |
|||
[[Image:Thorax CT peripheres Brronchialcarcinom li OF.jpg|thumb|[[CT snímek]] ukazující rakovinný tumor v levé plíci]] |
|||
Provedení [[rentgenu hrudníku]] je jedním z prvních kroků při vyšetření osoby trpící symptomy, jež by mohly naznačovat karcinom plic. Může odhalit přítomnost tumoru, rozšíření [[mezihrudí]] (naznačující, že tumor napadl [[lymfatické uzliny]]), [[atelektázu]] (kolaps), konsolidaci plic ([[pneumonii]]) nebo [[pleurální efuzi]].<ref name="Merck" /> Ke zjištění detailnějších informací o typu a rozsahu onemocnění se typicky používá [[Rentgenová počítačová tomografie|CT snímkování]]. [[Bronchoskopie]] nebo CT snímkováním řízená [[biopsie]] často slouží k odebrání vzorku tumoru pro účely [[histopatologie]].<ref name="Collins" /> |
|||
Rakovina plic se na rentgenu hrudníku často objevuje jako [[solitární plicní uzel]]. [[Diferenciální diagnostika]] však uvádí řadu dalších onemocnění s podobným symtomem. Stejný příznak může způsobit i [[tuberkulóza]], plísňové infekce, metastatická rakovina nebo [[organizující se pneumonie]]. Mezi méně běžné příčiny solitárního plicního uzlu patří [[hamartomy]], [[bronchogenní cysty]], [[adenomy]], [[arteriovenózní malformace]], [[plicní sekvestrace]], [[revmatoidní uzlíky]], [[Wegenerova granulomatóza]] nebo [[lymfom]].<ref>{{Cite book | last=Miller |first=WT | title=Fishman's Pulmonary Diseases and Disorders | publisher=McGraw-Hill | year=2008 | page=486 | edition=4th | isbn=0-07-145739-9 }}</ref> Karcinom plic může být odhalen i [[incidentalom|náhodně]] jako solitární plicní uzel na rentgenovém nebo CT snímku hrudníku pořízeném pro jiný, nesouvisející účel.<ref name="Fishman1815">{{Cite book | last=Kaiser | first=LR | title=Fishman's Pulmonary Diseases and Disorders | publisher=McGraw-Hill | year=2008 | pages=1815–1816 | edition=4th | isbn=0-07-145739-9 }}</ref>Definitivní diagnóza karcinomu plic se stanovuje na základě [[histopatologie|histologického]] vyšetření podezřelé tkáně z hlediska klinického a radiologického.<ref name="Harrison" /> |
|||
===Klasifikace=== |
|||
{| class="wikitable floatright" style="text-align:center;font-size:90%;width:45%;margin-left:1em" |
|||
|+ style="background:#E5AFAA;"|'''[[incidence (epidemiologie)|Počet případů]] karcinomu plic podle histologického typu v závislosti na věku'''<ref name="MurrayNadel46" /> |
|||
|- style="background: #E5AFAA;text-align:center;font-size:90%;" |
|||
! abbr="Type" | Histologický ytp |
|||
! abbr="Frequency" | Počet případů na 100 000 osob a rok |
|||
|- |
|||
| Všechny typy |
|||
| 66,9 |
|||
|- |
|||
| Adenokarcinom |
|||
| 22,1 |
|||
|- |
|||
| Spinocelulární karcinom |
|||
| 14,4 |
|||
|- |
|||
| Malobuněčný karcinom |
|||
| 9,8 |
|||
|} |
|||
Karcinomy plic jsou klasifikovány podle [[histopatologie|histologického typu]].<ref name="Holland-Frei78" /> Tato klasifikace je důležitá pro určení způsobu léčby a předvídání dalšího vývoje nemoci. V naprosté většině případů rakoviny plic se jedná o [[karcinomy]]—zhoubné bujení buněk [[epitelové tkáně]]. Karcinomy plic se rozdělují do kategorií podle velikosti a vzhledu buněk zhoubné tkáně tak, jak ji pod [[mikroskopem]] vidí histopatolog. Dvěma hlavními skupinami jsou nemalobuněčné a malobuněčné karcinomy plic.<ref name="Robbins" /> |
|||
====Nemalobuněčný karcinom plic==== |
|||
[[Image:Squamous carcinoma lung 2 cytology.jpg|thumb|left|[[Mikroskopický snímek]] [[spinocelulárního karcinomu]], typu nemalobuněčného karcinomu, [[vzorek získaný aspirační biopsií tenkou jehlou]], [[Papanicolauovo barvení]]]] |
|||
Třemi hlavními podtypy nemalobuněčného karcinomu plic jsou [[adenokarcinom]], [[spinocelulární karcinom plic]] a [[velkobuněčný karcinom plic]].<ref name="Harrison" /> |
|||
Téměř 40 % karcinomů plic jsou adenokarcinomy, které obvykle vznikají v okrajové plicní tkáni.<ref name="Holland-Frei78">{{cite book | last=Lu | first=C | coauthors=Onn A, Vaporciyan AA et al. | title=Holland-Frei Cancer Medicine |edition=8th | chapter=78: Cancer of the Lung | publisher=People's Medical Publishing House | year=2010 |isbn=9781607950141}}</ref> Většina případů adenokarcinomů souvisí s kouřením, avšak i u osob, které za svůj život vykouřily méně než 100 cigaret (a lze je tak označit za „nekuřáky“),<ref name="Harrison" /> je adenokarcinom nejběžnější formou rakoviny plic.<ref name="Subramanian">{{cite journal | last=Subramanian | first=J | coauthors=Govindan R |title=Lung cancer in never smokers: a review | journal=Journal of Clinical Oncology | volume=25 | issue=5 | pages=561–570| publisher=American Society of Clinical Oncology | month=February | year=2007 | pmid=17290066 |doi=10.1200/JCO.2006.06.8015 }}</ref> Podtyp adenokarcinomu označovaný jako [[bronchioloalveolární karcinom]] je obvyklejší u žen-nekuřaček a je spojován s delší pravděpodobnou dobou přežití.<ref name="Raz"/> |
|||
Spinocelulární karcinom stojí za přibližně 30 % případů rakoviny plic. Tento typ karcinomu se typicky objevuje v blízkosti velkých cest dýchacích. Ve středu tumoru se obvykle nachází dutina a [[nekróza|mrtvá tkáň]].<ref name="Holland-Frei78" />Přibližně 9 % rakoviny plic jsou velkobuněčné karcinomy. Jsou tak pojmenovány proto, že buňky karcinomu jsou velké, s množstvím [[cytoplazmy]], velkými [[buněčné jádro|jádry]] a nápadnými [[jadérko|jadérky]].<ref name="Holland-Frei78" /> |
|||
====Malobuněčný karcinom plic==== |
|||
[[Image:Lung small cell carcinoma (1) by core needle biopsy.jpg|thumb|left|Malobuněčný karcinom plic (mikroskopický pohled při biopsii dutou jehlou)]] |
|||
V případě [[malobuněčných karcinomů plic]] (SCLC) buňky obsahují kompaktní neurosekreční granula ([[váček (biologie)|váčky]] naplněné [[neuroendokrinními]] [[hormony]]), které by u tohoto tumoru mohly naznačovat souvislost s endokrinním/paraneoplastickým syndromem.<ref name="Rosti" /> Ve většině případů se karcinomy objevují ve velkých cestách dýchacích (primární a sekundární [[průduška|průdušky]]).<ref name="Collins" />Tyto typy karcinomu rychle rostou a šíří se již v rané fázi onemocnění. V šedesáti až sedmdesáti procentech případů u nich dochází k metastázím. Tento typ rakoviny plic velmi významně souvisí s kouřením.<ref name="Harrison" /> |
|||
====Další typy karcinomu==== |
|||
Rozeznáváme čtyři hlavní histologické podtypy, ačkoli některé karcinomy mohou být tvořeny kombinací různých podtypů.<ref name=Robbins>{{cite book | last=Maitra | first=A | coauthors=Kumar V | year=2007 | title=Robbins Basic Pathology|edition=8th | publisher=Saunders Elsevier | pages=528–529 | isbn=978-1-4160-2973-1 }}</ref> Mezi vzácné podtypy patří [[Rakovina slinných žláz|nádory žláz]], [[plicní karcinoid|karcinoidní tumory]] a nediferencované karcinomy.<ref name="Harrison" /> |
|||
====Šíření metastáz==== |
|||
{| class="wikitable floatright" style="text-align:center;font-size:90%;width:45%;margin-left:1em" |
|||
|+ style="background:#E5AFAA;"|'''Typické [[imunozbarvení]] karcinomu plic'''<ref name="Harrison" /> |
|||
|- style="background: #E5AFAA;text-align:center;font-size:90%;" |
|||
! abbr="Type" | Histologický ytp |
|||
! abbr="Frequency" | Imunozbarvení |
|||
|- |
|||
| Spinocelulární karcinom |
|||
| [[Cytokeratin|CK]]5/6 pozitivní <br>[[Keratin 7|CK7]] negativní |
|||
|- |
|||
| Adenokarcinom |
|||
| CK7 pozitivní <br>[[NK2 homeobox 1|TTF-1]] pozitivní |
|||
|- |
|||
| Velkobuněčný karcinom |
|||
| TTF-1 negativní |
|||
|- |
|||
| Malobuněčný karcinom |
|||
| TTF-1 pozitivní <br>[[Neurální adhezivní molekula|CD56]] pozitivní <br>[[Granin|Chromogranin]] pozitivní<br>[[Synaptofyzin]] pozitivní |
|||
|} |
|||
Plíce jsou místem, kam se běžně rozšiřují tumory z jiných částí těla. Sekundární karcinomy jsou klasifikovány podle místa jejich vzniku; například karcinom prsu, který se rozšířil do plic, se nazývá metastatický karcinom prsu. Na rentgenovém snímku mají metastázy často charakteristický zakulacený vzhled.<ref name="Seo" /> |
|||
Primární karcinomy plic nejběžněji metastázují do mozku, kostí, jater a [[nadledvinek]].<ref name="Holland-Frei78" /> [[Imunozbarvení]] během biopsie je často užitečné pro určení původního zdroje.<ref name="pmid18784820">{{cite journal |author=Tan D, Zander DS |title=Immunohistochemistry for Assessment of Pulmonary and Pleural Neoplasms: A Review and Update |journal=Int J Clin Exp Pathol |volume=1 |issue=1 |pages=19–31|year=2008|pmid=18784820 |pmc=2480532 }}</ref> |
|||
===Klasifikace stádií=== |
|||
[[Klasifikace stádií karcinomu]] plic je posouzení stádia rozšíření karcinomu z jeho původního zdroje. Je jedním z faktorů ovlivňujících [[prognózu]] a potenciální způsob léčby karcinomu plic.<ref name="Harrison" /> |
|||
Počáteční vyhodnocení stádia nemalobuněčného karcinomu plic (NSCLC) využívá [[TNM klasifikace|klasifikaci TNM]]. Ta je založena na velikosti primárního '''t'''umoru, postižení lymfatických uzlin (lymph '''n'''ode) a vzdálenosti '''m'''etastáz. Poté je za využití těchto TNM deskriptorů karcinom zařazen do jedné ze skupin - od okultní (skryté) fáze karcinomu až po stádia 0, IA (jedna A), IB, IIA, IIB, IIIA, IIIB a IV (čtyři). Toto rozdělení stádií do skupin napomáhá určení způsobu léčby a odhadu prognózy.<ref name="Rami-Porta">{{Cite journal | last=Rami-Porta | first=R | coauthors=Crowley JJ, Goldstraw P | title=The revised TNM staging system for lung cancer | journal=Annals of Thoracic and Cardiovascular Surgery | volume=15 | issue=1 | pages=4–9 |month=February | year=2009 | url=http://www.atcs.jp/pdf/2009_15_1/4.pdf | pmid=19262443 }}</ref> |
|||
Malobuněčné karcinomy plic (SCLC) jsou tradičně klasifikovány jako karcinomy „nepokročilého stádia“ (rozšíření pouze do poloviny hrudníku a v rozsahu jednoho radiačního pole s využitím [[radioterapie]] únosného stupně) nebo jako karcinomy „pokročilého stádia“ (výraznější rozšíření onemocnění).<ref name="Harrison" /> I tak je ale klasifikace TNM a zařazení do jedné ze skupin užitečné při odhadu prognózy.<ref name="Rami-Porta" /> |
|||
V případě NSCLC i SCLC jsou dvěma hlavními hledisky posouzení pokročilosti nemoci klinická a chirurgická klasifikace stádia. Klinická klasifikace stádia se provádí před samotným chirurgickým zákrokem. Je založena na výsledcích snímkování (například [[Rentgenová počítačová tomografie|CT snímky]] a [[pozitronová emisní tomografie|PET snímky]]) a na výsledcích biopsie. Chirurgická klasifikace stádia je vyhodnocena během operace nebo po ní a základem pro ni jsou kombinované výsledky chirurgických a klinických nálezů včetně chirurgicky odebraného vzorku hrudních lymfatických uzlin.<ref name="Holland-Frei78" /> |
|||
==Prevence== |
|||
Prevence je z hlediska nákladů nejefektivnějším prostředkem ke snižování počtu případů karcinomu plic. Ačkoli ve většině zemí byly karcinogeny v domácím i průmyslovém prostředí identifikovány a zakázány, kouření tabáku je stále velmi rozšířené. Eliminace kouření tabáku je primárním cílem prevence rakoviny plic a [[skoncování s kouřením]] je v rámci tohoto procesu důležitým nástrojem prevence.<ref>{{cite journal | last=Goodman | first=GE | title=Lung cancer. 1: prevention of lung cancer | journal=Thorax |volume=57 | issue=11 | year=2002 | month=November | pages=994–999 |url=http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1746232/pdf/v057p00994.pdf | pmid=12403886 | pmc=1746232}}</ref> |
|||
Opatření a zásahy k omezení [[pasivního kouření]] na veřejných místech, například v restauracích a na pracovištích, jsou nyní běžné v mnoha západních zemích.<ref>{{cite journal | last=McNabola | first=A | coauthors=Gill LW | title=The control of environmental tobacco smoke: a policy review | journal=International Journal of Environmental Research and Public Health |volume=6 | issue=2 | year=2009 | month=February | pages=741–758 | doi=10.3390/ijerph6020741 | pmid=19440413 |pmc=2672352}}</ref> [[Bhútán]] zavedl úplný zákaz kouření v roce 2005,<ref name="Bhutan" /> Indie uplatňuje zákaz kouření na veřejných místech od října 2008.<ref>{{cite news | last=Pandey | first=G | title=Indian ban on smoking in public |url=http://news.bbc.co.uk/1/hi/world/south_asia/7645868.stm | publisher=[[BBC]] | date=2 October 2008 | accessdate=2012-04-25 }}</ref> [[Světová zdravotnická organizace]] vyzývá vlády, aby prosadily úplný zákaz reklamy tabákových výrobků, aby mladí lidé s kouřením vůbec nezačínali. Tato organizace soudí, že tam, kde byl tento zákaz zaveden, spotřeba tabákových výrobků klesla o 16 %.<ref name="AUTOREF10">{{Cite press release |title=UN health agency calls for total ban on tobacco advertising to protect young |url=http://www.un.org/apps/news/story.asp?NewsID=26857 |publisher=[[United Nations]] News service |date=30 May 2008}}</ref> |
|||
Dlouhodobé užívání doplňkového vitaminu A,<ref name="Fabricius">{{cite journal | last=Fabricius | first=P |coauthors=Lange P | title=Diet and lung cancer | journal=Monaldi Archives for Chest Disease | volume=59 | issue=3 |year=2003 | month=July–September | pages=207–211 | pmid=15065316 }}</ref><ref>{{Cite journal | last=Fritz | first=H |coauthors=Kennedy D, Fergusson D et al. | title=Vitamin A and Retinoid Derivatives for Lung Cancer: A Systematic Review and Meta Analysis | journal=PLoS ONE | volume=6 | issue=6 | year=2011 | page=e21107 | pmid=21738614 |doi=10.1371/journal.pone.0021107 | pmc=3124481}}</ref> vitaminu C,<ref name="Fabricius" /> vitaminu D<ref>{{cite journal |last=Herr | first=C | coauthors=Greulich T, Koczulla RA et al. | title=The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer | journal=Respiratory Research | volume=12 | issue=1 | year=2011 | month=March | page=31 |doi=10.1186/1465-9921-12-31 | pmid=21418564 | pmc=3071319}}</ref> nebo vitaminu E<ref name="Fabricius" /> riziko vzniku rakoviny plic nesnižuje. Na základě některých studií se zdá, že pro lidi, kteří konzumují v potravě vyšší množství zeleniny a ovoce, je obvyklé nižší riziko onemocnění rakovinou,<ref name="Alberg" /><ref name="Key">{{cite journal | last=Key | first=TJ | title=Fruit and vegetables and cancer risk | journal=British Journal of Cancer | volume=104 | issue=1 | year=2011 | month=January | pages=6–11 |doi=10.1038/sj.bjc.6606032 | pmid=21119663 | pmc=3039795}}</ref> to je však pravděpodobně výsledek [[zavádějících faktorů]]. Preciznější studie jasnou souvislost neprokázaly.<ref name="Key" /> |
|||
===Screening=== |
|||
[[Screening (medicína)|Screening]] je využití [[lékařských vyšetření]] s cílem rozpoznat jistou chorobu u osob bez symptomů. Lékařská vyšetření, s jejichž pomocí lze rakovinu plic určit, zahrnují [[cytopatologie|cytologické vyšetření]] [[sputa]], [[rentgen plic]] (RTG plic) a [[počítačovou tomografii]] (CT). Screeningové programy využívající RTG plic nebo cytologické vyšetření neprokázaly podstatný přínos.<ref>{{Cite journal |last=Manser | first=RL | coauthors=Irving LB, Stone C et al. | title=Screening for lung cancer | journal=Cochrane Database of Systematic Reviews | issue=1 | pages=CD001991 | year=2004 | pmid=14973979 |url=http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD001991.pub2/full | doi=10.1002/14651858.CD001991.pub2 }}</ref> Každoroční vyšetření osob podléhajících vysokému riziku (tedy ve věku 55 až 79 let, které kouřily více než 30 [[balíčkoroků]] nebo které v minulosti trpěly rakovinou plic) pomocí CT snímkování o snížených dávkách záření může snížit riziko úmrtí na rakovinu plic o [[Snížení absolutního rizika|absolutní hodnotu]] 0,3 % ([[Snížení relativního rizika|relativní hodnota]] 20 %).<ref>{{cite journal |last=Jaklitsch | first=MT | coauthors=Jacobson FL, Austin JH et al. | title=The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups | journal=Journal of Thoracic and Cardiovascular Surgery | month=July | year=2012 | volume=144 | issue=1 |pages=33–38 | pmid=22710039 | doi=10.1016/j.jtcvs.2012.05.060}}</ref><ref>{{cite journal | last=Bach | first=PB |coauthors=Mirkin JN, Oliver TK et al. | title=Benefits and harms of CT screening for lung cancer: a systematic review |journal=JAMA: the Journal of the American Medical Association | month=June | year=2012 | volume=307 | issue=22 |pages=2418–2429 | pmid=22610500 | doi=10.1001/jama.2012.5521}}</ref> Počet falešně pozitivních CT snímků je však značný a může vyústit v řadu nepotřebných invazivních zákroků i značné finanční náklady.<ref>{{cite journal|last=Boiselle|first=PM|title=Computed tomography screening for lung cancer.|journal=JAMA : the journal of the American Medical Association|date=2013 Mar 20|volume=309|issue=11|pages=1163-70|pmid=23512063}}</ref> Na každý skutečně pozitivní snímek připadá více než 19 falešně pozitivních.<ref>{{cite journal |author=Bach PB, Mirkin JN, Oliver TK, ''et al.''|title=Benefits and harms of CT screening for lung cancer: a systematic review |journal=JAMA |volume=307 |issue=22|pages=2418–29 |year=2012 |month=June |pmid=22610500 |doi=10.1001/jama.2012.5521 |url=}}</ref> Dalším potenciálním rizikem je vystavení pacientů záření během CT snímkování.<ref>{{cite journal|last=Aberle|first=DR|coauthors=Abtin, F; Brown, K|title=Computed tomography screening for lung cancer: has it finally arrived? Implications of the national lung screening trial.|journal=Journal of clinical oncology : official journal of the American Society of Clinical Oncology|date=2013 Mar 10|volume=31|issue=8|pages=1002-8|pmid=23401434}}</ref> |
|||
==Léčba== |
|||
Léčba rakoviny plic závisí na specifickém typu rakovinných buněk, [[stanovení pokročilosti rakoviny|pokročilosti]] onemocnění a na tom, jaký je [[celkový fyzický stav]] nemocného. Běžné léčebné postupy zahrnují [[paliativní péči]],<ref>{{cite journal | last=Ferrell |first=B | coauthors=Koczywas M, Grannis F, Harrington A | title=Palliative care in lung cancer | journal=Surgical Clinics of North America | volume=91 | issue=2 | pages=403–417 | year=2011 | month=April | pmid=21419260 |doi=10.1016/j.suc.2010.12.003}}</ref> [[chirurgický zákrok]], [[chemoterapii]] a [[radioterapii]].<ref name="Harrison" /> |
|||
===Chirurgický zákrok=== |
|||
[[Image:Lung cancer.jpg|thumb|Preparát získaný [[pneumonektomií]] vykazující [[spinocelulární karcinom]], viditelný jako bílá oblast v blízkosti průdušky]] |
|||
Pokud vyšetření potvrdí nemalobuněčný karcinom plic, musí být posouzena [[stanovení pokročilosti rakoviny|fáze pokročilosti]] rakoviny, aby bylo možno určit, zda je onemocnění lokalizováno a řešitelné operací či zda se natolik rozšířilo, že operativní zákrok by již neměl smysl. K tomu se využívá počítačová tomografie a [[pozitronová emisní tomografie]].<ref name="Harrison" /> Pokud existuje podezření, že jsou zasaženy i mezihrudní lymfatické uzliny, lze pro odebrání vzorků z uzlin a stanovení pokročilosti nemoci využít [[mediastinoskopii]].<ref name="Fishman1853">{{Cite book |author=Kaiser LR | title=Fishman's Pulmonary Diseases and Disorders | publisher=McGraw-Hill | year=2008 | pages=1853–1854| edition=4th | isbn=0-07-145739-9 }}</ref> K posouzení skutečnosti, zda je nemocný schopen operaci podstoupit, se využívají i [[rozbory krve]] a [[vyšetření funkce plic]].<ref name="Collins" /> Pokud vyšetření plic odhalí slabou respirační rezervu, chirurgický zákrok pravděpodobně nebude vhodným řešením.<ref name="Harrison" /> |
|||
Ve většině případů raného nemalobuněčného karcinomu plic se upřednostňuje odstranění plicního laloku ([[lobektomie]]). U těch osob, jejichž celkový stav nedovoluje lobektomii celého laloku, lze provést resekci menšího rozsahu ([[klínovitá resekce]]). U tohoto typu resekce však existuje vyšší riziko recidivy rakoviny než u lobektomie.<ref name="Fishman1855">{{Cite book | author=Kaiser LR |title=Fishman's Pulmonary Diseases and Disorders | publisher=McGraw-Hill | year=2008 | pages=1855–1856 | edition=4th |isbn=0-07-145739-9 }}</ref> Radioaktivní [[brachyterapie]] [[jodovými zrny]] v okrajových oblastech klínovité excize může riziko recidivy snížit.<ref>{{cite journal | last=Odell | first=DD | coauthors=Kent MS, Fernando HC | title=Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer | journal=Seminars in Thoracic and Cardiovascular Surgery |volume=22 | issue=1 | pages=32–37 | year=2010 | month=Spring | pmid=20813314 | doi=10.1053/j.semtcvs.2010.04.003}}</ref>Velmi zřídka se provádí odstranění celé plíce ([[pneumonektomie]]).<ref name="Fishman1855" /> [[Videoasistovaná torakoskopická operace]] a [[videoasistovaná lobektomie]] jsou založeny na minimálně invazivním postupu při operaci rakoviny plic.<ref>{{cite journal | last=Alam| first=N | coauthors=Flores RM | title=Video-assisted thoracic surgery (VATS) lobectomy: the evidence base |journal=Journal of the Society of Laparoendoscopic Surgeons | volume=11 | issue=3 | pages=368–374 | year=2007 |month=July–September | pmid=17931521 | pmc=3015831}}</ref> Videoasistovaná lobektomie je ve srovnání s konvenční otevřenou lobektomií stejně efektivní, navíc však není v takovém množství doprovázena postoperačními onemocněními.<ref>{{cite journal | last=Rueth | first=NM | coauthors=Andrade RS |title=Is VATS lobectomy better: perioperatively, biologically and oncologically? | journal=Annals of Thoracic Surgery |volume=89 | issue=6 | pages=S2107–S2111 | year=2010 | month=June | pmid=20493991 | doi=10.1016/j.athoracsur.2010.03.020}}</ref> |
|||
U malobuněčného karcinomu plic se obvykle používá chemoterapie a/nebo radioterapie.<ref name='SimonTurrisi'>{{cite journal |author=Simon GR, Turrisi A |title=Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition)|journal=Chest |volume=132 |issue=3 Suppl |pages=324S–339S |year=2007 |month=September |pmid=17873178|doi=10.1378/chest.07-1385 |url=http://chestjournal.chestpubs.org/content/132/3_suppl/324S.long}}</ref> Význam chirurgického zákroku pro léčbu malobuněčného karcinomu plic je však předmětem úvah. V rané fázi SCLC může operační zákrok zlepšit možné výsledky, pokud je doprovázen chemoterapií a radioterapií.<ref>{{cite journal | last=Goldstein | first=SD | coauthors=Yang SC | title=Role of surgery in small cell lung cancer | journal=Surgical Oncology Clinics of North America | volume=20 | issue=4 | pages=769–777 | year=2011 |month=October | pmid=21986271 | doi=10.1016/j.soc.2011.08.001}}</ref> |
|||
===Radioterapie=== |
|||
[[Radioterapie|Radioterapie]] neboli ozařování se často kombinuje s chemoterapií a u osob trpících NSCLS, které nemohou podstoupit chirurgický zákrok, může být kurativně cílená. Tato forma vysoce intenzivní radioterapie se nazývá radikální radioterapie.<ref name="OTO" /> Zpřesněnou formou tohoto postupu je kontinuální hyperfrakcionovaná akcelerovaná terapie (CHART), během níž je pacient vystaven vysoké dávce radioterapie v krátkém časovém úseku.<ref>{{Cite journal | last=Hatton | first=MQ| coauthors=Martin JE | title=Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer: a review and consideration of future directions| journal=Clinical Oncology (Royal College of Radiologists) | volume=22 | issue=5 | pages=356–364 | month=June | year=2010| pmid=20399629 | doi=10.1016/j.clon.2010.03.010}}</ref> Pooperační radioterapie hrudní stěny by obecně po kurativní operaci NSCLC neměla být použita,<ref name="PORT Meta-analysis Trialists Group" /> může být ale prospěšná pro nemocné, jejichž mezihrudní lymfatické uzliny N2 byly nemocí zasaženy.<ref>{{Cite journal | last=Le Péchoux | first=C |title=Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data |journal=Oncologist | volume=16 | issue=5 | pages=672–681 | year=2011 | pmid=21378080 | doi=10.1634/theoncologist.2010-0150| pmc=3228187}}</ref> |
|||
U potenciálně vyléčitelných případů malobuněčného karcinomu plic se často doporučuje radioterapie hrudníku jako doplněk k chemoterapii.<ref name="Holland-Frei78" /> |
|||
Pokud rakovinný nádor blokuje krátký úsek průdušky, může lékař použít [[brachyterapii]] (lokalizovanou radioterapii), a to přímo v dýchacích cestách, aby byla obnovena jejich průchodnost.<ref>{{Cite journal | last=Cardona | first=AF | coauthors=Reveiz L, Ospina EG et al.| title=Palliative endobronchial brachytherapy for non-small cell lung cancer | journal=Cochrane Database of Systematic Reviews | issue=2 | pages=CD004284 | month=April | year=2008 | pmid=18425900 | doi=10.1002/14651858.CD004284.pub2}}</ref>Ve srovnání s radioterapií externím paprskem umožňuje brachyterapie zkrácení doby léčby a nižší vystavení radioaktivnímu záření pro zdravotníky.<ref>{{Cite journal | last=Ikushima | first=H | title=Radiation therapy: state of the art and the future | journal=Journal of Medical Investigation | volume=57 | issue=1–2 | pages=1–11 | month=February | year=2010 |url=http://www.jstage.jst.go.jp/article/jmi/57/1,2/1/_pdf | pmid=20299738 }}</ref> |
|||
Profylaktická kraniální iradiace (PCI) je typem radioterapie mozku, užívaným ke snížení rizika vzniku [[metastáz]]. Tento léčebný postup je nejvhodnější pro malobuněčný karcinom plic. U nepokročilé fáze nemoci zvyšuje míru tříletého přežití z 15 % na 20 %; u onemocnění v pokročilém stadiu se jednoleté přežití zvyšuje z 13 % na 27 %.<ref>{{Cite journal | last=Paumier | first=A | coauthors=Cuenca X, Le Péchoux C | title=Prophylactic cranial irradiation in lung cancer | journal=Cancer Treatment Reviews | volume=37 | issue=4| pages=261–265 | month=June | year=2011 | pmid=20934256 | doi=10.1016/j.ctrv.2010.08.009}}</ref> |
|||
Nedávná zlepšení technik zacílení a zobrazování vedla ke vzniku stereotaktického ozařování při léčbě raných fází rakoviny plic. Při této formě radioterapie je pacient vystaven vysokým dávkám záření při malém počtu vyšetření za použití stereotaktických lokalizačních technik. Využívá se zejména u pacientů, kteří v důsledku [[souběžných onemocnění]] nemohou podstoupit chirurgický zákrok.<ref>{{Cite journal | last=Girard | first=N | coauthors=Mornex F | title=Stereotactic radiotherapy for non-small cell lung cancer: From concept to clinical reality. 2011 update | journal=Cancer Radiothérapie | volume=15 |issue=6–7 | pages=522–526 | month=October | year=2011 | pmid=21889901 | doi=10.1016/j.canrad.2011.07.241}}</ref> |
|||
Ke kontrole symptomů u pacientů trpících nemalobuněčným i malobuněčným karcinomem plic lze využít ozařování hrudníku v menších dávkách ([[paliativní péče|paliativní]] radioterapie).<ref>{{Cite journal | last=Fairchild | first=A | coauthors=Harris K, Barnes E et al. |title=Palliative thoracic radiotherapy for lung cancer: a systematic review | journal=Journal of Clinical Oncology |volume=26 | issue=24 | pages=4001–4011 | month=August | year=2008 | pmid=18711191 |url=http://jco.ascopubs.org/content/26/24/4001.full | doi=10.1200/JCO.2007.15.3312}}</ref> |
|||
===Chemoterapie=== |
|||
Nasazení léčby [[chemoterapií]] závisí na typu nádoru.<ref name="Holland-Frei78" /> Malobuněčný karcinom plic (SCLC), a to i relativně raná fáze nemoci, se léčí především chemoterapií a radioterapií.<ref>{{cite journal |author=Hann CL, Rudin CM |title=Management of small-cell lung cancer: incremental changes but hope for the future |journal=Oncology (Williston Park)|date=2008-11-30|volume=22|issue=13|pages=1486–92 |pmid=19133604}}</ref> U malobuněčného karcinomu plic se nejčastěji užívá [[cisplatina]] a [[etoposid]].<ref name="Murray"/> Kombinují se také s [[karboplatinou]], [[gemcitabinem]],[[paklitaxelem]], [[vinorelbinem]], [[topotecanem]] a [[irinotecanem]].<ref name="Azim" /><ref name="MacCallum" /> U pokročilého nemalobuněčného karcinomu plic (NSCLC) zvyšuje chemoterapie pravděpodobnost přežití a užívá se jako primární léčba za předpokladu, že nemocný je schopen tuto léčbu podstoupit.<ref name="pmid18678835" /> Obvykle se podávají dva léčivé přípravky, z nichž jeden je vždy na bázi platiny (buď [[cisplatina]] nebo [[karboplatina]]). K dalším často užívaným lékům patří [[gemcitabin]], [[paklitaxel]], [[docetaxel]],<ref name="Fishman1876">{{Cite book | author=Mehra R, Treat J | title=Fishman's Pulmonary Diseases and Disorders | publisher=McGraw-Hill | year=2008 | page=1876 | edition=4th | isbn=0-07-145739-9 }}</ref><ref name="Clegg" /> [[pemetrexed]],<ref name="pmid20446853">{{cite journal |author=Fuld AD, Dragnev KH, Rigas JR|title=Pemetrexed in advanced non-small-cell lung cancer |journal=Expert Opin Pharmacother |volume=11 |issue=8|pages=1387–402 |year=2010 |month=June |pmid=20446853 |doi=10.1517/14656566.2010.482560 }}</ref> [[etoposid]] a [[vinorelbin]].<ref name="Clegg" /> |
|||
[[Adjuvantní chemoterapie]] označuje nasazení chemoterapie po léčebném chirurgickém zákroku za účelem zlepšení vyhlídky léčení. U nemalobuněčného karcinomu jsou z blízkých [[lymfatických uzlin]] během zákroku odebrány vzorky, jež pak slouží k určení [[stanovení pokročilosti rakoviny|fáze pokročilosti]] nemoci. Pokud je potvrzena II. či III. fáze onemocnění, může adjuvantní chemoterapie zvýšit míru přežití v následujících pěti letech o 5 %.<ref name="Carbone">{{Cite journal | last=Carbone | first=DP | coauthors=Felip E | title=Adjuvant therapy in non-small cell lung cancer: future treatment prospects and paradigms | journal=Clinical Lung Cancer | volume=12 | issue=5 | pages=261–271 | month=September |year=2011 | pmid=21831720 | doi=10.1016/j.cllc.2011.06.002 }}</ref><ref name="Le Chevalier">{{Cite journal | last=Le Chevalier | first=T | title=Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going? |journal=Annals of Oncology | volume=21 | issue=Suppl. 7 | pages=vii196–198 | month=October | year=2010 | pmid=20943614 |url=http://annonc.oxfordjournals.org/content/21/suppl_7/vii196.long | doi=10.1093/annonc/mdq376}}</ref> Kombinované podávání vinorelbinu a cisplatiny vykazuje vyšší účinek než dřívější metody léčby.<ref name="Le Chevalier" /> Adjuvantní chemoterapie u osob trpících rakovinou ve fázi IB je kontroverzní, neboť klinické studie neprokázaly jasně její přínos pro délku přežití.<ref name="Horn" /><ref name="Wakelee" /> Studie zaměřené na výzkum předoperační chemoterapie ([[neoadjuvantní chemoterapie]]) u resektabilního nemalobuněčného karcinomu nepřinesly jednoznačný závěr.<ref name="Clinical evidence" /> |
|||
===Paliativní péče=== |
|||
U osob trpících terminálním onemocněním může být vhodná paliativní péče či pobyt v hospici.<ref name="Collins" /> Tyto způsoby péče umožňují dodatečnou diskusi o možnostech léčby a nabízejí příležitost dobře zvážit všechna rozhodnutí;<ref name="pmid20818881">{{cite journal |author=Kelley AS, Meier DE |title=Palliative care—a shifting paradigm |journal=New England Journal of Medicine |volume=363 |issue=8 |pages=781–2|year=2010 |month=August |pmid=20818881|doi=10.1056/NEJMe1004139 }}</ref><ref name="pmid19856592">{{cite journal |author=Prince-Paul M |title=When hospice is the best option: an opportunity to redefine goals|journal=Oncology (Williston Park, N.Y.) |volume=23 |issue=4 Suppl Nurse Ed|pages=13–7 |year=2009 |month=April |pmid=19856592 }}</ref> mohou také předejít nevhodné a nákladné péči v závěrečné fázi života nemocného.<ref name="pmid19856592"/> |
|||
Při léčbě nemalobuněčného karcinomu plic lze chemoterapii kombinovat s paliativní péčí. U pokročilých případů zlepšuje vhodná chemoterapie [[medián|průměrnou]] dobu přežití ve srovnání s pouhým využitím podpůrné péče, a zvyšuje také kvalitu života.<ref name="pmid7551923">{{cite journal|author=Souquet PJ, Chauvin F, Boissel JP, Bernard JP |title=Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer |journal=Lung Cancer |volume=12 Suppl 1 |issue= |pages=S147–54|year=1995 |month=April |pmid=7551923 |doi=10.1016/0169-5002(95)00430-9 }}</ref> U nemocných s adekvátní [[Celkový stav|tělesnou zdatností]] umožňuje udržovací chemoterapie nasazená v rámci paliativní péče prodloužení života o 1,5 až 3 měsíce, úlevu od symptomů a zlepšení kvality života. U moderních prostředků jsou zaznamenané výsledky lepší.<ref name="pmid11441939">{{cite journal |author=Sörenson S, Glimelius B, Nygren P |title=A systematic overview of chemotherapy effects in non-small cell lung cancer |journal=Acta Oncol |volume=40 |issue=2–3|pages=327–39 |year=2001 |pmid=11441939 |doi= }}</ref><ref name="pmid12065068">{{cite journal |author=Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N |title=A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer |journal=Health Technol Assess |volume=5|issue=32 |pages=1–195 |year=2001 |pmid=12065068 |doi= }}</ref> Spolupracující skupina odborníků pro metaanalýzu nemalobuněčného karcinomu plic doporučuje, aby u případů karcinomu plic v pokročilém stadiu byla zvážena chemoterapie, pokud s ní nemocný souhlasí a je schopen ji podstoupit.<ref name="pmid18678835">{{cite journal |title=Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials |journal=J. Clin. Oncol. |volume=26 |issue=28|pages=4617–25 |year=2008 |month=October |pmid=18678835 |pmc=2653127|doi=10.1200/JCO.2008.17.7162 |author1=NSCLC Meta-Analyses Collaborative Group }}</ref><ref name="pmid20464750">{{cite Cochrane |title=Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer|review=CD007309 |version=2 |issue=5 |year=2010 |pmid=20464750|editor1-last=Burdett |editor1-first=Sarah |author1=Non-Small Cell Lung Cancer Collaborative Group }}</ref> |
|||
==Prognóza== |
|||
{| class="wikitable floatright" style="text-align:center;font-size:90%;width:45%;margin-left:1em" |
|||
|+ style="background:#E5AFAA;"|'''Výsledky léčby rakoviny plic v závislosti na klinickém stadiu'''<ref name="Rami-Porta" /> |
|||
|- style="background: #E5AFAA;text-align:center;font-size:90%;" |
|||
! abbr="Type" rowspan="2" | Klinické stadium |
|||
! abbr="5-year" colspan="2" | Pětileté přežití (%) |
|||
|- style="background: #E5AFAA;text-align:center;font-size:90%;" |
|||
! abbr="NSCLC" | Nemalobuněčný karcinom plic |
|||
! abbr="SCLC" | Malobuněčný karcinom plic |
|||
|- |
|||
| IA |
|||
| 50 |
|||
| 38 |
|||
|- |
|||
| IB |
|||
| 47 |
|||
| 21 |
|||
|- |
|||
| IIA |
|||
| 36 |
|||
| 38 |
|||
|- |
|||
| IIB |
|||
| 26 |
|||
| 18 |
|||
|- |
|||
| IIIA |
|||
| 19 |
|||
| 13 |
|||
|- |
|||
| IIIB |
|||
| 7 |
|||
| 9 |
|||
|- |
|||
| IV |
|||
| 2 |
|||
| 1 |
|||
|} |
|||
Prognóza je obecně špatná. Z osob diagnostikovaných s rakovinou plic přežije prvních pět let od diagnózy 15 % z nich.<ref name="Merck" /> V době diagnózy je stadium nemoci již často pokročilé. Při prvním projevu onemocnění je ve fázi IV 30–40 % případů nemalobuněčného karcinomu a 60 % případů malobuněčného karcinomu.<ref name="Holland-Frei78" /> |
|||
Prognostické faktory nemalobuněčného karcinomu plic zahrnují výskyt příznaků plicní choroby, velikost [[tumoru]], buněčný typ ([[histologie]]), stupeň rozšíření [[pokročilost (patologie)|(pokročilost)]], [[metastázy]] v mnohočetných [[lymfatických uzlinách]] a [[vaskulární invazi]]. U osob s neoperovatelným onemocněním jsou možné výsledky horší u skupiny se špatným [[celkovým fyzickým stavem]] a více než 10% úbytkem hmotnosti.<ref name="AUTOREF17"> |
|||
{{cite web |url=http://www.cancer.gov/cancertopics/pdq/treatment/non-small-cell-lung/HealthProfessional/page2 |title=Non-Small Cell Lung Cancer Treatment |publisher=National Cancer Institute |work=PDQ for Health Professionals |accessdate=2008-11-22}}</ref> K prognostickým faktorům malobuněčného karcinomu plic patří celkový fyzický stav, [[pohlaví]], stadium nemoci a zasažení [[centrálního nervového systému]] či [[jater]] v okamžiku diagnózy.<ref name="AUTOREF18" /> |
|||
U nemalobuněčného karcinomu plic je nejlepší prognózy dosaženo kompletní chirurgickou resekcí ve stadiu IA. Přežití po pěti letech pak činí až 70 %.<ref name="OTM">{{Cite book | last=Spiro | first=SG | title=Oxford Textbook Medicine | publisher=OUP Oxford |year=2010 | chapter=18.19.1 | edition=5th | isbn=978-0199204854 }}</ref> U malobuněčného karcinomu je celková míra přežití po pěti letech kolem 5 %.<ref name="Harrison" /> Nemocní s pokročilým malobuněčným karcinomem plic mají průměrnou šanci na pětileté přežití nižší než 1 %. Průměrná doba přežití u nemocných v nepokročilé fázi nemoci je 20 měsíců, míra pětiletého přežití pak 20 %.<ref name="Merck" /> |
|||
Na základě údajů poskytnutých [[Národním ústavem pro léčbu rakoviny]] je průměrný věk při diagnóze rakoviny plic ve Spojených státech 70 let,<ref>SEER data (SEER.cancer.gov)[http://seer.cancer.gov/csr/1975_2003/results_single/sect_01_table.11_2pgs.pdf Median Age of Cancer Patients at Diagnosis 2002-2003]</ref> průměrný věk při úmrtí na následky nemoci pak 72 let.<ref>SEER data (SEER.cancer.gov)[http://seer.cancer.gov/csr/1975_2006/results_single/sect_01_table.13_2pgs.pdf Median Age of Cancer Patients at Death 2002-2006]</ref> Nemocní se zdravotním pojištěním mají ve Spojených státech větší nadějí na lepší výsledek léčby.<ref>{{cite journal |last=Slatore | first=CG | coauthors=Au DH, Gould MK | title=An official American Thoracic Society systematic review: insurance status and disparities in lung cancer practices and outcomes | date=November 2010 | journal=American Journal of Respiratory and Critical Care Medicine | volume=182 | issue=9 | pages=1195–1205 | pmid=21041563 |url=http://ajrccm.atsjournals.org/content/182/9/1195.long | doi=10.1164/rccm.2009-038ST}}</ref> |
|||
==Epidemiologie== |
|||
[[Image:Trachea, bronchus, lung cancers world map - Death - WHO2004.svg|thumb|[[Věková standardizace|Věkově standardizovaná]] úmrtí na následky rakoviny průdušnice, průdušek a plic na 100 000 obyvatel v roce 2004<ref name="AUTOREF20" /> |
|||
{{legend|#b3b3b3|údaje nejsou k dispozici}} |
|||
{{legend|#ffff65|≤ 5}} |
|||
{{legend|#fff200|5-10}} |
|||
{{legend|#ffdc00|10-15}} |
|||
{{legend|#ffc600|15-20}} |
|||
{{legend|#ffb000|20-25}} |
|||
{{legend|#ff9a00|25-30}} |
|||
{{legend|#ff8400|30-35}} |
|||
{{legend|#ff6e00|35-40}} |
|||
{{legend|#ff5800|40-45}} |
|||
{{legend|#ff4200|45-50}} |
|||
{{legend|#ff2c00|50-55}} |
|||
{{legend|#cb0000|≥ 55}} |
|||
]] |
|||
[[Image:Lung cancer US distribution.gif|right|thumb|Znázornění výskytu rakoviny plic ve [[Spojených státech]]]] |
|||
Na celém světě je rakovina plic nejčastější formou rakoviny jak ve smyslu [[Incidence (epidemiologie)|výskytu]], tak úmrtnosti. V roce 2008 bylo zaznamenáno 1,61 milionu nových případů a 1,38 milionu úmrtí na následky rakoviny plic. Nejvyšší četnost výskytu nemoci je v Evropě a Severní Americe.<ref name="GLOBOCAN">{{cite journal | last=Ferlay | first=J | coauthors=Shin HR, Bray F et al.|title=Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008 | journal=International Journal of Cancer |date=December 2010 | volume=127 | issue=12 | pages=2893–2917 | pmid=21351269 |url=http://onlinelibrary.wiley.com/doi/10.1002/ijc.25516/full | doi=10.1002/ijc.25516}}</ref> Populační skupina, u níž je pravděpodobnost vzniku onemocnění nejvyšší, jsou osoby starší 50 let, které v minulosti kouřily. V protikladu k úmrtnosti mužů, která začala před více než 20 lety klesat, má úmrtnost na rakovinu plic u žen v posledních dvou dekádách stoupající tendenci, a teprve v poslední době se začala stabilizovat.<ref name="AUTOREF22" /> V USA je [[celoživotní riziko]] onemocnění rakovinou plic 8 % u mužů a 6 % žen.<ref name="Harrison" /> |
|||
Na každé 3-4 miliony vykouřených cigaret připadá jedno úmrtí na rakovinu plic.<ref name="Harrison" /><ref>{{cite journal |last=Proctor | first=RN | title=The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll | journal=Tobacco Control | volume=21 | issue=2 | pages=87–91 | month=March | year=2012 |pmid=22345227 | doi=10.1136/tobaccocontrol-2011-050338 }}</ref> Vliv velkých tabákových společností, tzv. "[[Big Tobacco]]", hraje v kultuře kouření podstatnou roli.<ref name="Lum" /> U mladých nekuřáků, obklopených reklamou na tabákové výrobky, je vyšší pravděpodobnost, že začnou kouřit.<ref>{{cite journal | last=Lovato | first=C | coauthors=Watts A, Stead LF | title=Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours | date=October 2011 | journal=Cochrane Database of Systematic Reviews | issue=10 | pages=CD003439 | pmid=21975739 | doi=10.1002/14651858.CD003439.pub2}}</ref> Vliv [[pasivního kouření]] je při vzniku rakoviny plic ve stále vyšší míře uznáván jako rizikový faktor,<ref name="Taylor" /> což vede k úpravě zákonů s cílem snížit nežádoucí vystavení nekuřáků tabákovému kouři.<ref>{{cite journal | last=Kemp |first=FB | title=Smoke free policies in Europe. An overview | journal=Pneumologia | volume=58 | issue=3 | pages=155–158 |month=Jul–Sep | year=2009 | pmid=19817310 }}</ref> Potenciální riziko představují také emise z automobilů, továren a elektráren.<ref name="MurrayNadel46" /> |
|||
Ve [[východní Evropě]] byla zaznamenána nejvyšší úmrtnost na následky rakoviny plic mezi muži, zatímco v severní Evropě a USA je nejvyšší úmrtnost na následky této nemoci mezi ženami. Ve Spojených státech je výskyt rakoviny vyšší u černošských žen a mužů.<ref>National Cancer Institute; SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. 2010[http://seer.cancer.gov/statfacts/html/lungb.html#incidence-mortality]</ref> Výskyt rakoviny plic v rozvojových zemích je v současné době omezený.<ref name="AUTOREF23" /> Počet kuřáků v těchto státech ale stoupá, a proto se očekává nárůst výskytu této nemoci v několika následujících letech, a to zejména v Číně<ref>{{cite journal | last=Zhang | first=J | coauthors=Ou JX, Bai CX |title=Tobacco smoking in China: prevalence, disease burden, challenges and future strategies | date=November 2011 |journal=Respirology | volume=16 | issue=8 | pages=1165–1172 | pmid=21910781 | doi=10.1111/j.1440-1843.2011.02062.x }}</ref> a Indii.<ref name="AUTOREF25" /> |
|||
Od 60. let 20. století začala četnost výskytu adenokarcinomu plic ve srovnání s jinými typy rakoviny plic stoupat. Příčinou je hlavně zahájení prodeje cigaret s filtrem. Použití filtru odstraňuje z tabákového kouře větší částice a omezuje ukládání nánosu ve velkých dýchacích cestách. Kuřák však musí vdechovat hlouběji, aby dostal tutéž dávku nikotinu, a tím dochází ke zvýšenému ukládání částic v malých dýchacích cestách, kde obvykle adenokarcinom vzniká.<ref name="Charloux" /> Četnost výskytu adenokarcinomu plic se tak neustále zvyšuje.<ref>{{cite journal | last=Kadara | first=H | coauthors=Kabbout M, Wistuba II | title=Pulmonary adenocarcinoma: a renewed entity in 2011 | journal=Respirology | volume=17 | issue=1 |pages=50–65 | month=January | year=2012 | pmid=22040022 | doi=10.1111/j.1440-1843.2011.02095.x }}</ref> |
|||
==Historie== |
|||
Před příchodem kouření cigaret byla rakovina plic poměrně řídkým onemocněním, a až do roku 1761 nebyla dokonce chápána jako specifická nemoc.<ref name="AUTOREF27" /> V roce 1810 byla řada aspektů rakoviny plic popsána podrobněji.<ref name="AUTOREF28" />Zhoubné nádory plic tvořily v roce 1878 pouze 1 % všech typů rakoviny potvrzené při pitvě, na počátku 20. století však tento počet vzrostl na 10–15 %.<ref name="Witschi" /> V roce 1912 bylo v odborné literatuře zaznamenáno celosvětově pouze 374 případových studií,<ref name="AUTOREF29" />revize pitev však prokázala, že výskyt rakoviny plic vzrostl z 0,3 % v roce 1852 na 5,66 % v roce 1952.<ref name="Grannis" /> Roku 1929 rozpoznal lékař Fritz Lickint v [[Německu]] souvislost mezi kouřením a rakovinou plic,<ref name="Witschi" /> což vedlo k razantní [[Protikuřácké tažení v nacistickém Německu|protikuřácké kampani]].<ref name="Proctor" /> [[Studie britských lékařů]], publikovaná v 50. letech 20. století, je považována za první solidní [[epidemiologie|epidemiologický]] důkaz souvislosti mezi rakovinou plic a kouřením.<ref name="Doll" /> V důsledku toho doporučil v roce 1964 [[vedoucí amerického úřadu pro zdravotnictví]], aby kuřáci od kouření upustili.<ref name="AUTOREF30" /> |
|||
Vliv vzácného plynu [[radonu]] na vznik rakoviny plic byl poprvé zaznamenán u horníků z [[Krušné hory (Německo)|Krušných hor]] poblíž [[Schneebergu v Sasku]]. [[Stříbro]] se tam těžilo od roku 1470; tyto doly jsou bohaté na [[uran]], jehož výskyt je doprovázen přítomností [[rádia]] a radonu.<ref name="Greaves" /> Horníci byli v nepřiměřeně vysoké míře postihováni plicní chorobou, jež byla v 70. letech 19. století nakonec potvrzena jako rakovina plic.<ref>{{Cite journal | last=Greenberg | first=M | coauthors=Selikoff IJ |title=Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879 |journal=Annals of Occupational Hygiene | volume=37 | issue=1 | pages=5–14 | month=February | year=1993 | pmid=8460878 }}</ref> Navzdory tomu dolování pokračovalo až do 50. let 20. století, a to zejména v důsledku poptávky po uranu v [[SSSR]].<ref name="Greaves" /> V 60. letech 20. století bylo prokázáno, že radon rakovinu plic skutečně způsobuje.<ref>{{Cite journal | last=Samet | first=JM |title=Radiation and cancer risk: a continuing challenge for epidemiologists | journal=Environmental Health | volume=10 |issue=Suppl. 1 | pages=S4 | month=April | year=2011 | pmid=21489214 | doi=10.1186/1476-069X-10-S1-S4 | pmc=3073196}}</ref> |
|||
První úspěšná [[pneumonektomie]] u rakoviny plic byla provedena v roce 1933.<ref name="AUTOREF32" /> Paliativní [[radioterapie]] se používá od 40. let 20. století.<ref name="Edwards" /> Radikální radioterapie, poprvé uplatněná v 50. letech 20. století, byla pokusem o nasazení vyšších dávek radiace u pacientů v relativně rané fázi rakoviny plic, kteří však z různých důvodů nemohli podstoupit chirurgický zákrok.<ref name="AUTOREF33" /> Kontinuální hyperfrakcionovaná akcelerovaná terapie byla v roce 1997 chápána ve srovnání s konvenční radikální radioterapií jako krok vpřed.<ref name="Saunders" /> Počáteční pokusy o chirurgickou resekci<ref name="AUTOREF34" /> a radikální radioterapii<ref name="AUTOREF35" /> z 60. let 20. století u malobuněčného karcinomu plic byly neúspěšné. V další dekádě pak byla úspěšně vyvinuta léčba chemoterapií.<ref name="AUTOREF36" /> |
|||
==Bibliografia== |
|||
<ref name="Harrison">{{Cite book | last=Horn | first=L | coauthors=Pao W, Johnson DH | title=Harrison's Principles of Internal Medicine | publisher=McGraw-Hill | year=2012 | chapter=Chapter 89 | edition=18th | isbn=0-07-174889-X }}</ref> |
|||
<ref name="Thun">{{Cite journal | last=Thun | first=MJ | coauthors=Hannan LM, Adams-Campbell LL et al. | title=Lung cancer occurrence in never-smokers: an analysis of 13 cohorts and 22 cancer registry studies | journal=PLoS Medicine | volume=5 | issue=9 | pages=e185 | month=September | year=2008 | doi=10.1371/journal.pmed.0050185 | pmid=18788891 | pmc=2531137 }}</ref> |
|||
<ref name="AUTOREF">{{cite web |url=http://www.surgeongeneral.gov/library/secondhandsmoke |author=Carmona, RH |publisher=U.S. Department of Health and Human Services |title=The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General |date=2006-06-27 |quote=Secondhand smoke exposure causes disease and premature death in children and adults who do not smoke.}}</ref> |
|||
<ref name="AUTOREF1">{{Cite journal |url=http://monographs.iarc.fr/ENG/Monographs/vol83/volume83.pdf |format=PDF |publisher=WHO International Agency for Research on Cancer |title=Tobacco Smoke and Involuntary Smoking |journal=IARC Monographs on the Evaluation of Carcinogenic Risks to Humans |volume=83 |year=2002 |quote=There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) causes lung cancer in humans. [...] Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1). }}</ref> |
|||
<ref name="Rosti">{{Cite journal | last=Rosti | first=G | coauthors=Bevilacqua G, Bidoli P et al. | title=Small cell lung cancer | journal=Annals of Oncology | volume=17 | issue=Suppl. 2 | pages=5–10 | month=March | year=2006 | url=http://annonc.oxfordjournals.org/cgi/reprint/17/suppl_2/ii5 | pmid=16608983 | doi=10.1093/annonc/mdj910 }}</ref> |
|||
<ref name="Seo">{{Cite journal | last=Seo | first=JB | coauthors=Im JG, Goo JM et al. | title=Atypical pulmonary metastases: spectrum of radiologic findings | journal=Radiographics | volume=21 | issue=2 | pages=403–417 | url=http://radiographics.rsnajnls.org/cgi/content/full/21/2/403 | pmid=11259704 | date=1 March 2001 }}</ref> |
|||
<ref name="Collins">{{Cite journal | last=Collins | first=LG | coauthors=Haines C, Perkel R, Enck RE | title=Lung cancer: diagnosis and management | journal=American Family Physician | volume=75 | issue=1 | pages=56–63 | publisher=American Academy of Family Physicians | month=January | year=2007 | url=http://www.aafp.org/afp/20070101/56.html | pmid=17225705 }}</ref> |
|||
<ref name="Honnorat">{{Cite journal | last=Honnorat | first=J | coauthors=Antoine JC | title=Paraneoplastic neurological syndromes | journal=Orphanet Journal of Rare Diseases | volume=2 | page=22 | publisher=BioMed Central | month=May | year=2007 | url=http://www.ojrd.com/content/2/1/22 | pmid=17480225 | doi=10.1186/1750-1172-2-22 | pmc=1868710 | issue=1}}</ref> |
|||
<ref name="ajcc">{{Cite book |author=Greene, Frederick L. |title=AJCC cancer staging manual |publisher=Springer-Verlag |location=Berlin |year=2002 |pages= |isbn=0-387-95271-3 |oclc= |doi= |accessdate=}}</ref> |
|||
<ref name="AUTOREF5">{{Cite journal | last=Biesalski | first=HK | coauthors=Bueno de Mesquita B, Chesson A et al. | title=European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel | journal=CA Cancer J Clin | volume=48 | issue=3 | pages=167–176; discussion 164–166 | year=1998 | pmid=9594919 | url=http://onlinelibrary.wiley.com/doi/10.3322/canjclin.48.3.167/full | doi=10.3322/canjclin.48.3.167 | location=Smoking is the major risk factor, accounting for about 90% of lung cancer incidence. }}</ref> |
|||
<ref name="Peto">{{Cite book | last=Peto | first=R | coauthors=Lopez AD, Boreham J et al. | title=Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics | publisher=Oxford University Press | year=2006 | url=http://www.ctsu.ox.ac.uk/~tobacco/ | isbn=0-19-262535-7 }}</ref> |
|||
<ref name="Hecht">{{Cite journal | last=Hecht | first=S | title=Tobacco carcinogens, their biomarkers and tobacco-induced cancer | journal=Nature Reviews. Cancer | volume=3 | issue=10 | pages=733–744 | publisher=Nature Publishing Group | month=October | year=2003 | url=http://www.nature.com/nrc/journal/v3/n10/abs/nrc1190_fs.html | doi=10.1038/nrc1190 | pmid=14570033 }}</ref> |
|||
<ref name="AUTOREF6">{{Cite journal | last=Sopori | first=M | title=Effects of cigarette smoke on the immune system | journal=Nature Reviews. Immunology | volume=2 | issue=5 | pages=372–7 | month=May | year=2002 | pmid=12033743 | doi=10.1038/nri803 }}</ref> |
|||
<ref name="NHMRC">{{Cite journal | author=National Health and Medical Research Council | title=The health effects and regulation of passive smoking | publisher=Australian Government Publishing Service |date = April 1994| url=http://www.obpr.gov.au/publications/submission/healthef/index.html | accessdate=2007-08-10 |archiveurl = http://web.archive.org/web/20070929025344/http://www.obpr.gov.au/publications/submission/healthef/index.html |archivedate = September 29, 2007}}</ref> |
|||
<ref name="Schick">{{Cite journal | last=Schick | first=S | coauthors=Glantz S | title=Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke | journal=Tobacco Control | volume=14 | issue=6 | pages=396–404 | month=December | year=2005 | pmid=16319363 | doi=10.1136/tc.2005.011288 | pmc=1748121 }}</ref> |
|||
<ref name="EPA radon">{{cite web | last=EPA | authorlink=United States Environmental Protection Agency | title=Radiation information: radon | publisher=EPA | month=October | year=2006 | url=http://www.epa.gov/rpdweb00/radionuclides/radon.html | accessdate=2007-08-11 }}</ref> |
|||
<ref name="O'Reilly">{{Cite journal | last=O'Reilly | first=KM | coauthors =Mclaughlin AM, Beckett WS, Sime PJ | title =Asbestos-related lung disease | journal=American Family Physician | volume=75 | issue=5 | pages=683–688 | month=March | year=2007 | url=http://www.aafp.org/afp/20070301/683.html | pmid=17375514 }}</ref> |
|||
<ref name="Fong">{{Cite journal | last=Fong | first=KM | coauthors=Sekido Y, Gazdar AF, Minna JD | title=Lung cancer • 9: Molecular biology of lung cancer: clinical implications | journal=Thorax | volume=58 | issue=10 | pages=892–900 | publisher=BMJ Publishing Group Ltd. | month=October | year=2003 | pmid=14514947 | doi=10.1136/thorax.58.10.892 | pmc=1746489 }}</ref> |
|||
<ref name="Salgia">{{Cite journal | last=Salgia | first=R | coauthors=Skarin AT | title=Molecular abnormalities in lung cancer | journal=Journal of Clinical Oncology | volume=16 | issue=3 | pages=1207–1217 | month=March | year=1998 | pmid=9508209 }}</ref> |
|||
<ref name="NEJM-molecular">{{Cite journal | last=Herbst | first=RS | coauthors=Heymach JV, Lippman SM | title=Lung cancer | journal=New England Journal of Medicine | volume=359 | issue=13 | pages=1367–1380 | month=September | year=2008| url=http://content.nejm.org/cgi/content/full/359/13/1367 | doi=10.1056/NEJMra0802714 | pmid=18815398 }}</ref> |
|||
<ref name="Aviel-Ronen">{{Cite journal | last=Aviel-Ronen | first=S | coauthors=Blackhall FH, Shepherd FA, Tsao MS | title=K-ras mutations in non-small-cell lung carcinoma: a review | journal=Clinical Lung Cancer | volume=8 | issue=1 | pages=30–38 | publisher=Cancer Information Group | month=July | year=2006 | pmid=16870043 | doi=10.3816/CLC.2006.n.030 }}</ref> |
|||
<ref name="Devereux">{{Cite journal | last=Devereux | first=TR | coauthors=Taylor JA, Barrett JC | title=Molecular mechanisms of lung cancer. Interaction of environmental and genetic factors | journal=Chest | volume=109 | issue=Suppl 3 | pages=14S–19S | publisher=American College of Chest Physicians | month=March | year=1996 | pmid=8598134 | doi=10.1378/chest.109.3_Supplement.14S }}</ref> |
|||
<ref name="Bhutan">{{cite news | last=Pandey | first=G | title=Bhutan's smokers face public ban | publisher=BBC | month=February | year=2005 | url=http://news.bbc.co.uk/2/hi/south_asia/4305715.stm | accessdate=2007-09-07 }}</ref> |
|||
<ref name="Clegg">{{Cite journal | last=Clegg | first=A | coauthors=Scott DA, Hewitson P et al. | title=Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review | journal=Thorax | volume=57 | issue=1 | pages=20–28 | publisher=BMJ Publishing Group | month=January | year=2002 | pmid=11809985 | doi=10.1136/thorax.57.1.20 | pmc=1746188 }}</ref> |
|||
<ref name="Murray">{{Cite journal | last=Murray | first=N | coauthors=Turrisi AT | title=A review of first-line treatment for small-cell lung cancer | journal=Journal of Thoracic Oncology | volume=1 | issue=3 | pages=270–278 | month=March | year=2006 | pmid=17409868 }}</ref> |
|||
<ref name="Azim">{{Cite journal | last=Azim | first=HA | coauthors=Ganti AK | title=Treatment options for relapsed small-cell lung cancer | journal=Anticancer drugs | volume=18 | issue=3 | pages=255–261 | month=March | year=2007 | pmid=17264756 | doi=10.1097/CAD.0b013e328011a547 }}</ref> |
|||
<ref name="MacCallum">{{Cite journal | last=MacCallum | first=C | coauthors=Gillenwater HH | title=Second-line treatment of small-cell lung cancer | journal=Current Oncology Reports | volume=8 | issue=4 | pages=258–264 | month=July | year=2006 | pmid=17254525 | doi=10.1007/s11912-006-0030-8 }}</ref> |
|||
<ref name="Horn">{{Cite journal | last=Horn | first=L | coauthors=Sandler AB, Putnam JB Jr, Johnson DH | title=The rationale for adjuvant chemotherapy in stage I non-small cell lung cancer | journal=Journal of Thoracic Oncology | volume=2 | issue=5 | pages=377–383 | month=May | year=2007 | pmid=17473651 | doi=10.1097/01.JTO.0000268669.64625.bb }}</ref> |
|||
<ref name="Wakelee">{{Cite journal | last=Wakelee | first=HA | coauthors=Schiller JH, Gandara DR | title=Current status of adjuvant chemotherapy for stage IB non-small-cell lung cancer: implications for the New Intergroup Trial | journal=Clinical Lung Cancer | volume=8 | issue=1 | pages=18–21 | publisher=Cancer Information Group | month=July | year=2006 | pmid=16870041 | doi=10.3816/CLC.2006.n.028 }}</ref> |
|||
<ref name="Clinical evidence">{{Cite book | last=BMJ | authorlink=British Medical Journal | title=Clinical evidence concise : the international resource of the best available evidence for effective health care. | publisher=BMJ Publishing Group | location=London | month=December | year=2005 | issue=14 | pages=486–488 | isbn=1-905545-00-2 | issn=1475-9225 }}</ref> |
|||
<ref name="OTO">{{Cite book | last=Arriagada | first=R | coauthors=Goldstraw P, Le Chevalier T | title=Oxford Textbook of Oncology | publisher=Oxford University Press | year=2002 | page=2094 | edition=2nd | isbn=0-19-262926-3 }}</ref> |
|||
<ref name="PORT Meta-analysis Trialists Group">{{Cite journal |author= |title=Postoperative radiotherapy for non-small cell lung cancer |journal=Cochrane Database of Systematic Reviews |issue=2 |pages=CD002142 |year=2005 |pmid=15846628 |url=http://mrw.interscience.wiley.com/cochrane/clsysrev/articles/CD002142/frame.html |doi=10.1002/14651858.CD002142.pub2 |author1= PORT Meta-analysis Trialists Group |editor1-last= Rydzewska |editor1-first= Larysa}}</ref> |
|||
<ref name="Raz">{{Cite journal | last=Raz | first=DJ | coauthors=He B, Rosell R, Jablons DM | title=Bronchioloalveolar carcinoma: a review | journal=Clinical Lung Cancer | volume=7 | issue=5 | pages=313–322 | month=March | year=2006 | pmid=16640802 | doi=10.3816/CLC.2006.n.012 }}</ref> |
|||
<ref name="AUTOREF18">{{cite web |title=Small Cell Lung Cancer Treatment |publisher=National Cancer Institute |url=http://www.cancer.gov/cancertopics/pdq/treatment/small-cell-lung/healthprofessional |work=PDQ for Health Professionals |year=2012 |accessdate=2012-05-16}}</ref> |
|||
<ref name="Merck">{{cite web | title=Lung Carcinoma: Tumors of the Lungs | publisher = Merck Manual Professional Edition, Online edition | url=http://www.merck.com/mmpe/sec05/ch062/ch062b.html#sec05-ch062-ch062b-1405 | accessdate=2007-08-15 }}</ref> |
|||
<ref name="AUTOREF20">{{cite web |url=http://www.who.int/healthinfo/global_burden_disease/estimates_country/en/index.html |title=WHO Disease and injury country estimates |year=2009 |work=World Health Organization |accessdate=November 11, 2009}}</ref> |
|||
<ref name="AUTOREF22">{{cite journal |author=Jemal A, Tiwari RC, Murray T, ''et al.'' |title=Cancer statistics, 2004 |journal=CA: a Cancer Journal for Clinicians |volume=54 |issue=1 |pages=8–29 |year=2004 |pmid=14974761 |doi=10.3322/canjclin.54.1.8}}</ref> |
|||
<ref name="Lum">{{Cite journal | last=Lum | first=KL | coauthors=Polansky JR, Jackler RK, Glantz SA | title=Signed, sealed and delivered: "big tobacco" in Hollywood, 1927–1951 | journal=Tobacco Control | volume=17 | issue=5 | pages=313–323 | month=October | year=2008 | url=http://tobaccocontrol.bmj.com/cgi/content/full/17/5/313 | pmid=18818225 | doi=10.1136/tc.2008.025445 | pmc=2602591 }}</ref> |
|||
<ref name="AUTOREF23">{{cite web | title=Gender in lung cancer and smoking research | publisher=[[World Health Organization]] | year=2004 | url=http://www.who.int/gender/documents/en/lungcancerlow.pdf | format=PDF | accessdate=2007-05-26 }}</ref> |
|||
<ref name="AUTOREF25">{{Cite journal | last=Behera | first=D | coauthors=Balamugesh T | title=Lung cancer in India | journal=Indian Journal of Chest Diseases and Allied Sciences | volume=46 | issue=4 | pages=269–281 | year=2004 | pmid=15515828 | url=http://www.vpci.org.in/upload/Journals/pic130.pdf#page=27 | format=PDF }}</ref> |
|||
<ref name="Charloux">{{Cite journal | last=Charloux | first=A | coauthors=Quoix E, Wolkove N et al. | title=The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma | journal=International Journal of Epidemiology | volume=26 | issue=1 | pages=14–23 | month=February | year=1997 | pmid=9126499 | url=http://ije.oxfordjournals.org/cgi/reprint/26/1/14 | doi=10.1093/ije/26.1.14 }}</ref> |
|||
<ref name="AUTOREF27">{{Cite book | last=Morgagni | first=Giovanni Battista | title=De sedibus et causis morborum per anatomen indagatis | year=1761 |ol=24830495M }}</ref> |
|||
<ref name="AUTOREF28">{{Cite book | last=Bayle | first=Gaspard-Laurent | title=Recherches sur la phthisie pulmonaire |place=Paris |language=French | year=1810 |ol=15355651W }}</ref> |
|||
<ref name="Witschi">{{Cite journal | last=Witschi | first=H | title=A short history of lung cancer | journal=[[Toxicological Sciences]] | volume=64 | issue=1 | pages=4–6 | month=November | year=2001 | url=http://toxsci.oxfordjournals.org/cgi/content/full/64/1/4 |pmid=11606795 | doi=10.1093/toxsci/64.1.4 }}</ref> |
|||
<ref name="AUTOREF29">{{Cite book|author=Adler, I |year=1912 |title=Primary Malignant Growths of the Lungs and Bronchi |place= New York |publisher=Longmans, Green, and Company |oclc=14783544 |ol=24396062M }}, cited in {{Cite journal |author=Spiro SG, Silvestri GA |title=One hundred years of lung cancer |journal=American Journal of Respiratory and Critical Care Medicine |volume=172 |issue=5 |pages=523–529 |year=2005 |pmid=15961694 |doi=10.1164/rccm.200504-531OE}}</ref> |
|||
<ref name="Grannis">{{cite web | last=Grannis | first=FW |title=History of cigarette smoking and lung cancer | publisher=smokinglungs.com | url=http://www.smokinglungs.com/cighist.htm | accessdate=2007-08-06 | archiveurl = http://web.archive.org/web/20070718174754/http://www.smokinglungs.com/cighist.htm| archivedate = July 18, 2007}}</ref> |
|||
<ref name="Proctor">{{Cite book | last=Proctor | first=R | title=The Nazi War on Cancer | publisher=Princeton University Press | year=2000 | pages=173–246 | isbn=0-691-00196-0 }}</ref> |
|||
<ref name="Doll">{{Cite journal | last=Doll | first=R | coauthors=Hill AB | title=Lung Cancer and Other Causes of Death in Relation to Smoking | journal=British Medical Journal | volume=2 | issue=5001 | pages=1071–1081 | month=November | year=1956 | pmid=13364389 | doi=10.1136/bmj.2.5001.1071 | pmc=2035864 }}</ref> |
|||
<ref name="AUTOREF30">{{cite web | author=US Department of Health Education and Welfare | title=Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service | location=Washington, DC | publisher=US Government Printing Office | year=1964 | url=http://profiles.nlm.nih.gov/NN/B/B/M/Q/_/nnbbmq.pdf | format=PDF }}</ref> |
|||
<ref name="Greaves">{{Cite book | last=Greaves | first=M | title=Cancer: the Evolutionary Legacy | publisher=Oxford University Press | year=2000 | pages=196–197 | isbn=0-19-262835-6 }}</ref> |
|||
<ref name="AUTOREF32">{{Cite journal | last=Horn | first=L | coauthors= Johnson DH | title=Evarts A. Graham and the first pneumonectomy for lung cancer | journal=Journal of Clinical Oncology | volume=26 | issue=19 | pages=3268–3275 | month=July | year=2008 | pmid=18591561 | url=http://jco.ascopubs.org/cgi/pdf_extract/26/19/3268 | doi=10.1200/JCO.2008.16.8260 }}</ref> |
|||
<ref name="Edwards">{{Cite journal | last=Edwards | first=AT | title=Carcinoma of the Bronchus | journal=Thorax | volume=1 | issue=1 | pages=1–25 | year=1946 | pmc = 1018207 | doi=10.1136/thx.1.1.1 | pmid=20986395}}</ref> |
|||
<ref name="AUTOREF33">{{Cite journal | last=Kabela | first=M | title=Erfahrungen mit der radikalen Röntgenbestrahlung des Bronchienkrebses |trans_title=Experience with radical irradiation of bronchial cancer | language=German | journal=Ceskoslovenská Onkológia | volume=3 | issue=2 | pages=109–115 | year=1956 | pmid=13383622 }}</ref> |
|||
<ref name="Saunders">{{Cite journal | last=Saunders | first=M | coauthors=Dische S, Barrett A et al. | title=Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial | journal=Lancet | volume=350 | issue=9072 | pages=161–165 | publisher=Elsevier | month=July | year=1997 | pmid=9250182 | doi=10.1016/S0140-6736(97)06305-8 }}</ref> |
|||
<ref name="AUTOREF34">{{Cite journal | last=Lennox | first=SC | coauthors=Flavell G, Pollock DJ et al. | title=Results of resection for oat-cell carcinoma of the lung | journal=Lancet | volume=2 | issue=7575 | pages=925–927 | publisher=Elsevier | month=November | year=1968 | pmid=4176258 | doi=10.1016/S0140-6736(68)91163-X }}</ref> |
|||
<ref name="AUTOREF35">{{Cite journal | last=Miller | first=AB | coauthors=Fox W, Tall R | title=Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus | journal=Lancet | volume=2 | issue=7619 | pages=501–505 | publisher=Elsevier | month=September | year=1969 | pmid=4184834 | doi=10.1016/S0140-6736(69)90212-8 }}</ref> |
|||
<ref name="AUTOREF36">{{Cite journal | last=Cohen | first=M | coauthors= Creaven PJ, Fossieck BE Jr et al. | title=Intensive chemotherapy of small cell bronchogenic carcinoma | journal=Cancer Treatment Reports | volume=61 | issue=3 | pages=349–354 | year=1977 | pmid=194691 }}</ref><!-- Old article --> |
|||
---- |
|||
{{Infobox Choroba |
{{Infobox Choroba |
||
| Název = Karcinom plic |
| Název = Karcinom plic |
||
Verze z 31. 7. 2014, 14:29
Karcinom plic je onemocnění, při kterém dochází k nekontrolovanému buněčnému růstu v tkáni plic. Pokud není léčen, může se tento růst v rámci procesu zvaného metastázování rozšířit i mimo plíce do okolních tkání nebo dalších částí těla. Většina případů rakoviny, které začínají v plicích a jsou známy jako primární rakovina plic, jsou karcinomy vznikající z buněk epitelové tkáně. Hlavními typy rakoviny plic jsou malobuněčný karcinom plic (SCLC), rovněž známý jako „karcinom ovesných buněk“ (zhoubné buňky připomínají zrnka ovsa), a nemalobuněčný karcinom plic (NSCLC). Mezi nejběžnější symptomy onemocnění patří kašel (včetně vykašlávání krve), úbytek váhy a dechová nedostatečnost.[1]
Nejběžnější příčinou nemoci je dlouhodobé vystavení tabákovému kouři,[2] které stojí za 80–90 % případů rakoviny plic.[1] K 10–15 % případů tohoto onemocnění dochází u nekuřáků,[3] přičemž tyto případy jsou často přičítány kombinaci genetických faktorů,[4] vystavení vlivu radonu,[4] azbestu[5] a znečištění vzduchu,[4] včetně kouře z pasivního kouření.[6][7] Karcinom plic lze zobrazit pomocí rentgenu hrudníku a počítačové tomografie (CT snímek). Diagnóza je potvrzována prostřednictvím biopsie,[8] která se obvykle provádí za využití bronchoskopie nebo kontrolovaným CT vyšetřením. Léčba a dlouhodobé výsledky závisí na typu rakoviny, fázi (stupni rozšíření) a celkovém zdravotním stavu nemocného měřeném prostřednictvím hodnocení jeho celkového fyzického stavu.
Mezi běžné způsoby léčby patří chirurgický zákrok, chemoterapie a radioterapie. Nemalobuněčné karcinomy jsou někdy odstraňovány chirurgickým zákrokem, kdežto malobuněčné karcinomy obvykle lépe reagují na chemoterapii a radioterapii.[9] 15 % osob ve Spojených státech, u nichž je diagnostikována rakovina plic, přežije dalších pět let po stanovení diagnózy.[10] Celosvětově je rakovina plic nejběžnější příčinou úmrtí žen i mužů souvisejících s rakovinou a přičítá se jí 1,38 milionu úmrtí ročně (údaj k roku 2008).[11]
Příznaky a symptomy
Mezi příznaky a symptomy, které mohou rakovinu plic naznačovat, patří:[1]
- respirační symptomy: kašel, vykašlávání krve, sípání nebo dýchavičnost
- systémové symptomy: úbytek hmotnosti, horečka, paličkovité prsty nebo únava
- symptomy způsobené místním tlakem: bolest na prsou, bolesti v kostech, syndrom horní duté žíly, potíže s polykáním
Pokud se karcinom tvoří v dýchacích cestách, může ztěžovat proudění vzduchu a zapříčinit tak dýchavičnost. Ucpání dýchacích cest může vést k nahromadění sekretu za místem ucpání a způsobit zápal plic.[1] V závislosti na typu tumoru může na možnost karcinomu plic zpočátku ukázat tzv. paraneoplastický syndrom.[12] V případě karcinomu plic mohou projevy tohoto syndromu zahrnovat Lambert–Eatonův myastenický syndrom (svalová slabost způsobená autoprotilátkami), hyperkalcemii nebo syndrom nedostatečné produkce antidiuretického hormonu (SIADH). Tumory v horní části plic, známé jako Pancoastovy tumory, mohou narušit místní část sympatického nervového systému a vést tak k Hornerově syndromu (pokles očního víčka a malá oční panenka na postižené straně) a k poškození brachiálního plexu.[1]
Mnoho ze symptomů karcinomu plic (nechuť k jídlu, úbytek hmotnosti, horečka, únava) není specifických.[8] U mnoha osob, které v okamžiku projevu symptomů vyhledají lékařskou pomoc, je již rakovina rozšířena i mimo původní ložisko. Mezi běžná místa, kam se rakovina dále šíří, patří mozek, kosti, nadledvinky, druhá plíce, játra, osrdečník a ledviny.[13] Přibližně 10 % osob s karcinomem plic nemá v okamžiku diagnózy žádné symptomy; k nálezu karcinomu obvykle dochází náhodně při rutinním rentgenu hrudníku.[10]
Příčiny
K rozvoji karcinomu dochází v důsledku genetického poškození DNA. Toto genetické poškození postihuje normální funkci buňky včetně její schopnosti množení, programované buněčné smrti (apoptózy) a schopnosti opravy DNA. Čím větší je poškození, tím vyšší je riziko vzniku karcinomu.[14]
Kouření

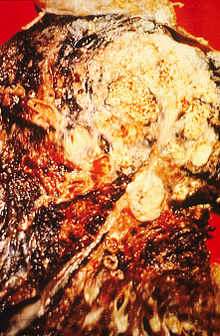
Kouření, zejména pak kouření cigaret, přispívá ke vzniku karcinomu plic zdaleka nejvíce.[15] Cigaretový kouř obsahuje více než 60 známých karcinogenů,[16] mezi něž patří radioizotopy z rozpadové řady radonu, z nitrosaminu a benzopyrenu. Rovněž se zdá, že nikotin potlačuje imunitní odezvu na rakovinotvorný růst ve tkáni vystavené těmto vlivům.[17] V rozvinutých zemích bylo 90 % úmrtí mužů na karcinom plic v roce 2000 přičítáno kouření (70 % u žen).[18] Kouření se přičítá 80–90 % všech případů karcinomu plic.[1]
U nekuřáků je příčinou vzniku karcinomu plic pasivní kouření - vdechování kouře vznikajícího při kouření jiných osob. Jako pasivního kuřáka lze označit člověka, který žije nebo pracuje v blízkosti kuřáka. Studie provedené ve Spojených státech,[19][20]Evropě,[21] Spojeném království[22] a v Austrálii[23] konzistentně prokázaly značně zvýšené riziko vzniku rakoviny u osob vystavených pasivnímu kouření.[24] U těch, kdo žijí s kuřákem, je riziko vyšší asi o 20–30 %, zatímco u osob, které pracují v prostředí ovlivňovaném kouřem z cigaret jiných lidí, je riziko vyšší o 16–19 %.[25] Výzkum vlivu postranního proudu kouře naznačuje, že tento kouř je ještě nebezpečnější než kouř přímo vdechovaný kuřákem.[26] Ve Spojených státech je pasivní kouření příčinou přibližně 3 400 úmrtí na karcinom plic ročně.[20]
Radon
Radon je plyn bez barvy a zápachu vznikající rozpadem radioaktivního rádia, které je pro změnu produktem rozpadu uranu vyskytujícího se v zemské kůře. Produkty rozpadu radioaktivních látek ionizují genetický materiál a způsobují mutace, které se někdy stávají rakovinnými. Po kouření je radon druhou nejběžnější příčinou karcinomu plic ve Spojených státech.[20] S každými 100 becquerely/m³ koncentrace radonu se riziko zvyšuje o 8-16 %.[27]Množství radonu se liší v závislosti na lokalitě a složení půdy a hornin v podloží. Například v oblastech, jako je Cornwall ve Spojeném království (kde je žulové podloží), je radon velkým problémem. Pro snížení koncentrace radonu musí být budovy uměle větrány. Americká Agentura pro ochranu životního prostředí (EPA) odhaduje, že v jednom z 15 domů ve Spojených státech je hladina radonu vyšší než je doporučený limit 4 pikocurie na litr (pCi/l) (148 Bq/m³).[28]
Azbest
Azbest může způsobit řadu onemocnění plic, včetně karcinomu plic. Kouření tabáku a vystavení azbestu má na tvorbu karcinomu plic synergický efekt.[5] Azbest může rovněž způsobit rakovinu pohrudnice, která se nazývá mezoteliom (a která se od karcinomu plic liší).[29]
Znečištění vzduchu
Znečištění vzduchu má na zvýšení rizika karcinomu plic malý účinek.[4] Jemné částice (PM2,5) a sulfátové aerosoly, které se mohou dostávat do ovzduší ve výfukových plynech, jsou spojovány s mírně zvýšeným rizikem.[4][30] U oxidu dusičitého každý přírůstek 10 částic na jednu miliardu částic vzduchu zvyšuje riziko karcinomu plic o 14 %.[31] Znečištění vzduchu se připisuje 1–2 % případů karcinomu plic.[4]
Předběžné důkazy podporují hypotézu zvýšeného rizika vzniku karcinomu plic v důsledku znečištění vzduchu v interiéru v souvislosti se spalováním dřeva, uhlí, zvířecího trusu nebo zbytků rostlin při vaření nebo topení.[32] U žen, které jsou v interiéru vystaveny kouři z uhlí, je riziko přibližně dvojnásobné; řada vedlejších produktů spalování biomasy je známými nebo domnělými karcinogeny.[33] Toto riziko se týká přibližně 2,4 miliardy lidí na celém světě[32] a má se za to, že stojí za 1,5 % úmrtí na karcinom plic.[33]
Genetika
Odhaduje se, že 8 až 14 % případů karcinomu plic je způsobeno dědičnými faktory.[34] U osob příbuzných nemocnému s karcinomem plic je riziko 2,4 krát vyšší. Je tomu tak pravděpodobně v důsledku kombinace genů.[35]
Další příčiny
S karcinomem plic je spojována řada dalších látek, povolání a vystavení vlivům okolního prostředí. Mezinárodní agentura pro výzkum rakoviny (IARC) uvádí, že existují „dostatečné důkazy“ pro to, že přítomnost následujících látek v plicích je karcinogenní:[36]
- Některé kovy (výroba hliníku, kadmium a sloučeniny kadmia, sloučeniny chromu (VI), berylium a sloučeniny berylia, železné a ocelové slitiny, sloučeniny niklu, arsen a anorganické sloučeniny arsenu, podzemní těžba hematitu)
- Některé produkty spalování (nedokonalé spalování, uhlí (emise ze spalování uhlí v domácnostech), uhelné plyny, černouhelná smůla, výroba koksu, saze, výfukové plyny z naftových motorů)
- Ionizující záření (rentgen, radon 222 a produkty jeho rozpadu, gama záření, plutonium)
- Některé toxické plyny (metyléter (technický stupeň čistoty), bis(chlormetyl)éter, yperit, MOPP (směs vinkristin-prednison-dusíkatý yperit-prokarbazin), výpary z nátěrů)
- Výroba pryže a krystalický křemenný prach
Patogeneze
Podobně jako u mnoha dalších typů rakoviny začíná karcinom plic aktivací onkogenů nebo deaktivací genů bránících vzniku tumoru.[37] Má se za to, že onkogeny činí člověka náchylnějším k rozvoji rakoviny, a zdá se, že protoonkogeny se po vystavení působení konkrétních karcinogenů mění právě na onkogeny.[38] Mutace protoonkogenu K-ras způsobují 10–30 % případů adenokarcinomu plic.[39][40] Receptor pro epidermální růstový faktor (EGFR) reguluje množení buněk, apoptózu, angiogenezi a invazi tumoru.[39] Mutace a zvětšení receptorů EGFR jsou běžné u nemalobuněčného karcinomu plic a představují základ pro léčbu pomocí inhibitorů EGFR. Receptor Her2/neu je postihován méně častěji.[39] Poškození chromozomů může vést ke ztrátě heterozygozity, a tedy potenciálně k deaktivaci genů zabraňujících vzniku tumoru. Pro malobuněčný karcinom plic je běžné poškození zejména chromozomů 3p, 5q, 13q a 17p. Gen p53, který zabraňuje vzniku tumoru a který se nachází na chromozomu 17p, je postihován v 60-75 % případů.[41] Mezi další geny, k jejich mutaci či změnám často dochází, patří c-MET, NKX2-1,LKB1, PIK3CA a BRAF.[39]
Diagnóza

Provedení rentgenu hrudníku je jedním z prvních kroků při vyšetření osoby trpící symptomy, jež by mohly naznačovat karcinom plic. Může odhalit přítomnost tumoru, rozšíření mezihrudí (naznačující, že tumor napadl lymfatické uzliny), atelektázu (kolaps), konsolidaci plic (pneumonii) nebo pleurální efuzi.[2] Ke zjištění detailnějších informací o typu a rozsahu onemocnění se typicky používá CT snímkování. Bronchoskopie nebo CT snímkováním řízená biopsie často slouží k odebrání vzorku tumoru pro účely histopatologie.[10]
Rakovina plic se na rentgenu hrudníku často objevuje jako solitární plicní uzel. Diferenciální diagnostika však uvádí řadu dalších onemocnění s podobným symtomem. Stejný příznak může způsobit i tuberkulóza, plísňové infekce, metastatická rakovina nebo organizující se pneumonie. Mezi méně běžné příčiny solitárního plicního uzlu patří hamartomy, bronchogenní cysty, adenomy, arteriovenózní malformace, plicní sekvestrace, revmatoidní uzlíky, Wegenerova granulomatóza nebo lymfom.[42] Karcinom plic může být odhalen i náhodně jako solitární plicní uzel na rentgenovém nebo CT snímku hrudníku pořízeném pro jiný, nesouvisející účel.[43]Definitivní diagnóza karcinomu plic se stanovuje na základě histologického vyšetření podezřelé tkáně z hlediska klinického a radiologického.[1]
Klasifikace
| Histologický ytp | Počet případů na 100 000 osob a rok |
|---|---|
| Všechny typy | 66,9 |
| Adenokarcinom | 22,1 |
| Spinocelulární karcinom | 14,4 |
| Malobuněčný karcinom | 9,8 |
Karcinomy plic jsou klasifikovány podle histologického typu.[8] Tato klasifikace je důležitá pro určení způsobu léčby a předvídání dalšího vývoje nemoci. V naprosté většině případů rakoviny plic se jedná o karcinomy—zhoubné bujení buněk epitelové tkáně. Karcinomy plic se rozdělují do kategorií podle velikosti a vzhledu buněk zhoubné tkáně tak, jak ji pod mikroskopem vidí histopatolog. Dvěma hlavními skupinami jsou nemalobuněčné a malobuněčné karcinomy plic.[44]
Nemalobuněčný karcinom plic

Třemi hlavními podtypy nemalobuněčného karcinomu plic jsou adenokarcinom, spinocelulární karcinom plic a velkobuněčný karcinom plic.[1]
Téměř 40 % karcinomů plic jsou adenokarcinomy, které obvykle vznikají v okrajové plicní tkáni.[8] Většina případů adenokarcinomů souvisí s kouřením, avšak i u osob, které za svůj život vykouřily méně než 100 cigaret (a lze je tak označit za „nekuřáky“),[1] je adenokarcinom nejběžnější formou rakoviny plic.[45] Podtyp adenokarcinomu označovaný jako bronchioloalveolární karcinom je obvyklejší u žen-nekuřaček a je spojován s delší pravděpodobnou dobou přežití.[46]
Spinocelulární karcinom stojí za přibližně 30 % případů rakoviny plic. Tento typ karcinomu se typicky objevuje v blízkosti velkých cest dýchacích. Ve středu tumoru se obvykle nachází dutina a mrtvá tkáň.[8]Přibližně 9 % rakoviny plic jsou velkobuněčné karcinomy. Jsou tak pojmenovány proto, že buňky karcinomu jsou velké, s množstvím cytoplazmy, velkými jádry a nápadnými jadérky.[8]
Malobuněčný karcinom plic

V případě malobuněčných karcinomů plic (SCLC) buňky obsahují kompaktní neurosekreční granula (váčky naplněné neuroendokrinními hormony), které by u tohoto tumoru mohly naznačovat souvislost s endokrinním/paraneoplastickým syndromem.[47] Ve většině případů se karcinomy objevují ve velkých cestách dýchacích (primární a sekundární průdušky).[10]Tyto typy karcinomu rychle rostou a šíří se již v rané fázi onemocnění. V šedesáti až sedmdesáti procentech případů u nich dochází k metastázím. Tento typ rakoviny plic velmi významně souvisí s kouřením.[1]
Další typy karcinomu
Rozeznáváme čtyři hlavní histologické podtypy, ačkoli některé karcinomy mohou být tvořeny kombinací různých podtypů.[44] Mezi vzácné podtypy patří nádory žláz, karcinoidní tumory a nediferencované karcinomy.[1]
Šíření metastáz
| Histologický ytp | Imunozbarvení |
|---|---|
| Spinocelulární karcinom | CK5/6 pozitivní CK7 negativní |
| Adenokarcinom | CK7 pozitivní TTF-1 pozitivní |
| Velkobuněčný karcinom | TTF-1 negativní |
| Malobuněčný karcinom | TTF-1 pozitivní CD56 pozitivní Chromogranin pozitivní Synaptofyzin pozitivní |
Plíce jsou místem, kam se běžně rozšiřují tumory z jiných částí těla. Sekundární karcinomy jsou klasifikovány podle místa jejich vzniku; například karcinom prsu, který se rozšířil do plic, se nazývá metastatický karcinom prsu. Na rentgenovém snímku mají metastázy často charakteristický zakulacený vzhled.[48]
Primární karcinomy plic nejběžněji metastázují do mozku, kostí, jater a nadledvinek.[8] Imunozbarvení během biopsie je často užitečné pro určení původního zdroje.[49]
Klasifikace stádií
Klasifikace stádií karcinomu plic je posouzení stádia rozšíření karcinomu z jeho původního zdroje. Je jedním z faktorů ovlivňujících prognózu a potenciální způsob léčby karcinomu plic.[1]
Počáteční vyhodnocení stádia nemalobuněčného karcinomu plic (NSCLC) využívá klasifikaci TNM. Ta je založena na velikosti primárního tumoru, postižení lymfatických uzlin (lymph node) a vzdálenosti metastáz. Poté je za využití těchto TNM deskriptorů karcinom zařazen do jedné ze skupin - od okultní (skryté) fáze karcinomu až po stádia 0, IA (jedna A), IB, IIA, IIB, IIIA, IIIB a IV (čtyři). Toto rozdělení stádií do skupin napomáhá určení způsobu léčby a odhadu prognózy.[50]
Malobuněčné karcinomy plic (SCLC) jsou tradičně klasifikovány jako karcinomy „nepokročilého stádia“ (rozšíření pouze do poloviny hrudníku a v rozsahu jednoho radiačního pole s využitím radioterapie únosného stupně) nebo jako karcinomy „pokročilého stádia“ (výraznější rozšíření onemocnění).[1] I tak je ale klasifikace TNM a zařazení do jedné ze skupin užitečné při odhadu prognózy.[50]
V případě NSCLC i SCLC jsou dvěma hlavními hledisky posouzení pokročilosti nemoci klinická a chirurgická klasifikace stádia. Klinická klasifikace stádia se provádí před samotným chirurgickým zákrokem. Je založena na výsledcích snímkování (například CT snímky a PET snímky) a na výsledcích biopsie. Chirurgická klasifikace stádia je vyhodnocena během operace nebo po ní a základem pro ni jsou kombinované výsledky chirurgických a klinických nálezů včetně chirurgicky odebraného vzorku hrudních lymfatických uzlin.[8]
Prevence
Prevence je z hlediska nákladů nejefektivnějším prostředkem ke snižování počtu případů karcinomu plic. Ačkoli ve většině zemí byly karcinogeny v domácím i průmyslovém prostředí identifikovány a zakázány, kouření tabáku je stále velmi rozšířené. Eliminace kouření tabáku je primárním cílem prevence rakoviny plic a skoncování s kouřením je v rámci tohoto procesu důležitým nástrojem prevence.[51]
Opatření a zásahy k omezení pasivního kouření na veřejných místech, například v restauracích a na pracovištích, jsou nyní běžné v mnoha západních zemích.[52] Bhútán zavedl úplný zákaz kouření v roce 2005,[53] Indie uplatňuje zákaz kouření na veřejných místech od října 2008.[54] Světová zdravotnická organizace vyzývá vlády, aby prosadily úplný zákaz reklamy tabákových výrobků, aby mladí lidé s kouřením vůbec nezačínali. Tato organizace soudí, že tam, kde byl tento zákaz zaveden, spotřeba tabákových výrobků klesla o 16 %.[55]
Dlouhodobé užívání doplňkového vitaminu A,[56][57] vitaminu C,[56] vitaminu D[58] nebo vitaminu E[56] riziko vzniku rakoviny plic nesnižuje. Na základě některých studií se zdá, že pro lidi, kteří konzumují v potravě vyšší množství zeleniny a ovoce, je obvyklé nižší riziko onemocnění rakovinou,[20][59] to je však pravděpodobně výsledek zavádějících faktorů. Preciznější studie jasnou souvislost neprokázaly.[59]
Screening
Screening je využití lékařských vyšetření s cílem rozpoznat jistou chorobu u osob bez symptomů. Lékařská vyšetření, s jejichž pomocí lze rakovinu plic určit, zahrnují cytologické vyšetření sputa, rentgen plic (RTG plic) a počítačovou tomografii (CT). Screeningové programy využívající RTG plic nebo cytologické vyšetření neprokázaly podstatný přínos.[60] Každoroční vyšetření osob podléhajících vysokému riziku (tedy ve věku 55 až 79 let, které kouřily více než 30 balíčkoroků nebo které v minulosti trpěly rakovinou plic) pomocí CT snímkování o snížených dávkách záření může snížit riziko úmrtí na rakovinu plic o absolutní hodnotu 0,3 % (relativní hodnota 20 %).[61][62] Počet falešně pozitivních CT snímků je však značný a může vyústit v řadu nepotřebných invazivních zákroků i značné finanční náklady.[63] Na každý skutečně pozitivní snímek připadá více než 19 falešně pozitivních.[64] Dalším potenciálním rizikem je vystavení pacientů záření během CT snímkování.[65]
Léčba
Léčba rakoviny plic závisí na specifickém typu rakovinných buněk, pokročilosti onemocnění a na tom, jaký je celkový fyzický stav nemocného. Běžné léčebné postupy zahrnují paliativní péči,[66] chirurgický zákrok, chemoterapii a radioterapii.[1]
Chirurgický zákrok

Pokud vyšetření potvrdí nemalobuněčný karcinom plic, musí být posouzena fáze pokročilosti rakoviny, aby bylo možno určit, zda je onemocnění lokalizováno a řešitelné operací či zda se natolik rozšířilo, že operativní zákrok by již neměl smysl. K tomu se využívá počítačová tomografie a pozitronová emisní tomografie.[1] Pokud existuje podezření, že jsou zasaženy i mezihrudní lymfatické uzliny, lze pro odebrání vzorků z uzlin a stanovení pokročilosti nemoci využít mediastinoskopii.[67] K posouzení skutečnosti, zda je nemocný schopen operaci podstoupit, se využívají i rozbory krve a vyšetření funkce plic.[10] Pokud vyšetření plic odhalí slabou respirační rezervu, chirurgický zákrok pravděpodobně nebude vhodným řešením.[1]
Ve většině případů raného nemalobuněčného karcinomu plic se upřednostňuje odstranění plicního laloku (lobektomie). U těch osob, jejichž celkový stav nedovoluje lobektomii celého laloku, lze provést resekci menšího rozsahu (klínovitá resekce). U tohoto typu resekce však existuje vyšší riziko recidivy rakoviny než u lobektomie.[68] Radioaktivní brachyterapie jodovými zrny v okrajových oblastech klínovité excize může riziko recidivy snížit.[69]Velmi zřídka se provádí odstranění celé plíce (pneumonektomie).[68] Videoasistovaná torakoskopická operace a videoasistovaná lobektomie jsou založeny na minimálně invazivním postupu při operaci rakoviny plic.[70] Videoasistovaná lobektomie je ve srovnání s konvenční otevřenou lobektomií stejně efektivní, navíc však není v takovém množství doprovázena postoperačními onemocněními.[71]
U malobuněčného karcinomu plic se obvykle používá chemoterapie a/nebo radioterapie.[72] Význam chirurgického zákroku pro léčbu malobuněčného karcinomu plic je však předmětem úvah. V rané fázi SCLC může operační zákrok zlepšit možné výsledky, pokud je doprovázen chemoterapií a radioterapií.[73]
Radioterapie
Radioterapie neboli ozařování se často kombinuje s chemoterapií a u osob trpících NSCLS, které nemohou podstoupit chirurgický zákrok, může být kurativně cílená. Tato forma vysoce intenzivní radioterapie se nazývá radikální radioterapie.[74] Zpřesněnou formou tohoto postupu je kontinuální hyperfrakcionovaná akcelerovaná terapie (CHART), během níž je pacient vystaven vysoké dávce radioterapie v krátkém časovém úseku.[75] Pooperační radioterapie hrudní stěny by obecně po kurativní operaci NSCLC neměla být použita,[76] může být ale prospěšná pro nemocné, jejichž mezihrudní lymfatické uzliny N2 byly nemocí zasaženy.[77]
U potenciálně vyléčitelných případů malobuněčného karcinomu plic se často doporučuje radioterapie hrudníku jako doplněk k chemoterapii.[8]
Pokud rakovinný nádor blokuje krátký úsek průdušky, může lékař použít brachyterapii (lokalizovanou radioterapii), a to přímo v dýchacích cestách, aby byla obnovena jejich průchodnost.[78]Ve srovnání s radioterapií externím paprskem umožňuje brachyterapie zkrácení doby léčby a nižší vystavení radioaktivnímu záření pro zdravotníky.[79]
Profylaktická kraniální iradiace (PCI) je typem radioterapie mozku, užívaným ke snížení rizika vzniku metastáz. Tento léčebný postup je nejvhodnější pro malobuněčný karcinom plic. U nepokročilé fáze nemoci zvyšuje míru tříletého přežití z 15 % na 20 %; u onemocnění v pokročilém stadiu se jednoleté přežití zvyšuje z 13 % na 27 %.[80]
Nedávná zlepšení technik zacílení a zobrazování vedla ke vzniku stereotaktického ozařování při léčbě raných fází rakoviny plic. Při této formě radioterapie je pacient vystaven vysokým dávkám záření při malém počtu vyšetření za použití stereotaktických lokalizačních technik. Využívá se zejména u pacientů, kteří v důsledku souběžných onemocnění nemohou podstoupit chirurgický zákrok.[81]
Ke kontrole symptomů u pacientů trpících nemalobuněčným i malobuněčným karcinomem plic lze využít ozařování hrudníku v menších dávkách (paliativní radioterapie).[82]
Chemoterapie
Nasazení léčby chemoterapií závisí na typu nádoru.[8] Malobuněčný karcinom plic (SCLC), a to i relativně raná fáze nemoci, se léčí především chemoterapií a radioterapií.[83] U malobuněčného karcinomu plic se nejčastěji užívá cisplatina a etoposid.[84] Kombinují se také s karboplatinou, gemcitabinem,paklitaxelem, vinorelbinem, topotecanem a irinotecanem.[85][86] U pokročilého nemalobuněčného karcinomu plic (NSCLC) zvyšuje chemoterapie pravděpodobnost přežití a užívá se jako primární léčba za předpokladu, že nemocný je schopen tuto léčbu podstoupit.[87] Obvykle se podávají dva léčivé přípravky, z nichž jeden je vždy na bázi platiny (buď cisplatina nebo karboplatina). K dalším často užívaným lékům patří gemcitabin, paklitaxel, docetaxel,[88][89] pemetrexed,[90] etoposid a vinorelbin.[89]
Adjuvantní chemoterapie označuje nasazení chemoterapie po léčebném chirurgickém zákroku za účelem zlepšení vyhlídky léčení. U nemalobuněčného karcinomu jsou z blízkých lymfatických uzlin během zákroku odebrány vzorky, jež pak slouží k určení fáze pokročilosti nemoci. Pokud je potvrzena II. či III. fáze onemocnění, může adjuvantní chemoterapie zvýšit míru přežití v následujících pěti letech o 5 %.[91][92] Kombinované podávání vinorelbinu a cisplatiny vykazuje vyšší účinek než dřívější metody léčby.[92] Adjuvantní chemoterapie u osob trpících rakovinou ve fázi IB je kontroverzní, neboť klinické studie neprokázaly jasně její přínos pro délku přežití.[93][94] Studie zaměřené na výzkum předoperační chemoterapie (neoadjuvantní chemoterapie) u resektabilního nemalobuněčného karcinomu nepřinesly jednoznačný závěr.[95]
Paliativní péče
U osob trpících terminálním onemocněním může být vhodná paliativní péče či pobyt v hospici.[10] Tyto způsoby péče umožňují dodatečnou diskusi o možnostech léčby a nabízejí příležitost dobře zvážit všechna rozhodnutí;[96][97] mohou také předejít nevhodné a nákladné péči v závěrečné fázi života nemocného.[97]
Při léčbě nemalobuněčného karcinomu plic lze chemoterapii kombinovat s paliativní péčí. U pokročilých případů zlepšuje vhodná chemoterapie průměrnou dobu přežití ve srovnání s pouhým využitím podpůrné péče, a zvyšuje také kvalitu života.[98] U nemocných s adekvátní tělesnou zdatností umožňuje udržovací chemoterapie nasazená v rámci paliativní péče prodloužení života o 1,5 až 3 měsíce, úlevu od symptomů a zlepšení kvality života. U moderních prostředků jsou zaznamenané výsledky lepší.[99][100] Spolupracující skupina odborníků pro metaanalýzu nemalobuněčného karcinomu plic doporučuje, aby u případů karcinomu plic v pokročilém stadiu byla zvážena chemoterapie, pokud s ní nemocný souhlasí a je schopen ji podstoupit.[87][101]
Prognóza
| Klinické stadium | Pětileté přežití (%) | |
|---|---|---|
| Nemalobuněčný karcinom plic | Malobuněčný karcinom plic | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Prognóza je obecně špatná. Z osob diagnostikovaných s rakovinou plic přežije prvních pět let od diagnózy 15 % z nich.[2] V době diagnózy je stadium nemoci již často pokročilé. Při prvním projevu onemocnění je ve fázi IV 30–40 % případů nemalobuněčného karcinomu a 60 % případů malobuněčného karcinomu.[8]
Prognostické faktory nemalobuněčného karcinomu plic zahrnují výskyt příznaků plicní choroby, velikost tumoru, buněčný typ (histologie), stupeň rozšíření (pokročilost), metastázy v mnohočetných lymfatických uzlinách a vaskulární invazi. U osob s neoperovatelným onemocněním jsou možné výsledky horší u skupiny se špatným celkovým fyzickým stavem a více než 10% úbytkem hmotnosti.[102] K prognostickým faktorům malobuněčného karcinomu plic patří celkový fyzický stav, pohlaví, stadium nemoci a zasažení centrálního nervového systému či jater v okamžiku diagnózy.[103]
U nemalobuněčného karcinomu plic je nejlepší prognózy dosaženo kompletní chirurgickou resekcí ve stadiu IA. Přežití po pěti letech pak činí až 70 %.[104] U malobuněčného karcinomu je celková míra přežití po pěti letech kolem 5 %.[1] Nemocní s pokročilým malobuněčným karcinomem plic mají průměrnou šanci na pětileté přežití nižší než 1 %. Průměrná doba přežití u nemocných v nepokročilé fázi nemoci je 20 měsíců, míra pětiletého přežití pak 20 %.[2]
Na základě údajů poskytnutých Národním ústavem pro léčbu rakoviny je průměrný věk při diagnóze rakoviny plic ve Spojených státech 70 let,[105] průměrný věk při úmrtí na následky nemoci pak 72 let.[106] Nemocní se zdravotním pojištěním mají ve Spojených státech větší nadějí na lepší výsledek léčby.[107]
Epidemiologie

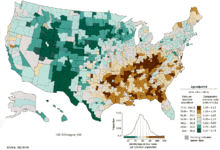
Na celém světě je rakovina plic nejčastější formou rakoviny jak ve smyslu výskytu, tak úmrtnosti. V roce 2008 bylo zaznamenáno 1,61 milionu nových případů a 1,38 milionu úmrtí na následky rakoviny plic. Nejvyšší četnost výskytu nemoci je v Evropě a Severní Americe.[11] Populační skupina, u níž je pravděpodobnost vzniku onemocnění nejvyšší, jsou osoby starší 50 let, které v minulosti kouřily. V protikladu k úmrtnosti mužů, která začala před více než 20 lety klesat, má úmrtnost na rakovinu plic u žen v posledních dvou dekádách stoupající tendenci, a teprve v poslední době se začala stabilizovat.[109] V USA je celoživotní riziko onemocnění rakovinou plic 8 % u mužů a 6 % žen.[1]
Na každé 3-4 miliony vykouřených cigaret připadá jedno úmrtí na rakovinu plic.[1][110] Vliv velkých tabákových společností, tzv. "Big Tobacco", hraje v kultuře kouření podstatnou roli.[111] U mladých nekuřáků, obklopených reklamou na tabákové výrobky, je vyšší pravděpodobnost, že začnou kouřit.[112] Vliv pasivního kouření je při vzniku rakoviny plic ve stále vyšší míře uznáván jako rizikový faktor,[24] což vede k úpravě zákonů s cílem snížit nežádoucí vystavení nekuřáků tabákovému kouři.[113] Potenciální riziko představují také emise z automobilů, továren a elektráren.[4]
Ve východní Evropě byla zaznamenána nejvyšší úmrtnost na následky rakoviny plic mezi muži, zatímco v severní Evropě a USA je nejvyšší úmrtnost na následky této nemoci mezi ženami. Ve Spojených státech je výskyt rakoviny vyšší u černošských žen a mužů.[114] Výskyt rakoviny plic v rozvojových zemích je v současné době omezený.[115] Počet kuřáků v těchto státech ale stoupá, a proto se očekává nárůst výskytu této nemoci v několika následujících letech, a to zejména v Číně[116] a Indii.[117]
Od 60. let 20. století začala četnost výskytu adenokarcinomu plic ve srovnání s jinými typy rakoviny plic stoupat. Příčinou je hlavně zahájení prodeje cigaret s filtrem. Použití filtru odstraňuje z tabákového kouře větší částice a omezuje ukládání nánosu ve velkých dýchacích cestách. Kuřák však musí vdechovat hlouběji, aby dostal tutéž dávku nikotinu, a tím dochází ke zvýšenému ukládání částic v malých dýchacích cestách, kde obvykle adenokarcinom vzniká.[118] Četnost výskytu adenokarcinomu plic se tak neustále zvyšuje.[119]
Historie
Před příchodem kouření cigaret byla rakovina plic poměrně řídkým onemocněním, a až do roku 1761 nebyla dokonce chápána jako specifická nemoc.[120] V roce 1810 byla řada aspektů rakoviny plic popsána podrobněji.[121]Zhoubné nádory plic tvořily v roce 1878 pouze 1 % všech typů rakoviny potvrzené při pitvě, na počátku 20. století však tento počet vzrostl na 10–15 %.[122] V roce 1912 bylo v odborné literatuře zaznamenáno celosvětově pouze 374 případových studií,[123]revize pitev však prokázala, že výskyt rakoviny plic vzrostl z 0,3 % v roce 1852 na 5,66 % v roce 1952.[124] Roku 1929 rozpoznal lékař Fritz Lickint v Německu souvislost mezi kouřením a rakovinou plic,[122] což vedlo k razantní protikuřácké kampani.[125] Studie britských lékařů, publikovaná v 50. letech 20. století, je považována za první solidní epidemiologický důkaz souvislosti mezi rakovinou plic a kouřením.[126] V důsledku toho doporučil v roce 1964 vedoucí amerického úřadu pro zdravotnictví, aby kuřáci od kouření upustili.[127]
Vliv vzácného plynu radonu na vznik rakoviny plic byl poprvé zaznamenán u horníků z Krušných hor poblíž Schneebergu v Sasku. Stříbro se tam těžilo od roku 1470; tyto doly jsou bohaté na uran, jehož výskyt je doprovázen přítomností rádia a radonu.[128] Horníci byli v nepřiměřeně vysoké míře postihováni plicní chorobou, jež byla v 70. letech 19. století nakonec potvrzena jako rakovina plic.[129] Navzdory tomu dolování pokračovalo až do 50. let 20. století, a to zejména v důsledku poptávky po uranu v SSSR.[128] V 60. letech 20. století bylo prokázáno, že radon rakovinu plic skutečně způsobuje.[130]
První úspěšná pneumonektomie u rakoviny plic byla provedena v roce 1933.[131] Paliativní radioterapie se používá od 40. let 20. století.[132] Radikální radioterapie, poprvé uplatněná v 50. letech 20. století, byla pokusem o nasazení vyšších dávek radiace u pacientů v relativně rané fázi rakoviny plic, kteří však z různých důvodů nemohli podstoupit chirurgický zákrok.[133] Kontinuální hyperfrakcionovaná akcelerovaná terapie byla v roce 1997 chápána ve srovnání s konvenční radikální radioterapií jako krok vpřed.[134] Počáteční pokusy o chirurgickou resekci[135] a radikální radioterapii[136] z 60. let 20. století u malobuněčného karcinomu plic byly neúspěšné. V další dekádě pak byla úspěšně vyvinuta léčba chemoterapií.[137]
Bibliografia
[1] [3] [6] [7] [47] [48] [10] [12] [13] [15] [18] [16] [17] [23] [26] [28] [5] [37] [38] [39] [40] [41] [53] [89] [84] [85] [86] [93] [94] [95] [74] [76] [46] [103] [2] [108] [109] [111] [115] [117] [118] [120] [121] [122] [123] [124] [125] [126] [127] [128] [131] [132] [133] [134] [135] [136] [137]
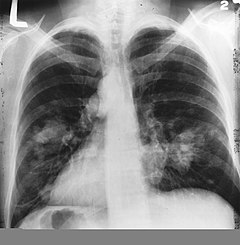
Karcinom plic, obecně známý jako rakovina plic, je onemocnění, při kterém nekontrolovaně rostou buňky v plicních tkáních. Tento růst může vést k metastáze, což je invaze do přilehlé tkáně a infiltraci mimo plíce. Převážná většina rakoviny plic jsou karcinomy plic, odvozených z buněk epitelové tkáně. Rakovina plic je nejběžnější příčina rakoviny, vedoucí ke smrti u mužů. Celosvětově je zodpovědná za smrt 1,3 milionů mužů a také žen ročně.[138] Nejběžnějšími příznaky jsou dechová nedostatečnost, kašel (včetně vykašlávání krve) a ztráty váhy.[1]
Hlavními typy karcinomu plic jsou nemalobuněčný typ a malobuněčný typ[139]. Toto rozlišení je důležité, protože léčba je u každého jiná; nemalobuněčný plicní karcinom (NSCLC) se někdy léčí chirurgicky, zatímco malobuněčný plicní karcinom (SCLC) má obvykle lepší odezvu na léčbu chemoterapií a ozařováním.[140] Nejběžnější příčinou rozvinutí karcinomu plic je dlouhodobé vystavení kouření tabáku.[2] Výskyt karcinomu plic u nekuřáků, kterých je až 15% všech případů karcinomu plic[3], je často přisuzována ke kombinaci genetických faktorů,[141][142] radonového plynu,[143][144] azbestu,[5] a znečištění vzduchu,[145][146][147] včetně pasívního kouření.[148][149]
Karcinom plic může být zobrazen plicním rentgenem a na počítačové tomografii (CT snímek). Dlouhodobě uznávanou diagnostikou je biopsie. Je obvykle prováděna pomocí bronchoskopie nebo biopsií, vedenou pomocí CT. Léčba a prognózy závisí na histologickém typu karcinomu, stupni rozšíření a pacientově výkonu. Možností léčby jsou chirurgie, chemoterapie a radioterapie. S léčbou přežívá pět let 14% pacientů.[1]
Klasifikace
Naprostou většinou karcinomů plic jsou karcinomy maligní, které vyrůstají z epitelových buněk. Existují dva druhy karcinomu plic, kategorizované rozměrem a vzhledem maligních buněk zobrazených při histologickém vyšetření pod mikroskopem: Procentního zastoupením dosahuje karcinom plic nemalobuněčný (80.4 %) a malobuněčný (16.8 %).[150] Tato klasifikace, založená na histologických kritériích má důležitou úlohu pro klinický management a prognózy vývoje onemocnění.
| Histologický typ | Frekvence (%) |
|---|---|
| Nemalobuněčný karcinom plic | 80.4 |
| Malobuněčný karcinom plic | 16.8 |
| Karcinoid[151] | 0.8 |
| Sarkom[152] | 0.1 |
| Nespecifikovaný plicní karcinom | 1.9 |
Nemalobuněčný typ karcinomu plic (NSCLC)
Nemalobuněčné typy karcinomu plic jsou společnou skupinou, protože jejich prognózy a management jsou podobné. Existují tři hlavní podskupiny: SCC karcinom, adenokarcinom a velkobuněčný typ karcinomu plic.
| Histologický podtyp | Frekvence nemalobuněčného typu karcinomu plic (%) | ||
|---|---|---|---|
| Kuřáci | Nikdy nekouřící | ||
| Spinocelulární karcinom plic | 42 | 33 | |
| Adenokarcinom | Adenokarcinom (není-li uvedeno jinak) | 39 | 35 |
| Bronchioloalveolární karcinom | 4 | 10 | |
| Karcinoid | 7 | 16 | |
| Další | 8 | 6 | |
Na přibližně 25% rakoviny plic se podílí[150] SCC karcinom, který obvykle začíná růst uprostřed průdušky. Střed tumoru je většinou tvořen prázdnou dutinou a spojen s nekrózou tkáně. Dobře rozlišitelný SCC karcinom často roste mnohem pomaleji než ostatní typy karcinomů.[140]
Adenokarcinom má na svědomí okolo 40% karcinomu plic.[150] Obvykle vzniká na okraji plicní tkáně. Většina případů vzniku adenokarcinomu je spojena s kouřením. A dále také vzniká i u lidí, kteří nikdy nekouřili ("nikdy nekouřící"). Adenokarcinom je nejběžnějším typem rakoviny plic.[45] Podtyp adenokarcinomu, bronchioloalveolární karcinom je častější u nikdy nekouřících žen a může mít i odlišné odezvy na léčbu.[46]
Malobuněčný typ karcinomu plic (SCLC)

Malobuněčný typ karcinomu plic (SCLC, zvaný také jako "karcinom ovesných buněk") je již méně častý. Má tendenci růst do horních cest dýchacích (primární a sekundární průduška) a roste rychle a do velkých rozměrů.[10] "Ovesná" buňka obsahuje hustou změť neurosekretních granulí (vezikuly obsahující neuroendokrinní hormony), který je s tímto endokrinním/paraneoplastickým syndromem spojen.[47] Zatímco zpočátku je citlivější k chemoterapii, v konečném důsledku přináší horší prognózy a ve výsledku končí metastázou. Malobuněčný karcinom plic je rozdělen do omezené fáze a rozšířené fáze onemocnění. Tento druh karcinomu plic je ostře spojován s kouřením.[154]
Další
U kojenců a dětí je nejběžnějším typem rakoviny pleuropulmonární blastoma a karcinoidní tumor.[155]
Sekundární karcinom
Plíce jsou běžným místem pro metastázu tumorů z dalších částí těla. Tyto sekundární karcinomy jsou nazvány podle místa původu; například karcinom prsu, metastazovaný do plic je stále karcinom prsu. Mají často charakteristický kruhový vzhled na vyobrazení na plicním rentgenu.[48] U dětí je většina druhů karcinomu plic sekundární.[155]
Primární formy karcinomu plic běžně metastazují do nadledvin, jater, mozku a kostí.[140]
Fáze
Fáze rakoviny plic je soubor stupňů šíření karcinomu ze svého počátečního zdroje. Jedná se o důležitý faktor ovlivňující prognózy počáteční léčby karcinomu plic. Nemalobuněčný typ karcinomu plic (NSCLC) začíná fází IA ("jedna A"; nejlepší prognóza) IV ("čtyři"; nejhorší prognóza).[156] Malobuněčný typ karcinomu plic je klasifikován jako limitovaná fáze, pokud je omezen na jednu polovinu hrudníku (pod rentgenem); jinak se jedná rozšířenou fázi.[10]
Znaky a symptomy
Symptomy, které ukazují na karcinom plic jsou:[157]
Pokud karcinom roste v dýchacích cestách, může blokovat průtok vzduchu a způsobovat dýchavičnost. Tento stav může vést k hromadění sekretů za překážkou a u pacienta se může dostavit zápal plic. Mnoho plicních nádorů je bohatě zásobováno krví. Povrch nádoru může být křehký a může vést ke krvácení do dýchacích cest. Tato krev může být následně vykašlávána.
V závislosti na druhu tumoru, takzvaném paraneoplastickém syndromu, může tento stav na počátku přitahovat pozornost k nemoci.[12] U karcinomu plic mohou těmito fenomény být Lambert-Eatonův myastenický syndrom (svalová slabost kvůli autoimunitnímu onemocnění), hypercalcemie nebo nepřiměřená sekrece antidiuretického hormonu (SIADH). Tumor v horní části plic (apex), známý jako Pancoastův syndrom,[158] může zasáhnout lokální část sympatikového nervového systému, vedoucímu ke změnám v pocení a k problémům očního svalu (kombinace známá jako Hornův syndrom), stejně tak se může projevit svalová únava v rukou v důsledku invaze do brachial plexus.
Mnoho příznaků karcinomu plic (bolest kostí, únava a ztráta váhy) je nespecifických; u starých lidí mohou být spojovány s komordibitou.[140] U mnoha pacientů se karcinom rozšířil z místa původu jinam než vyhledali pomoc lékaře. Běžnými místy metastázy jsou mozek, kosti, nadledviny, kontralaterální (opačná) plíce, játra, perikard a ledviny.[13] Okolo 10% lidí s karcinomem plic nemá symptomy diagnostikovánu; tyto nádory jsou náhodně nalezeny až při rutinní prohlídce pod rentgenem.[1]
Příčiny
Mezi hlavní příčiny karcinomu plic (a rakoviny obecně) patří karcinogeny (jako jsou ty, v cigaretovém kouři), ionizující záření a virové infekce. Toto vystavení způsobuje kumulativní změny DNA v tkáňovém vedení průdušek plic (bronchiální epitelová tkáň). Čím více se tkáň stává poškozenější, tím větší je pravděpodobnost vzniku rakoviny.[140]
Kouření

Kouření, zejména cigaret, patří ke zdaleka největšímu původci smrtelného karcinomu plic.[159] Téměř 90% úmrtí na karcinom plic v rozvinutých zemích je způsobeno kouřením.[18] V USA je kouření přičítáno na 87 % případů karcinomu plic (90 % u mužů a 85 % u žen).[160] U kuřáků mužů je životní získání karcinomu plic 17.2 %; u ženských kuřáků je riziko karcinomu 11.6 %. Toto riziko je znatelně menší u nekuřáků: 1.3% u mužů a 1.4% u žen.[161] Cigaretový kouř obsahuje přes 60 známých karcinogenů,[16] včetně rozpadové řady radionuklidů radonu, nitrosaminu a benzopyrenu. Také se zdá, že nikotin potlačuje imunitní odezvu na růst maligních nádorů u tkání.[162]
S dobou, po kterou osoba kouří (stejně jako s počtem), stoupá riziko, že se u osoby rozvine karcinom plic. Pokud osoba přestane kouřit, tato šance se stále stabilně snižuje, jak se plíce čistí od polutantů, které jsou nakonec úplně odstraněny.[163] Kromě toho existují důkazy, že rakovina plic u nekuřáků má lepší prognózy než u kuřáků,[164] a také, že pacienti, kteří kouřili v době diagnostikování nemoci mají kratší čas na přežití než ti, kteří přestali zcela kouřit.[165]
Pasivní kouření—inhalace kouře od jiných—je příčinou karcinomu plic u nekuřáků. Pasivní kuřák může být klasifikován jako někdo, kdo žije nebo pracuje s kuřákem. Studie z USA,[166] Evropy,[167] Velké Británie,[168] a z Austrálie[23] trvale ukazují závažný nárůst relativního rizika u osob vystavených pasivnímu kouření. Současná šetření proudu bočního dýmu ukazují, že je to mnohem nebezpečnější, než přímá inhalace kouře.[26]
Zhruba 10–15 % pacientů s karcinomem plic nikdy nekouřilo.[169] To znamená, že 20,000 až 30,000 nikdy nekouřících lidí je každý rok v USA diagnostikováno na karcinom plic. Právě kvůli pětiletému přežití každý rok v USA zemře více nekuřáků na karcinom plic, než všech pacientů na leukémii, rakovinu vaječníků nebo AIDS.[170]
Radon
Radon je plyn bez barvy a zápachu, vytvářející se při rozpadu radioaktivního rádia, který je rozpadovým produktem uranu, nacházejícího se v zemské kůře. Záření rozpadajících se produktů ionizuje genetický materiál, způsobuje mutace, které občas přejdou v karcinom. Vystavení se radonu při kouření je druhou nejčastější příčinou vzniku karcinomu plic.[143] Úroveň plynu radonu se mění podle lokality a stavby půdy a skal pod povrchem. Například v oblasti, jako je Cornwall ve Velké Británii (která má granit jako podklad), je plynný radon hlavním problémem a budovy musí být nuceně odvětrávány ke snížení koncentrace radonu. United States Environmental Protection Agency (EPA) odhaduje, že každý 15. dům v USA má hodnoty radonu nad povolenoumírou 4 pikocurie na litr (pCi/L) (148 Bq/m³).[28] Iowa má nejvyšší průměrné koncentrace radonu ve Spojených Státech; studie tam prokázaly 50% nárůst rizika karcinomu plic při dlouhodobém vystavení nad EPA donotu, která je 4 pCi/L.[171][172]
Azbest
Azbest může způsobovat množství plicních chorob, včetně karcinomu plic. Existuje synergický efekt mezi kouřením tabáku a vystavením azbestu při formování karcinomu plic.[5] Ve Velké Británii azbest způsobuje okolo 2–3% úmrtí na karcinom plic u mužů.[173] Azbest také může způsobit karcinom pohrudnice, zvaný rakovina pohrudnice (který je odlišný od karcinomu plic).
Viry
O virech je známo, že způsobují karcinom plic u zvířat,[174][175] a poslední důkazy ukazují na to, že podobné nebezpečí hrozí u lidí. Propletenec virů včetně lidského papilomaviru,[176] JC virus,[177] simian virus 40 (SV40), BK virus a cytomegalovirus.[178] Tyto viry mohou napadnout buněčný cyklus a při potlačení apoptózy způsobit nekontrolované dělení buněk.
Patogeneze
Podobně jako u dalších druhů karcinomů, tak je i karcinom plic inicializován onkogenz nebo deaktivací tumory potlačujících genů.[37] Onkogeny jsou geny u kterých se zdá, že lidé s ním budou více citlivější k tvorbě karcinomu. U protoonkogenů se předpokládá, že se dokáží změnit v onkogeny, pokud jsou vystaveny určitým karcinogenům.[38] Mutace v K-ras proto-onkogenu jsou zodpovědné za 10–30% plicních adenokarcinomů.[39][40] Receptor epidemárního růstového faktoru (EGFR) omezuje bujení buňky, apoptózu, angiogenezi a invazi tumoru.[39] Mutace a rozšíření EGFR je běžnější u nemalobuněčného karcinomu plic a umožňuje založit léčbu pomocí EGFR-inhibitorů. Her2/neu není zasažen tak často.[39] Chromozomální poškození může vést ke ztrátě heterozygosity. Tento projev může způsobit deaktivaci tumory potlačujících genů. Poškození genů 3p, 5q, 13q, a 17p u malobuněčného karcinomu plic velice běžné. Tumor potlačující gen p53, umístěný v chromozomu 17p, je zasažen v 60-75% případů.[41] Dalšími geny, které jsou často zmutovány nebo zesíleny jsou c-MET, NKX2-1, LKB1, PIK3CA a BRAF.[39]
S karcinomem plic je spojováno několik genetických polymorfismů. Tyto obsahují polymorfismy v genovém kódování na interleukin-1,[179] cytochrome P450,[180] spouštěče apoptózy jako caspase-8,[181] molekuly pro opravu DNA jako je XRCC1.[182] Lidé s těmito polymorfismy jsou více vnímavější k rozvinutí karcinomu plic po vystavení se karcinogenům.
Současné studie ukazují, že při projevu genu MDM2 309G existuje malé riziko, že se rozvine karcinom u Asiatů.[183]
Diagnóza

Vyšetření na plicním rentgenu je prvním krokem, pokud má pacient symptomy, které mohou ukazovat na karcinom plic. Ten může odhalit zřejmé hromadění, šíření mediastinu (pokud vypadá na šíření do lymfatických uzlin), atelektázu (kolaps), kondolizovaný (zápal plic) nebo výpotek na plicích. Pokud není po radiologickém vyšetření nález, ale podezření je vysoké (například těžký kuřák vykašlávající krev), tak může bronchoskopie anebo CT scan ukázat potřebné informace. Bronchoskopie nebo biopsie je často užívanou metodou k identifikaci typu tumoru.[1]
Abnormální nálezy v buňkách ("atypia") v hlenu jsou spojeny s vyšším rizikem rakoviny plic. Cytologické vyšetření hlenu spolu s dalšími postupy screeningu mohou mít roli v časné detekci karcinomu plic.[184]

U pacientů, kteří vykazují abnormality při rentgenu plic, ukazující na karcinom plic, stejně jako nezhoubné nemoci, je použita rozdílná diagnostika. Tyto obsahují nemoci jako je infekční tuberkulóza nebo zápal plic či zánětlivé stavy jako je sarkoidóza. Tato onemocnění mohou vyvrcholit v medianastální lymfatodenopatii nebo v uzliny, a někdy se tváří jako karciom plic.[140] Karcinom plic může být také náhodným lálezem: Solitární plicní uzlina (nazývaná také jako mincová léze) na plicním rentgenu nebo CT scanu nemusí mít související důvody.
Prevence
Prevence je nejlevnějším způsobem boje proti karcinomu plic. Zatímco ve většině zemí byla převážná část průmyslových a domácích karcinogenů zakázána, kouření tabáku je stále široce rozšířeno. Eliminace kouření tabáku je primárním cílem v prevenci karcinomu plic a odvykání kouření je důležitým preventivním nástrojem v tomto procesu.[185] Nejdůležitějším prvkem jsou preventivní programy zaměřené na mládež. V roce 1998 vznikl v USA Master Settlement Agreement, který ve 46 státech nařizoval tabákovým společnostem každoroční platbu.[186] Z vybraných prostředků za tabák byly v jednotlivých státech USA pomocí úřadů veřejného zdraví založeny preventivní programy. Center for Disease Control doporučuje každoročně utratit 15 procent prostředků z daní za tabák na preventivní programy. Snahy budou v tomto směru i nadále pokračovat.[186]
V mnoha zemích Západní Evropy se stala více běžnou politická intervence proti pasivnímu kouření na veřejných místech jako jsou restaurace a pracoviště. Společně s Kalifornií, jejíž tažení vedlo v roce 1998 k zákazu kouření na veřejných místech. Irsko hrálo podobnou roli v Evropě roku 2004, následováno roku 2005 Itálií a Norskem. Skotsko s espolečně s dalšími státy připojilo roku 2006, Anglie v roce 2007, Francie v roce 2008 a Turecko v roce 2009. Na Novém Zealandu je zakázáno kouřit na veřejných místech od roku 2004. Himalájské království Bhútán zavedlo v roce 2005 úplný zákaz kouření, nejen na veřejných místech.[53] V mnoha zemích nadále pokračují kampaně za podobné zákazy. V roce 2007 se Chandigarh stalo prvním nekuřáckým městem v Indii. Indie představila úplný zákaz kouření na veřejných místech 2. října 2008.
Argumenty uváděné proti těmto zákazům jsou kriminalizace kouření, nárůst rizika pašování a riziko, že takový zákaz nemůže být zaveden.[187]
Dlouhodobé užívání multivitamínových přípravků s vitamínem C a D a kyseliny listové nezmenšuje rizika karcinomu plic. Naopak může dlouhodobé používání vysokých dávek přípravků s vitamínem D zvýšit riziko vzniku karcinomu plic.[188]
Světová zdravotnická organizace žádá vlády k zavedení úplného zákazu na tabákovou reklamu na ochranu mladých lidí, aby s kouřením případně vůbec nezačali. WHO oceňuje, že se v zemích, kde byly tyto zákony přijaty, snížila spotřeba tabáku o 16 %.[189]
Screening
Screening odkazuje na použití lékařského vyšetření k detekci nemoci u asymptomatických osob. Možnými screeningovými testy na karcinom plic je hrudní rentgen nebo počítačová tomografie (CT) hrudníku. Dosud však screeningové programy na karcinom plic nepřinesly konkrétní výhody. Na tomto poli probíhají náhodně kontrolovaná studie, aby se zjistilo, zda může být případná mortalita v dlouhém termínu vyšetřena přímo z CT screeningu.[190]
Léčba
Léčba karcinomu plic závisí na specifikách rakovinných buněk, na jejich rozšíření v těle a pacientově celkovém stavu. Běžná léčba zahrnuje chirurgii, chemoterapii a radioterapii.[1][191]
Operace
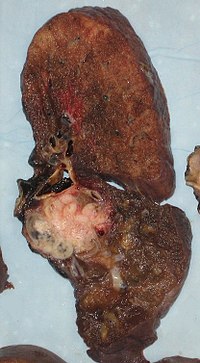
Lékařská vyšetření potvrdí rakovinu plic, buďto CT scanem nebo často pozitronovou emisní tomografií (PET), které zhodnotí, zda je nemoc nalezena a je jí možno odstranit nebo zda je již rozšířena za možnosti chirurgického zákroku.
Krevní testy a spirometrie (testování funkcí plic) jsou dalším nutným krokem ke zjištění, zda je pacient natolik zdráv, aby mohl být operován. Pokud spirometrie odhalí slabou respirační rezervu (často kvůli chronické obstrukční plicní nemoci), chirurgický zákrok může být kontraindikován.
Chirurgický zákrok samotný má procento úmrtnosti okolo 4.4%, v závislosti na pacientově funkci plic a dalších rizikových faktorech.[192] Chirurgický zákrok u nemalobuněčného karcinomu plic omezený na jednu plíci do stádia IIIA. Ta je hodnocena pomocí zobrazovací metody (počítačová tomografie, pozitronová emisní tomografie). U pacienta však musí být přítomna dostatečná respirační rezerva, která dovolí plicím fungovat i po odstranění části tkáně.
Procedura obsahuje resekci plic (odstranění části plicního laloku), segmentectomy (odstranění anatomického oddělení určitého plicního laloku), lobektomie (jeden lalok), bilobektomie (dva laloky) nebo pneumonektomie (celé plíce). U pacientů s adekvátní respirační rezervou je preferován výběr lobektomie, které minimalizuje možnost místního opakování. Pokud pro toto nemá pacient dost fungující plíce, může být provedena resekce plic.[193] Radioaktivního jódu brachyterapii na okraji klínové excize může snížit opakování jako u lobektomie. brachyterapie aktivním jódem na okrajích klínové excize může omezit možnost navrácení, jak je tomu u lobektomie.[194]
Videem asistovaná thorakoskopická operace VAT a VATS lobektomie dovolují minimální invazní zásah do karcinomu plic, které má výhody pro rychlejší uzdravení, kratší pobyt v nemocnici a minimalizuje lékařské výdaje.[195]
Chemoterapie
Malobuněčný typ karcinomu plic je primárně léčen chemoterapií a ozařováním, protože u chirurgie nejsou vykázány dostatečné výsledky pro přežití. Primární chemoterapie je také používána u metastáz při nemalobuněčném karcinomu plic.
Kombinace těchto postupů velmi záleží na typu tumoru. Nemalobuněčný typ karcinomu plic je často léčen pomocí cisplatinu nebo carboplatinu v kombinaci s gemcitabinem, paclitaxelem, docetaxelem, etoposidem nebo vinorelbinem.[89] U malobuněčného karcinomu plic jsou nejběžnějšími přípravky cisplatin a etoposide[84] Stejně tak jsou používány kombinace carboplatinu, gemcitabinu, paclitaxelu, vinorelbinu, topotecan a irinotecan[85][86] V rozvinuté fázi malobuněčného karcinomu plic může být bezpečně kombinován celecoxib s etoposidem, tato kombinace vykazuje zlepšení stavu[196]
Adjuvantní chemoterapie NSCLC
Adjuvantní chemoterapie odkazuje na použití chemoterapie po chirurgickém zákroku ke zlepšení výsledků. Během operace jsou izolovány vzorky z mízních uzlin. Pokud tyto vzorky obsahují karcinom, pacient má stádium nemoci II nebo III. V této situaci může adjuvantní chemoterapie zvýšit šanci na přežití až o 15 %.[197][198] Standard practice is to offer platinum-based chemotherapy (including either cisplatin or carboplatin).[199]
Advujantní chemoterapie pro pacienty ve stádiu IB patří ke kontroversním praktikám, jelikož klinické zkoušky jasně nedemonstrovaly výhody přežití.[93][94] Zkoušky s předoperativní terapií (Neoadjuvantní chemoterapie) v odstranitelném nemalobuněčném karcinomu plic byly dosud neprůkazné.[95]
Radioterapie
Radioterapie je často prováděna společně s chemoterapií a může být použita v léčebném postupu u pacientů s nemalobuněčným karcinomem plic, kteří nejsou způsobilí pro operační zákrok. Tato forma vysoce intenzivní radioterapie se nazývá radikální radioterapie.[74] Zjemněním této techniky je hyperfrakční akcelerovaná radioterapie (CHART), u které jsou použity vysoké dávky radiace v krátké časové periodě.[134] U případů malobuněčného karcinomu, který je potencionálně léčitelný, je často doporučováno plicní ozařování společně s chemoterapií.[200] Postupy adjuvantní thoratické radioterapie následovanou chirurgickými zásahy u nemalobuněčného karcinomu plic nejsou ještě dobře propracovány a jsou kontroverzní. Pokud existují výhody, mohou být omezeny pouze na osoby, kde se tumor rozšířil na mediastanální lymfatické uzliny.[76][201]
U obou, jak nemalobuněčného tak malobuněčného karcinomu plic mohou být pro kontrolu příznaků použity menší dávky záření do hrudníku (paliativní radioterapie). Na rozdíl od jiných způsobů léčby, je možné poskytovat paliativní radioterapie bez potvrzení histologické diagnózy rakoviny plic.
Brachytherapy (lokalizovaná radioterapie) může být použita přímo uvnitř dýchacích cest, když karcinom zasáhne krátkou část průdušky.[202] Je použito tehdy, když neoperovaný karcinom plic blokuje horní cesty dýchací.[203]
Pacienti s omezeným stupněm karcinomu plic jsou obvykle vystaveni profilaktickému kraniálnímu ozáření (PCI). Toto je druh radioterapie mozku, použitého k omezení rizika metastáze.[204] V nedávné době se PCI ukázalo být výhodné u těch, kteří mají rozsáhlý malobuněčný karcinom plic. U pacientů, jejichž příznaky se zlepšily po projití chemoterapií, PCI během jednoho roku ukázal redukci kumulativního rizika mozkových metastází ze 40.4% na 14.6%.[205]
Současné zdokonalování v cílení a zobrazování vedlo k vývoji extrakraniálního stereotaktického zářiče pro léčbu raných stádií karcinomu plic. U této formy ozařovací terapie jsou použity velmi vysoké dávky záření, vysílané v krátkých časových sekvencích použitím stereotaktických cílených technik. Toto použití je převážně zaměřeno na pacienty, kteří nejsou vhodnými kandidáty pro chirurgickou operaci kvůli zdravotním komorbilitám.[206]
Intervenční radiologie
Radiofrekvenční ablace je v současnosti považována za hodnotnou techniku při léčbě karcinomu dýchacích cest. Je tvořena vložením malé tepelné sondy do nádoru k zabití nádorových buněk.[207]
Cílená léčba
V posledních letech bylo ke zlepšení léčby karcinomu plic vyvinuto množství molekulárních cílených terapií. Gefitinib (Iressa) je jednou z látek, které se zacílí na tyrosinkinázu, doménu receptoru pro epidermální růstový faktor (EGFR), vyjádřen v mnoha případech nemalobuněčným karcinomem plic. Ukazuje se, že přežití vzrůstá, i když ženy Asiatky, nekuřačky a osoby s bronchioloalveolárním karcinomem vykazují nejvyšší zlepšení u gefitinibu.[46][208] Erlotinib (Tarceva), další inhibitor tyrosinkináz, vykazoval ve studiích výrazný nárůst přežití pacientů s karcinomem plic[209] a v sooučasnosti má být schválen FDA, jako druhá linie při léčbě rozvinutého nemalobuněčného karcinomu plic. Podobně gefitinib, který zřejmě nejlépe funguje u žen, Asiatů, nekuřáků a pacientů s bronchioloalveolárním karcinomem.[208] Inhibitor angiogeneze bevacizumab, (v kombinaci s paxitaxelem a carboplatinem), zvyšuje přežití u pacientů s malobuněčným karcinomem plic.[210] Nicméně, tento nárůst má i rizika v podobě krvácení plic, zvláště u pacientů se spinocelulárním karcinomem.
Vývoj u cytostatických léků,[211] ve farmakokinetice[212] a cílené výrobě léků[213] je slibný. Velké množství cílených agentů je v počátečních fázích klinického výzkumu, jako je COX-2 inhibitor,[214] exisulind (promoter apoptózy),[215] inhibitory proteazomu,[216] bexaroten,[217] inhibitor receptoru epidermálního růstového faktoru (tzv. cetuximab),[218] a očkovací látky.[219] Budoucí místa výzkumu jsou inhibice ras proteinu, fosfoinositid-3-kinázy, histon deacetylázy a výměna tumory potlačujících genů.[220]
Prognózy
Prognostické faktory u nemalobuněčného karcinomu plic obsahují přítomnost nebo nepřítomnost příznaků, velikost tumoru, typ buňky (histologie), stupeň rozšíření (fáze) a metastáze do rozšířených lymfatických uzlin a invaze do cév. U pacientů s neoperovatelnou nemocí je nepříznivým dopadem osobní stav a ztráta váhy o více než 10%.[221] Prognostické faktory u nemalobuněčného karcinomu plic obsahují osobní stav, pohlaví, fáze nemoci a zahrnují centrální nervový systém nebo stav jater v době lékařské diagnózy.[222]
U nemalobuněčného karcinomu plic jsou prognózy obecně velice mizivé. Následuje kompletní chirurgické odstranění ve fázi nemoci IA, pětileté přežití je 67%. U fáze nemoci IB je přežití 57%.[223] Pětileté přežití u pacientů s fází IV nemoci NSCLC je okolo 1%.[2]
U malobuněčného karcinomu plic jsou prognózy na vyléčení také mizivé. Celková doba přežití na SCLC je okolo 5 %.[1] Pacienti s rozvinutým stádiem SCLC mají průměrně pětiletou šanci na přežití menší než 1 %. Středová doba přežití je u omezené fáze 20 měsíců, šance na pětileté přežití je 20 %.[2]
Na základě dat, poskytnutých National Cancer Institute je střední věk indikování karcinomu plic 70 let a střední věk úmrtí na karcinom plic je 71 let.[224]
Epidemiologie

Celosvětově je karcinom plic nejběžnější jak ve výskytu tak i v úmrtnosti (1.35 milionů nových případů ročně a 1.18 milionů úmrtí), se svým nejvyšším výskytem v Evropě a v Severní Americe.[225] Segment populace, ve kterém se nejčastěji vyskytne karcinom plic je u lidí nad čtyřicet let, kteří kouří. Karcinom plic je druhou nejčastější formou rakoviny ve většině západních zemí, která vede k úmrtí. V souvislosti s úmrtností u mužů, která začala za posledních dvacet let neustále klesat, ženská úmrtnost v poslední dekátě stále vzrůstala a v současnosti se stabilizuje.[226] Evoluce "Big Tobacco" hraje jasnou roli v kuřácké kultuře.[111] Od 70. let 20. století tabákové společnosti zaměřily své úsilí na propagaci cigaret mezi ženami a dívkami uvedením cigaret nazvaných jako "light" (lehké) a "s nízkým obsahem dehtu" [2]. Mezi celoživotními nekuřáky se muži dožívají vyššího věku-standartizovanou měrou úmrtí na karcinom plic než u žen.
Ne všechny případy karcinomu plic jsou kvůli kouření, avšak role pasivního kouření neustále narůstá a byla zjištěna jako rizikový faktor karcinomu plic – dochází k politickým zásahům vedoucím ke snížení nežádoucího vystavování nekuřáků tabákovému kouři od kuřáků. Emise z automobilů, továren a tepelných elektráren jsou také potencionálním rizikem.[145][147][227]
Východní Evropa má nejvyšší úmrtnost na karcinom plic u mužů, zatímco Severní Evropa a USA má nejvyšší úmrtnost na karcinom plic u žen. V rozvojových zemích není v současné době výskyt rakoviny plic moc běžný.[228] Se zvýšeným kouřením v rozvojových zemích lze očekávat výskyt v následujících letech, zejména pak v Číně[229] a v Indii.[230]
Výskyt karcinomu plic (podle zemí) inverzně koreluje se slunečním zářením a vystavením UVB zářením. Jedním z možných vysvětlení jsou preventivní účinky vitamínu D (který je vytvářen v kůži po vystavení se slunečnímu záření).[231]
Od 50. let začal narůstat výskyt adenokarcinomu přibližně stejně jako další typy karcinomu plic.[232] To je částečně kvůli zavedení cigaretového filtru. Použití cigaretového filtru odstraňuje větší části tabákového dýmu a tím omezuje jejich ukládání v horních cestách dýchacích. Když bude kuřák inhalovat hlouběji, aby dosáhl stejné dávky nikotinu, zvyšuje se usazování částic ve spodních cestách dýchacích a vzniká tím vyšší riziko nárůstu adenokarcinomu.[118] Výskyt adenokarcinomu plic se v USA od roku 1999 stále snižuje. Příčinou menšího výskytu může být současné snižování průmyslového znečištění.[232]
Historie
Před nástupem kouření cigaret nebyl karcinom plic známý; do roku 1761 nebyl dokonce identifikován ani jako vzácná choroba.[233] Různé aspekty onemocnění karcinomem plic byly popsány teprve v roce 1810.[234] Zhoubné plicní tumory tvořily pouze 1% všech karcinomů nalezených během pitev v roce 1878, avšak do roku 1900 vzrostly až na 10–15%.[122] V roce 1912 bylo na celém světě v lékařské literatuře nalezeno pouze 374 případů,[235] avšak přehled pitev ukazuje, že výskyt karcinomu plic narostl z 0.3% v roce 1852 na 5.66% v roce 1952.[124] Roku 1929 nalezl německý lékař Fritz Lickint spojení mezi kouřením a karcinomem plic,[122] což vedlo k agresivní protikuřácké kampani.[125] British Doctors Study, vydaný roku 1950, byl prvním přesným epidemiologickým důkazem spojení mezi karcinomem plic a kouřením.[126] Důsledkem bylo v roce 1964 doporučení Surgeon General of the United States kuřákům, aby přestali kouřit.[236]
Spojení karcinomu plic s radonovým plynem bylo poprvé zjištěno v Krušných Horách blízko Schneebergu v Sasku. Stříbro bylo těženo od roku 1470 a tyto doly jsou současně bohaté na uran s doprovodným radiem a radonovým plynem. U horníků se vyvinulo neúměrné množství případů plicních chorob, roku 1870 se již mohlo patrně jednat o karcinom plic. Přibližně 75% bývalých horníků na karcinom plic zemřelo.[237] Navzdory tomuto zjištění důlní těžba pokračovala až do roku 1950, kvůli potřebám SSSR po uranu.[128]
První úspěšná pneumonektomie (chirurgické odstranění plíce) karcinomu plic byla provedena roku 1933.[238] Mírnější forma radioterapie je používána od 40. let 20 století.[132] Radikální radioterapie, poprvé použita v 50. letech, byla pokusem použít vyšších dávek radiace u pacientů s relativně raným stadiem karcinomu plic, ale také u těch, kteří by jinak museli podstoupit radikální chirurgickou operaci.[239] Hyperfrakční akcelerovaná terapie (CHART) byla v roce 1997 uvedena jako vylepšení před konvenční radikální radioterapií.[134]
U malobuněčného karcinomu plic byla v 60. letech neúspěšně prováděna chirurgická resekce[240] a radikální radioterapie.[241] Až v 70. letech byly vyvinuty úspěšné metody chemoterapie.[242]
Odkazy
![]() Obrázky, zvuky či videa k tématu rakovina plic na Wikimedia Commons
Obrázky, zvuky či videa k tématu rakovina plic na Wikimedia Commons
- Lokální šablona odkazuje na jinou kategorii Commons než přiřazená položka Wikidat:
- Lokální odkaz: Lung cancers
- Wikidata: Cancers of bronchus and lung
- Lokální šablona odkazuje na jinou kategorii Commons než přiřazená položka Wikidat:
Reference
V tomto článku byl použit překlad textu z článku Lung cancer na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa HORN, L, Pao W, Johnson DH. Harrison's Principles of Internal Medicine. 18th. vyd. [s.l.]: McGraw-Hill, 2012. ISBN 0-07-174889-X. Kapitola Chapter 89. Chybná citace: Neplatná značka
<ref>; název „Harrison“ použit vícekrát s různým obsahem - ↑ a b c d e f g h Lung Carcinoma: Tumors of the Lungs [online]. Merck Manual Professional Edition, Online edition [cit. 2007-08-15]. Dostupné online. Chybná citace: Neplatná značka
<ref>; název „Merck“ použit vícekrát s různým obsahem - ↑ a b c THUN, MJ, Hannan LM, Adams-Campbell LL et al. Lung cancer occurrence in never-smokers: an analysis of 13 cohorts and 22 cancer registry studies. PLoS Medicine. 2008, s. e185. DOI 10.1371/journal.pmed.0050185. PMID 18788891. Chybná citace: Neplatná značka
<ref>; název „Thun“ použit vícekrát s různým obsahem - ↑ a b c d e f g h Alberg AJ, Samet JM. Murray & Nadel's Textbook of Respiratory Medicine. 5th. vyd. [s.l.]: Saunders Elsevier, 2010. ISBN 978-1-4160-4710-0. Kapitola Chapter 46.
- ↑ a b c d e O'REILLY, KM, Mclaughlin AM, Beckett WS, Sime PJ. Asbestos-related lung disease. American Family Physician. 2007, s. 683–688. Dostupné online. PMID 17375514. Chybná citace: Neplatná značka
<ref>; název „O'Reilly“ použit vícekrát s různým obsahem - ↑ a b Carmona, RH. The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General [online]. U.S. Department of Health and Human Services, 2006-06-27. Dostupné online.
- ↑ a b Tobacco Smoke and Involuntary Smoking. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. WHO International Agency for Research on Cancer, 2002. Dostupné online.
- ↑ a b c d e f g h i j k LU, C, Onn A, Vaporciyan AA et al. Holland-Frei Cancer Medicine. 8th. vyd. [s.l.]: People's Medical Publishing House, 2010. ISBN 9781607950141. Kapitola 78: Cancer of the Lung.
- ↑ CHAPMAN, S, Robinson G, Stradling J, West S. Oxford Handbook of Respiratory Medicine. 2nd. vyd. [s.l.]: Oxford University Press, 2009. ISBN 9-780199-545162. Kapitola Chapter 31.
- ↑ a b c d e f g h i COLLINS, LG, Haines C, Perkel R, Enck RE. Lung cancer: diagnosis and management. American Family Physician. American Academy of Family Physicians, 2007, s. 56–63. Dostupné online. PMID 17225705. Chybná citace: Neplatná značka
<ref>; název „Collins“ použit vícekrát s různým obsahem - ↑ a b FERLAY, J, Shin HR, Bray F et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. International Journal of Cancer. December 2010, s. 2893–2917. Dostupné online. DOI 10.1002/ijc.25516. PMID 21351269.
- ↑ a b c HONNORAT, J, Antoine JC. Paraneoplastic neurological syndromes. Orphanet Journal of Rare Diseases. BioMed Central, 2007, s. 22. Dostupné online. DOI 10.1186/1750-1172-2-22. PMID 17480225. Chybná citace: Neplatná značka
<ref>; název „Honnorat“ použit vícekrát s různým obsahem - ↑ a b c Greene, Frederick L. AJCC cancer staging manual. Berlin: Springer-Verlag, 2002. ISBN 0-387-95271-3. Chybná citace: Neplatná značka
<ref>; název „ajcc“ použit vícekrát s různým obsahem - ↑ BROWN, KM, Keats JJ, Sekulic A et al. Holland-Frei Cancer Medicine. 8th. vyd. [s.l.]: People's Medical Publishing House USA, 2010. ISBN 978-1607950141. Kapitola 8.
- ↑ a b BIESALSKI, HK, Bueno de Mesquita B, Chesson A et al. European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel. CA Cancer J Clin. Smoking is the major risk factor, accounting for about 90% of lung cancer incidence.: 1998, s. 167–176; discussion 164–166. Dostupné online. DOI 10.3322/canjclin.48.3.167. PMID 9594919.
- ↑ a b c HECHT, S. Tobacco carcinogens, their biomarkers and tobacco-induced cancer. Nature Reviews. Cancer. Nature Publishing Group, 2003, s. 733–744. Dostupné online. DOI 10.1038/nrc1190. PMID 14570033. Chybná citace: Neplatná značka
<ref>; název „Hecht“ použit vícekrát s různým obsahem - ↑ a b SOPORI, M. Effects of cigarette smoke on the immune system. Nature Reviews. Immunology. 2002, s. 372–7. DOI 10.1038/nri803. PMID 12033743.
- ↑ a b c PETO, R, Lopez AD, Boreham J et al. Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics. [s.l.]: Oxford University Press, 2006. Dostupné online. ISBN 0-19-262535-7. Chybná citace: Neplatná značka
<ref>; název „Peto“ použit vícekrát s různým obsahem - ↑ CALIFORNIA ENVIRONMENTAL PROTECTION AGENCY. Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency. Tobacco Control. 1997, s. 346–353. Dostupné online. DOI 10.1136/tc.6.4.346. PMID 9583639.
* Centers for Disease Control and Prevention (CDC). State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000. Morbidity and Mortality Weekly Report. Atlanta, Georgia: CDC, 2001, s. 1101–1106. Dostupné online. PMID 11794619. - ↑ a b c d ALBERG, AJ, Samet JM. Epidemiology of lung cancer. Chest. American College of Chest Physicians, 2007, s. 29S–55S. Dostupné online. DOI 10.1378/chest.07-1347. PMID 17873159.
- ↑ JAAKKOLA, MS, Jaakkola JJ. Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention. European Respiratory Journal. 2006, s. 397–408. Dostupné online. DOI 10.1183/09031936.06.00001306. PMID 16880370.
- ↑ PARKIN, DM. Tobacco—attributable cancer burden in the UK in 2010. British Journal of Cancer. 2011, s. S6–S13. Dostupné online. DOI 10.1038/bjc.2011.475. PMID 22158323.
- ↑ a b c National Health and Medical Research Council. The health effects and regulation of passive smoking. www.obpr.gov.au. Australian Government Publishing Service, April 1994. Dostupné v archivu pořízeném z originálu dne September 29, 2007. Chybná citace: Neplatná značka
<ref>; název „NHMRC“ použit vícekrát s různým obsahem - ↑ a b TAYLOR, R, Najafi F, Dobson A. Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent. International Journal of Epidemiology. 2007, s. 1048–1059. Dostupné online. DOI 10.1093/ije/dym158. PMID 17690135.
- ↑ Frequently asked questions about second hand smoke [online]. [cit. 2012-07-25]. Dostupné online.
- ↑ a b c SCHICK, S, Glantz S. Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke. Tobacco Control. 2005, s. 396–404. DOI 10.1136/tc.2005.011288. PMID 16319363. Chybná citace: Neplatná značka
<ref>; název „Schick“ použit vícekrát s různým obsahem - ↑ Schmid K, Kuwert T, Drexler H. Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine. Dtsch Arztebl Int. 2010, s. 181–6. DOI 10.3238/arztebl.2010.0181. PMID 20386676.
- ↑ a b c EPA. Radiation information: radon [online]. EPA, 2006 [cit. 2007-08-11]. Dostupné online. Chybná citace: Neplatná značka
<ref>; název „EPA radon“ použit vícekrát s různým obsahem - ↑ DAVIES, RJO, Lee YCG. Oxford Textbook Medicine. 5th. vyd. [s.l.]: OUP Oxford, 2010. ISBN 978-0199204854. Kapitola 18.19.3.
- ↑ CHEN, H, Goldberg MS, Villeneuve PJ. A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases. Reviews on Environmental Health. 2008, s. 243–297. PMID 19235364.
- ↑ CLAPP, RW, Jacobs MM, Loechler EL. Environmental and Occupational Causes of Cancer New Evidence, 2005–2007. Reviews on Environmental Health. 2008, s. 1–37. Dostupné online. PMID 18557596.
- ↑ a b LIM, WY, Seow, A. Biomass fuels and lung cancer.. Respirology (Carlton, Vic.). 2012 Jan, s. 20-31. PMID 22008241.
- ↑ a b SOOD, A. Indoor fuel exposure and the lung in both developing and developed countries: an update.. Clinics in chest medicine. 2012 Dec, s. 649-65. PMID 23153607.
- ↑ DUDLEY, Joel. Exploring Personal Genomics. [s.l.]: Oxford University Press, 2013. Dostupné online. ISBN 9780199644483. S. 25.
- ↑ Kern JA, McLennan G. Fishman's Pulmonary Diseases and Disorders. 4th. vyd. [s.l.]: McGraw-Hill, 2008. ISBN 0-07-145739-9. S. 1802.
- ↑ COGLIANO, VJ, Baan, R; Straif, K; Grosse, Y; Lauby-Secretan, B; El Ghissassi, F; Bouvard, V; Benbrahim-Tallaa, L; Guha, N; Freeman, C; Galichet, L; Wild, CP. Preventable exposures associated with human cancers.. Journal of the National Cancer Institute. 2011 Dec 21, s. 1827-39. Dostupné online. PMID 22158127.
- ↑ a b c FONG, KM, Sekido Y, Gazdar AF, Minna JD. Lung cancer • 9: Molecular biology of lung cancer: clinical implications. Thorax. BMJ Publishing Group Ltd., 2003, s. 892–900. DOI 10.1136/thorax.58.10.892. PMID 14514947. Chybná citace: Neplatná značka
<ref>; název „Fong“ použit vícekrát s různým obsahem - ↑ a b c SALGIA, R, Skarin AT. Molecular abnormalities in lung cancer. Journal of Clinical Oncology. 1998, s. 1207–1217. PMID 9508209. Chybná citace: Neplatná značka
<ref>; název „Salgia“ použit vícekrát s různým obsahem - ↑ a b c d e f g h i HERBST, RS, Heymach JV, Lippman SM. Lung cancer. New England Journal of Medicine. 2008, s. 1367–1380. Dostupné online. DOI 10.1056/NEJMra0802714. PMID 18815398. Chybná citace: Neplatná značka
<ref>; název „NEJM-molecular“ použit vícekrát s různým obsahem - ↑ a b c AVIEL-RONEN, S, Blackhall FH, Shepherd FA, Tsao MS. K-ras mutations in non-small-cell lung carcinoma: a review. Clinical Lung Cancer. Cancer Information Group, 2006, s. 30–38. DOI 10.3816/CLC.2006.n.030. PMID 16870043. Chybná citace: Neplatná značka
<ref>; název „Aviel-Ronen“ použit vícekrát s různým obsahem - ↑ a b c DEVEREUX, TR, Taylor JA, Barrett JC. Molecular mechanisms of lung cancer. Interaction of environmental and genetic factors. Chest. American College of Chest Physicians, 1996, s. 14S–19S. DOI 10.1378/chest.109.3_Supplement.14S. PMID 8598134. Chybná citace: Neplatná značka
<ref>; název „Devereux“ použit vícekrát s různým obsahem - ↑ MILLER, WT. Fishman's Pulmonary Diseases and Disorders. 4th. vyd. [s.l.]: McGraw-Hill, 2008. ISBN 0-07-145739-9. S. 486.
- ↑ KAISER, LR. Fishman's Pulmonary Diseases and Disorders. 4th. vyd. [s.l.]: McGraw-Hill, 2008. ISBN 0-07-145739-9. S. 1815–1816.
- ↑ a b MAITRA, A, Kumar V. Robbins Basic Pathology. 8th. vyd. [s.l.]: Saunders Elsevier, 2007. ISBN 978-1-4160-2973-1. S. 528–529.
- ↑ a b SUBRAMANIAN, J, Govindan R. Lung cancer in never smokers: a review. Journal of Clinical Oncology. American Society of Clinical Oncology, 2007, s. 561–570. DOI 10.1200/JCO.2006.06.8015. PMID 17290066. Chybná citace: Neplatná značka
<ref>; název „Subramanian“ použit vícekrát s různým obsahem - ↑ a b c d RAZ, DJ, He B, Rosell R, Jablons DM. Bronchioloalveolar carcinoma: a review. Clinical Lung Cancer. 2006, s. 313–322. DOI 10.3816/CLC.2006.n.012. PMID 16640802. Chybná citace: Neplatná značka
<ref>; název „Raz“ použit vícekrát s různým obsahem - ↑ a b c ROSTI, G, Bevilacqua G, Bidoli P et al. Small cell lung cancer. Annals of Oncology. 2006, s. 5–10. Dostupné online. DOI 10.1093/annonc/mdj910. PMID 16608983. Chybná citace: Neplatná značka
<ref>; název „Rosti“ použit vícekrát s různým obsahem - ↑ a b c SEO, JB, Im JG, Goo JM et al. Atypical pulmonary metastases: spectrum of radiologic findings. Radiographics. 1 March 2001, s. 403–417. Dostupné online. PMID 11259704. Chybná citace: Neplatná značka
<ref>; název „Seo“ použit vícekrát s různým obsahem - ↑ Tan D, Zander DS. Immunohistochemistry for Assessment of Pulmonary and Pleural Neoplasms: A Review and Update. Int J Clin Exp Pathol. 2008, s. 19–31. PMID 18784820.
- ↑ a b c RAMI-PORTA, R, Crowley JJ, Goldstraw P. The revised TNM staging system for lung cancer. Annals of Thoracic and Cardiovascular Surgery. 2009, s. 4–9. Dostupné online. PMID 19262443.
- ↑ GOODMAN, GE. Lung cancer. 1: prevention of lung cancer. Thorax. 2002, s. 994–999. Dostupné online. PMID 12403886.
- ↑ MCNABOLA, A, Gill LW. The control of environmental tobacco smoke: a policy review. International Journal of Environmental Research and Public Health. 2009, s. 741–758. DOI 10.3390/ijerph6020741. PMID 19440413.
- ↑ a b c PANDEY, G. Bhutan's smokers face public ban. news.bbc.co.uk. BBC, 2005. Dostupné online [cit. 2007-09-07]. Chybná citace: Neplatná značka
<ref>; název „Bhutan“ použit vícekrát s různým obsahem - ↑ PANDEY, G. Indian ban on smoking in public. news.bbc.co.uk. BBC, 2 October 2008. Dostupné online [cit. 2012-04-25].
- ↑ United Nations News service: UN health agency calls for total ban on tobacco advertising to protect young, tisková zpráva, [cit. {{{accessdate}}}], Dostupné on-line.
- ↑ a b c FABRICIUS, P, Lange P. Diet and lung cancer. Monaldi Archives for Chest Disease. 2003, s. 207–211. PMID 15065316.
- ↑ FRITZ, H, Kennedy D, Fergusson D et al. Vitamin A and Retinoid Derivatives for Lung Cancer: A Systematic Review and Meta Analysis. PLoS ONE. 2011, s. e21107. DOI 10.1371/journal.pone.0021107. PMID 21738614.
- ↑ HERR, C, Greulich T, Koczulla RA et al. The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer. Respiratory Research. 2011, s. 31. DOI 10.1186/1465-9921-12-31. PMID 21418564.
- ↑ a b KEY, TJ. Fruit and vegetables and cancer risk. British Journal of Cancer. 2011, s. 6–11. DOI 10.1038/sj.bjc.6606032. PMID 21119663.
- ↑ MANSER, RL, Irving LB, Stone C et al. Screening for lung cancer. Cochrane Database of Systematic Reviews. 2004, s. CD001991. Dostupné online. DOI 10.1002/14651858.CD001991.pub2. PMID 14973979.
- ↑ JAKLITSCH, MT, Jacobson FL, Austin JH et al. The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups. Journal of Thoracic and Cardiovascular Surgery. 2012, s. 33–38. DOI 10.1016/j.jtcvs.2012.05.060. PMID 22710039.
- ↑ BACH, PB, Mirkin JN, Oliver TK et al. Benefits and harms of CT screening for lung cancer: a systematic review. JAMA: the Journal of the American Medical Association. 2012, s. 2418–2429. DOI 10.1001/jama.2012.5521. PMID 22610500.
- ↑ BOISELLE, PM. Computed tomography screening for lung cancer.. JAMA : the journal of the American Medical Association. 2013 Mar 20, s. 1163-70. PMID 23512063.
- ↑ Bach PB, Mirkin JN, Oliver TK, et al.. Benefits and harms of CT screening for lung cancer: a systematic review. JAMA. 2012, s. 2418–29. DOI 10.1001/jama.2012.5521. PMID 22610500.
- ↑ ABERLE, DR, Abtin, F; Brown, K. Computed tomography screening for lung cancer: has it finally arrived? Implications of the national lung screening trial.. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2013 Mar 10, s. 1002-8. PMID 23401434.
- ↑ FERRELL, B, Koczywas M, Grannis F, Harrington A. Palliative care in lung cancer. Surgical Clinics of North America. 2011, s. 403–417. DOI 10.1016/j.suc.2010.12.003. PMID 21419260.
- ↑ Kaiser LR. Fishman's Pulmonary Diseases and Disorders. 4th. vyd. [s.l.]: McGraw-Hill, 2008. ISBN 0-07-145739-9. S. 1853–1854.
- ↑ a b Kaiser LR. Fishman's Pulmonary Diseases and Disorders. 4th. vyd. [s.l.]: McGraw-Hill, 2008. ISBN 0-07-145739-9. S. 1855–1856.
- ↑ ODELL, DD, Kent MS, Fernando HC. Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer. Seminars in Thoracic and Cardiovascular Surgery. 2010, s. 32–37. DOI 10.1053/j.semtcvs.2010.04.003. PMID 20813314.
- ↑ ALAM, N, Flores RM. Video-assisted thoracic surgery (VATS) lobectomy: the evidence base. Journal of the Society of Laparoendoscopic Surgeons. 2007, s. 368–374. PMID 17931521.
- ↑ RUETH, NM, Andrade RS. Is VATS lobectomy better: perioperatively, biologically and oncologically?. Annals of Thoracic Surgery. 2010, s. S2107–S2111. DOI 10.1016/j.athoracsur.2010.03.020. PMID 20493991.
- ↑ Simon GR, Turrisi A. Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest. 2007, s. 324S–339S. Dostupné online. DOI 10.1378/chest.07-1385. PMID 17873178.
- ↑ GOLDSTEIN, SD, Yang SC. Role of surgery in small cell lung cancer. Surgical Oncology Clinics of North America. 2011, s. 769–777. DOI 10.1016/j.soc.2011.08.001. PMID 21986271.
- ↑ a b c ARRIAGADA, R, Goldstraw P, Le Chevalier T. Oxford Textbook of Oncology. 2nd. vyd. [s.l.]: Oxford University Press, 2002. ISBN 0-19-262926-3. S. 2094. Chybná citace: Neplatná značka
<ref>; název „OTO“ použit vícekrát s různým obsahem - ↑ HATTON, MQ, Martin JE. Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer: a review and consideration of future directions. Clinical Oncology (Royal College of Radiologists). 2010, s. 356–364. DOI 10.1016/j.clon.2010.03.010. PMID 20399629.
- ↑ a b c PORT Meta-analysis Trialists Group. Postoperative radiotherapy for non-small cell lung cancer. Redakce Rydzewska Larysa. Cochrane Database of Systematic Reviews. 2005, s. CD002142. Dostupné online. DOI 10.1002/14651858.CD002142.pub2. PMID 15846628. Chybná citace: Neplatná značka
<ref>; název „PORT Meta-analysis Trialists Group“ použit vícekrát s různým obsahem - ↑ LE PÉCHOUX, C. Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data. Oncologist. 2011, s. 672–681. DOI 10.1634/theoncologist.2010-0150. PMID 21378080.
- ↑ CARDONA, AF, Reveiz L, Ospina EG et al. Palliative endobronchial brachytherapy for non-small cell lung cancer. Cochrane Database of Systematic Reviews. 2008, s. CD004284. DOI 10.1002/14651858.CD004284.pub2. PMID 18425900.
- ↑ IKUSHIMA, H. Radiation therapy: state of the art and the future. Journal of Medical Investigation. 2010, s. 1–11. Dostupné online. PMID 20299738.
- ↑ PAUMIER, A, Cuenca X, Le Péchoux C. Prophylactic cranial irradiation in lung cancer. Cancer Treatment Reviews. 2011, s. 261–265. DOI 10.1016/j.ctrv.2010.08.009. PMID 20934256.
- ↑ GIRARD, N, Mornex F. Stereotactic radiotherapy for non-small cell lung cancer: From concept to clinical reality. 2011 update. Cancer Radiothérapie. 2011, s. 522–526. DOI 10.1016/j.canrad.2011.07.241. PMID 21889901.
- ↑ FAIRCHILD, A, Harris K, Barnes E et al. Palliative thoracic radiotherapy for lung cancer: a systematic review. Journal of Clinical Oncology. 2008, s. 4001–4011. Dostupné online. DOI 10.1200/JCO.2007.15.3312. PMID 18711191.
- ↑ Hann CL, Rudin CM. Management of small-cell lung cancer: incremental changes but hope for the future. Oncology (Williston Park). 2008-11-30, s. 1486–92. PMID 19133604.
- ↑ a b c MURRAY, N, Turrisi AT. A review of first-line treatment for small-cell lung cancer. Journal of Thoracic Oncology. 2006, s. 270–278. PMID 17409868. Chybná citace: Neplatná značka
<ref>; název „Murray“ použit vícekrát s různým obsahem - ↑ a b c AZIM, HA, Ganti AK. Treatment options for relapsed small-cell lung cancer. Anticancer drugs. 2007, s. 255–261. DOI 10.1097/CAD.0b013e328011a547. PMID 17264756. Chybná citace: Neplatná značka
<ref>; název „Azim“ použit vícekrát s různým obsahem - ↑ a b c MACCALLUM, C, Gillenwater HH. Second-line treatment of small-cell lung cancer. Current Oncology Reports. 2006, s. 258–264. DOI 10.1007/s11912-006-0030-8. PMID 17254525. Chybná citace: Neplatná značka
<ref>; název „MacCallum“ použit vícekrát s různým obsahem - ↑ a b NSCLC Meta-Analyses Collaborative Group. Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials. J. Clin. Oncol.. 2008, s. 4617–25. DOI 10.1200/JCO.2008.17.7162. PMID 18678835.
- ↑ Mehra R, Treat J. Fishman's Pulmonary Diseases and Disorders. 4th. vyd. [s.l.]: McGraw-Hill, 2008. ISBN 0-07-145739-9. S. 1876.
- ↑ a b c d CLEGG, A, Scott DA, Hewitson P et al. Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review. Thorax. BMJ Publishing Group, 2002, s. 20–28. DOI 10.1136/thorax.57.1.20. PMID 11809985. Chybná citace: Neplatná značka
<ref>; název „Clegg“ použit vícekrát s různým obsahem - ↑ Fuld AD, Dragnev KH, Rigas JR. Pemetrexed in advanced non-small-cell lung cancer. Expert Opin Pharmacother. 2010, s. 1387–402. DOI 10.1517/14656566.2010.482560. PMID 20446853.
- ↑ CARBONE, DP, Felip E. Adjuvant therapy in non-small cell lung cancer: future treatment prospects and paradigms. Clinical Lung Cancer. 2011, s. 261–271. DOI 10.1016/j.cllc.2011.06.002. PMID 21831720.
- ↑ a b LE CHEVALIER, T. Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going?. Annals of Oncology. 2010, s. vii196–198. Dostupné online. DOI 10.1093/annonc/mdq376. PMID 20943614.
- ↑ a b c HORN, L, Sandler AB, Putnam JB Jr, Johnson DH. The rationale for adjuvant chemotherapy in stage I non-small cell lung cancer. Journal of Thoracic Oncology. 2007, s. 377–383. DOI 10.1097/01.JTO.0000268669.64625.bb. PMID 17473651. Chybná citace: Neplatná značka
<ref>; název „Horn“ použit vícekrát s různým obsahem - ↑ a b c WAKELEE, HA, Schiller JH, Gandara DR. Current status of adjuvant chemotherapy for stage IB non-small-cell lung cancer: implications for the New Intergroup Trial. Clinical Lung Cancer. Cancer Information Group, 2006, s. 18–21. DOI 10.3816/CLC.2006.n.028. PMID 16870041. Chybná citace: Neplatná značka
<ref>; název „Wakelee“ použit vícekrát s různým obsahem - ↑ a b c BMJ. Clinical evidence concise : the international resource of the best available evidence for effective health care.. London: BMJ Publishing Group, 2005. ISBN 1-905545-00-2. S. 486–488. Chybná citace: Neplatná značka
<ref>; název „Clinical evidence“ použit vícekrát s různým obsahem - ↑ Kelley AS, Meier DE. Palliative care—a shifting paradigm. New England Journal of Medicine. 2010, s. 781–2. DOI 10.1056/NEJMe1004139. PMID 20818881.
- ↑ a b Prince-Paul M. When hospice is the best option: an opportunity to redefine goals. Oncology (Williston Park, N.Y.). 2009, s. 13–7. PMID 19856592.
- ↑ Souquet PJ, Chauvin F, Boissel JP, Bernard JP. Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer. Lung Cancer. 1995, s. S147–54. DOI 10.1016/0169-5002(95)00430-9. PMID 7551923.
- ↑ Sörenson S, Glimelius B, Nygren P. A systematic overview of chemotherapy effects in non-small cell lung cancer. Acta Oncol. 2001, s. 327–39. PMID 11441939.
- ↑ Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N. A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer. Health Technol Assess. 2001, s. 1–195. PMID 12065068.
- ↑ Šablona:Cite Cochrane
- ↑ Non-Small Cell Lung Cancer Treatment [online]. National Cancer Institute [cit. 2008-11-22]. Dostupné online.
- ↑ a b Small Cell Lung Cancer Treatment [online]. National Cancer Institute, 2012 [cit. 2012-05-16]. Dostupné online.
- ↑ SPIRO, SG. Oxford Textbook Medicine. 5th. vyd. [s.l.]: OUP Oxford, 2010. ISBN 978-0199204854. Kapitola 18.19.1.
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Diagnosis 2002-2003
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Death 2002-2006
- ↑ SLATORE, CG, Au DH, Gould MK. An official American Thoracic Society systematic review: insurance status and disparities in lung cancer practices and outcomes. American Journal of Respiratory and Critical Care Medicine. November 2010, s. 1195–1205. Dostupné online. DOI 10.1164/rccm.2009-038ST. PMID 21041563.
- ↑ a b WHO Disease and injury country estimates [online]. 2009 [cit. 2009-11-11]. Dostupné online.
- ↑ a b Jemal A, Tiwari RC, Murray T, et al.. Cancer statistics, 2004. CA: a Cancer Journal for Clinicians. 2004, s. 8–29. DOI 10.3322/canjclin.54.1.8. PMID 14974761.
- ↑ PROCTOR, RN. The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll. Tobacco Control. 2012, s. 87–91. DOI 10.1136/tobaccocontrol-2011-050338. PMID 22345227.
- ↑ a b c LUM, KL, Polansky JR, Jackler RK, Glantz SA. Signed, sealed and delivered: "big tobacco" in Hollywood, 1927–1951. Tobacco Control. 2008, s. 313–323. Dostupné online. DOI 10.1136/tc.2008.025445. PMID 18818225. Chybná citace: Neplatná značka
<ref>; název „Lum“ použit vícekrát s různým obsahem - ↑ LOVATO, C, Watts A, Stead LF. Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours. Cochrane Database of Systematic Reviews. October 2011, s. CD003439. DOI 10.1002/14651858.CD003439.pub2. PMID 21975739.
- ↑ KEMP, FB. Smoke free policies in Europe. An overview. Pneumologia. 2009, s. 155–158. PMID 19817310.
- ↑ National Cancer Institute; SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. 2010[1]
- ↑ a b Gender in lung cancer and smoking research [online]. World Health Organization, 2004 [cit. 2007-05-26]. Dostupné online.
- ↑ ZHANG, J, Ou JX, Bai CX. Tobacco smoking in China: prevalence, disease burden, challenges and future strategies. Respirology. November 2011, s. 1165–1172. DOI 10.1111/j.1440-1843.2011.02062.x. PMID 21910781.
- ↑ a b BEHERA, D, Balamugesh T. Lung cancer in India. Indian Journal of Chest Diseases and Allied Sciences. 2004, s. 269–281. Dostupné online. PMID 15515828.
- ↑ a b c CHARLOUX, A, Quoix E, Wolkove N et al. The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma. International Journal of Epidemiology. 1997, s. 14–23. Dostupné online. DOI 10.1093/ije/26.1.14. PMID 9126499. Chybná citace: Neplatná značka
<ref>; název „Charloux“ použit vícekrát s různým obsahem - ↑ KADARA, H, Kabbout M, Wistuba II. Pulmonary adenocarcinoma: a renewed entity in 2011. Respirology. 2012, s. 50–65. DOI 10.1111/j.1440-1843.2011.02095.x. PMID 22040022.
- ↑ a b MORGAGNI, Giovanni Battista. De sedibus et causis morborum per anatomen indagatis. [s.l.]: [s.n.], 1761.
- ↑ a b BAYLE, Gaspard-Laurent. Recherches sur la phthisie pulmonaire. Paris: [s.n.], 1810. (French)
- ↑ a b c d e WITSCHI, H. A short history of lung cancer. Toxicological Sciences. 2001, s. 4–6. Dostupné online. DOI 10.1093/toxsci/64.1.4. PMID 11606795. Chybná citace: Neplatná značka
<ref>; název „Witschi“ použit vícekrát s různým obsahem - ↑ a b Adler, I. Primary Malignant Growths of the Lungs and Bronchi. New York: Longmans, Green, and Company, 1912. OCLC 14783544, cited in Spiro SG, Silvestri GA. One hundred years of lung cancer. American Journal of Respiratory and Critical Care Medicine. 2005, s. 523–529. DOI 10.1164/rccm.200504-531OE. PMID 15961694.
- ↑ a b c GRANNIS, FW. History of cigarette smoking and lung cancer [online]. smokinglungs.com [cit. 2007-08-06]. Dostupné v archivu pořízeném z originálu dne July 18, 2007. Chybná citace: Neplatná značka
<ref>; název „Grannis“ použit vícekrát s různým obsahem - ↑ a b c PROCTOR, R. The Nazi War on Cancer. [s.l.]: Princeton University Press, 2000. ISBN 0-691-00196-0. S. 173–246. Chybná citace: Neplatná značka
<ref>; název „Proctor“ použit vícekrát s různým obsahem - ↑ a b c DOLL, R, Hill AB. Lung Cancer and Other Causes of Death in Relation to Smoking. British Medical Journal. 1956, s. 1071–1081. DOI 10.1136/bmj.2.5001.1071. PMID 13364389. Chybná citace: Neplatná značka
<ref>; název „Doll“ použit vícekrát s různým obsahem - ↑ a b US Department of Health Education and Welfare. Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service [online]. Washington, DC: US Government Printing Office, 1964. Dostupné online.
- ↑ a b c d GREAVES, M. Cancer: the Evolutionary Legacy. [s.l.]: Oxford University Press, 2000. ISBN 0-19-262835-6. S. 196–197. Chybná citace: Neplatná značka
<ref>; název „Greaves“ použit vícekrát s různým obsahem - ↑ GREENBERG, M, Selikoff IJ. Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879. Annals of Occupational Hygiene. 1993, s. 5–14. PMID 8460878.
- ↑ SAMET, JM. Radiation and cancer risk: a continuing challenge for epidemiologists. Environmental Health. 2011, s. S4. DOI 10.1186/1476-069X-10-S1-S4. PMID 21489214.
- ↑ a b HORN, L, Johnson DH. Evarts A. Graham and the first pneumonectomy for lung cancer. Journal of Clinical Oncology. 2008, s. 3268–3275. Dostupné online. DOI 10.1200/JCO.2008.16.8260. PMID 18591561.
- ↑ a b c EDWARDS, AT. Carcinoma of the Bronchus. Thorax. 1946, s. 1–25. DOI 10.1136/thx.1.1.1. PMID 20986395. Chybná citace: Neplatná značka
<ref>; název „Edwards“ použit vícekrát s různým obsahem - ↑ a b KABELA, M. Erfahrungen mit der radikalen Röntgenbestrahlung des Bronchienkrebses. Ceskoslovenská Onkológia. 1956, s. 109–115. PMID 13383622. (German)
- ↑ a b c d SAUNDERS, M, Dische S, Barrett A et al. Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial. Lancet. Elsevier, 1997, s. 161–165. DOI 10.1016/S0140-6736(97)06305-8. PMID 9250182. Chybná citace: Neplatná značka
<ref>; název „Saunders“ použit vícekrát s různým obsahem - ↑ a b LENNOX, SC, Flavell G, Pollock DJ et al. Results of resection for oat-cell carcinoma of the lung. Lancet. Elsevier, 1968, s. 925–927. DOI 10.1016/S0140-6736(68)91163-X. PMID 4176258.
- ↑ a b MILLER, AB, Fox W, Tall R. Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus. Lancet. Elsevier, 1969, s. 501–505. DOI 10.1016/S0140-6736(69)90212-8. PMID 4184834.
- ↑ a b COHEN, M, Creaven PJ, Fossieck BE Jr et al. Intensive chemotherapy of small cell bronchogenic carcinoma. Cancer Treatment Reports. 1977, s. 349–354. PMID 194691.
- ↑ WHO. Cancer [online]. World Health Organization, February 2006 [cit. 2007-06-25]. Dostupné online.
- ↑ Pavel Pafko: Plicní rakovina – klasifikace, rizikové faktory. Praha: tištěný SANQUIS č.17/2001, str. 45.
- ↑ a b c d e f VAPORCIYAN, AA, Nesbitt JC, Lee JS et al. Cancer Medicine. [s.l.]: B C Decker, 2000. ISBN 1-55009-113-1. S. 1227–1292.
- ↑ GORLOVA, OY, Weng SF, Zhang Y et al. Aggregation of cancer among relatives of never-smoking lung cancer patients. International Journal of Cancer. July 2007, roč. 121, čís. 1, s. 111–118. DOI 10.1002/ijc.22615. PMID 17304511.
- ↑ HACKSHAW, AK, Law MR, Wald NJ. The accumulated evidence on lung cancer and environmental tobacco smoke. British Medical Journal. 1997-10-18, roč. 315, čís. 7114, s. 980–988. Dostupné online. PMID 9365295.
- ↑ a b Catelinois O, Rogel A, Laurier D, et al.. Lung cancer attributable to indoor radon exposure in france: impact of the risk models and uncertainty analysis. Environ. Health Perspect.. September 2006, roč. 114, čís. 9, s. 1361–6. Dostupné online. DOI 0.1289/ehp.9070. PMID 16966089.
- ↑ http://www.who.int/mediacentre/factsheets/fs291/en/index.html – WHO:Radon and cancer
- ↑ a b KABIR, Z, Bennett K, Clancy L. Lung cancer and urban air-pollution in dublin: a temporal association?. Irish Medical Journal. February 2007, roč. 100, čís. 2, s. 367–369. PMID 17432813.
- ↑ COYLE, YM, Minahjuddin AT, Hynan LS, Minna JD. An ecological study of the association of metal air pollutants with lung cancer incidence in Texas. Journal of Thoracic Oncology. September 2006, roč. 1, čís. 7, s. 654–661. PMID 17409932.
- ↑ a b CHIU, HF, Cheng MH, Tsai SS et al. Outdoor air pollution and female lung cancer in Taiwan. Inhalation Toxicology. December 2006, roč. 18, čís. 13, s. 1025–1031. DOI 10.1080/08958370600904561. PMID 16966302.
- ↑ Carmona, RH. The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General [online]. U.S. Department of Health and Human Services, 2006-06-27. Dostupné online.
- ↑ Tobacco Smoke and Involuntary Smoking. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. WHO International Agency for Research on Cancer, 2002, roč. 83. Dostupné online [PDF].
- ↑ a b c d TRAVIS, WD, Travis LB, Devesa SS. Lung cancer. Cancer. January 1995, roč. 75, čís. Suppl. 1, s. 191–202. DOI 10.1002/1097-0142(19950101)75:1+<191::AID-CNCR2820751307>3.0.CO;2-Y. PMID 8000996. Chybná citace: Neplatná značka
<ref>; název „Travis“ použit vícekrát s různým obsahem - ↑ MORANDI, U, Casali C, Rossi G. Bronchial typical carcinoid tumors. Seminars in Thoracic and Cardiovascular Surgery. 2006, roč. 18, čís. 3, s. 191–198. DOI 10.1053/j.semtcvs.2006.08.005. PMID 17185178.
- ↑ ETIENNE-MASTROIANNI, B, Falchero L, Chalabreysse L et al. Primary sarcomas of the lung: a clinicopathologic study of 12 cases. Lung Cancer. December 2002, roč. 38, čís. 3, s. 283–289. DOI 10.1016/S0169-5002(02)00303-3. PMID 12445750.
- ↑ BRYANT, A, Cerfolio RJ. Differences in epidemiology, histology, and survival between cigarette smokers and never-smokers who develop non-small cell lung cancer. Chest. July 2007, roč. 132, čís. 1, s. 198–192. Dostupné online. DOI 10.1378/chest.07-0442. PMID 17573517.
- ↑ BARBONE, F, Bovenzi M, Cavallieri F, Stanta G. Cigarette smoking and histologic type of lung cancer in men. Chest. American College of Chest Physicians, December 1997, roč. 112, čís. 6, s. 1474–1479. Dostupné online [PDF]. DOI 10.1378/chest.112.6.1474. PMID 9404741.
- ↑ a b Dishop MK, Kuruvilla S. Primary and metastatic lung tumors in the pediatric population: a review and 25-year experience at a large children's hospital. Arch. Pathol. Lab. Med.. July 2008, roč. 132, čís. 7, s. 1079–103. Dostupné online. PMID 18605764.
- ↑ MOUNTAIN, CF, Libshitz HI, Hermes KE. A Handbook for Staging, Imaging, and Lymph Node Classification. [s.l.]: Charles P Young, 2003. Dostupné online.
- ↑ HAMILTON, W, Peters TJ, Round A, Sharp D. What are the clinical features of lung cancer before the diagnosis is made? A population based case-control study. Thorax. BMJ Publishing Group, December 2005, roč. 60, čís. 12, s. 1059–1065. DOI 10.1136/thx.2005.045880. PMID 16227326.
- ↑ JONES, DR, Detterbeck FC. Pancoast tumors of the lung. Current Opinion in Pulmonary Medicine. July 1998, roč. 4, čís. 4, s. 191–197. DOI 10.1097/00063198-199807000-00001. PMID 10813231.
- ↑ BIESALSKI, HK, Bueno de Mesquita B, Chesson A et al. European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel. CA Cancer J Clin. 1998, roč. 48, čís. 3, s. 167–176; discussion 164–166. Dostupné online. DOI 10.3322/canjclin.48.3.167. PMID 9594919.
- ↑ SAMET, JM, Wiggins CL, Humble CG, Pathak DR. Cigarette smoking and lung cancer in New Mexico. American Review of Respiratory Disease. May 1988, roč. 137, čís. 5, s. 1110–1113. PMID 3264122.
- ↑ VILLENEUVE, PJ, Mao Y. Lifetime probability of developing lung cancer, by smoking status, Canada. Canadian Journal of Public Health. November 1994, roč. 85, čís. 6, s. 385–388. PMID 7895211.
- ↑ SOPORI, M. Effects of cigarette smoke on the immune system. Nature Reviews. Immunology. May 2002, roč. 2, čís. 5, s. 372–7. DOI 10.1038/nri803. PMID 12033743.
- ↑ US Department of Health and Human Services. The Health Benefits of Smoking Cessation: a Report of the Surgeon General [PDF]. Centers for Disease Control (CDC), Office on Smoking and Health., 1990-09-30 [cit. 2007-11-18]. S. vi, 130, 148, 152, 155, 164, 166. Dostupné online.
- ↑ NORDQUIST, LT, Simon GR, Cantor A et al. Improved survival in never-smokers vs current smokers with primary adenocarcinoma of the lung. Chest. American College of Chest Physicians, August 2004, roč. 126, čís. 2, s. 347–351. Dostupné online. DOI 10.1378/chest.126.2.347. PMID 15302716.
- ↑ TAMMEMAGI, CM, Neslund-Dudas C, Simoff M, Kvale P. Smoking and lung cancer survival: the role of comorbidity and treatment. Chest. American College of Chest Physicians, January 2004, roč. 125, čís. 1, s. 27–37. Dostupné online. DOI 10.1378/chest.125.1.27. PMID 14718417.
- ↑ CDC. 1986 Surgeon General's report: the health consequences of involuntary smoking [online]. CDC, December 1986 [cit. 2007-08-10]. Dostupné online. PMID 3097495.
* NATIONAL RESEARCH COUNCIL. Environmental tobacco smoke: measuring exposures and assessing health effects. [s.l.]: National Academy Press, 1986. Dostupné online. ISBN 0-309-07456-8.
* EPA. Respiratory health effects of passive smoking: lung cancer and other disorders. cfpub2.epa.gov. EPA, 1992. Dostupné online [cit. 2007-08-10].
* CALIFORNIA ENVIRONMENTAL PROTECTION AGENCY. Health effects of exposure to environmental tobacco smoke. Tobacco Control. 1997, roč. 6, čís. 4, s. 346–353. Dostupné online. DOI 10.1136/tc.6.4.346. PMID 9583639.
* CDC. State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000. Morbidity and Mortality Weekly Report. Atlanta, Georgia: CDC, December 2001, roč. 50, čís. 49, s. 1101–1106. Dostupné online. PMID 11794619.
* ALBERG, AJ, Samet JM. Epidemiology of lung cancer. Chest. American College of Chest Physicians, January 2003, roč. 123, čís. S1, s. 21S–49S. Dostupné online. DOI 10.1378/chest.123.1_suppl.21S. PMID 12527563. - ↑ BOFFETTA, P, Agudo A, Ahrens W et al. Multicenter case-control study of exposure to environmental tobacco smoke and lung cancer in Europe. Journal of the National Cancer Institute. Oxford University Press, October 1998, roč. 90, čís. 19, s. 1440–1450. Dostupné online. DOI 10.1093/jnci/90.19.1440. PMID 9776409.
- ↑ Report of the Scientific Committee on Tobacco and Health [online]. Department of Health, March 1998 [cit. 2007-07-09]. Dostupné online.
* HACKSHAW, AK. Lung cancer and passive smoking. Statistical Methods in Medical Research. June 1998, roč. 7, čís. 2, s. 119–136. DOI 10.1191/096228098675091404. PMID 9654638. - ↑ Thun, M.J., S.J. Henley, D Burns, et al., Lung cancer death rates in lifelong nonsmokers. J. Natl Cancer Inst, 2006. 98: s.691.
- ↑ Sun, S., J.H. Schiller and A.F. Gazdar, Lung cancer in never-smokers: A different disease. Nat Rev Cancer, 2007. 7: s. 778–90.
- ↑ FIELD, RW, Steck DJ, Smith BJ et al. Residential radon gas exposure and lung cancer: the Iowa Radon Lung Cancer Study. American Journal of Epidemiology. Oxford Journals, 06/01/2000, roč. 151, čís. 11, s. 1091–1102. Dostupné online. PMID 10873134.
- ↑ EPA. Iowa Radon Lung Cancer Study [online]. EPA, June 2000 [cit. 2007-08-11]. Dostupné online.
- ↑ DARNTON, AJ, McElvenny DM, Hodgson JT. Estimating the number of asbestos-related lung cancer deaths in Great Britain from 1980 to 2000. Annals of Occupational Hygiene. January 2006, roč. 50, čís. 1, s. 29–38. Dostupné online. DOI 10.1093/annhyg/mei038. PMID 16126764.
- ↑ LEROUX, C, Girard N, Cottin V et al. Jaagsiekte Sheep Retrovirus (JSRV): from virus to lung cancer in sheep. Veterinary Research. March-April 2007, roč. 38, čís. 2, s. 211–228. DOI 10.1051/vetres:2006060. PMID 17257570.
- ↑ PALMARINI, M, Fan H. Retrovirus-induced ovine pulmonary adenocarcinoma, an animal model for lung cancer. Journal of the National Cancer Institute. Oxford University Press, November 2001, roč. 93, čís. 21, s. 1603–1614. Dostupné online. DOI 10.1093/jnci/93.21.1603. PMID 11698564.
- ↑ CHENG, YW, Chiou HL, Sheu GT et al. The association of human papillomavirus 16/18 infection with lung cancer among nonsmoking Taiwanese women. Cancer Research. American Association for Cancer Research, 04/01/2001, roč. 61, čís. 7, s. 2799–2803. Dostupné online. PMID 11306446.
- ↑ ZHENG, H, Aziz HA, Nakanishi Y et al. Oncogenic role of JC virus in lung cancer. Journal of Pathology. May 2007, roč. 212, čís. 3, s. 306–315. DOI 10.1002/path.2188. PMID 17534844.
- ↑ GIULIANI, L, Jaxmar T, Casadio C et al. Detection of oncogenic viruses (SV40, BKV, JCV, HCMV, HPV) and p53 codon 72 polymorphism in lung carcinoma. Lung Cancer. September 2007, roč. 57, čís. 3, s. 273–281. DOI 10.1016/j.lungcan.2007.02.019. PMID 17400331.
- ↑ ENGELS, EA, Wu X, Gu J et al. Systematic evaluation of genetic variants in the inflammation pathway and risk of lung cancer. Cancer Research. American Association for Cancer Research, July 2007, roč. 67, čís. 13, s. 6520–6527. DOI 10.1158/0008-5472.CAN-07-0370. PMID 17596594.
- ↑ WENZLAFF, AS, Cote ML, Bock CH et al. CYP1A1 and CYP1B1 polymorphisms and risk of lung cancer among never smokers: a population-based study. Carcinogenesis. Oxford University Press, December 2005, roč. 26, čís. 12, s. 2207–2212. DOI 10.1093/carcin/bgi191. PMID 16051642.
- ↑ SON, JW, Kang HK, Chae MH et al. Polymorphisms in the caspase-8 gene and the risk of lung cancer. Cancer Genetics and Cytogenetics. September 2006, roč. 169, čís. 2, s. 121–127. DOI 10.1016/j.cancergencyto.2006.04.001. PMID 16938569.
- ↑ YIN, J, Vogel U, Ma Y et al. The DNA repair gene XRCC1 and genetic susceptibility of lung cancer in a northeastern Chinese population. Lung Cancer. May 2007, roč. 56, čís. 2, s. 153–160. DOI 10.1016/j.lungcan.2006.12.012. PMID 17316890.
- ↑ Tomoda K, Ohkoshi T, Hirota K, et al.. Preparation and properties of inhalable nanocomposite particles for treatment of lung cancer. Colloids Surf B Biointerfaces. February 2009, roč. 71, s. 177. Dostupné online. DOI 10.1016/j.colsurfb.2009.02.001. PMID 19264458.
- ↑ FAN, YG, Hu P, Jiang Y, et al. Association between sputum atypia and lung cancer risk in an occupational cohort in yunnan, china. Chest. March 2009, roč. 135, čís. 3, s. 778–85. DOI 10.1378/chest.08-1469. PMID 19265088.
- ↑ VINEIS, P, Hoek G, Krzyzanowski M et al. Lung cancers attributable to environmental tobacco smoke and air pollution in non-smokers in different European countries: a prospective study. Environmental Health. BioMed Central, February 2007, roč. 6, s. 7. DOI 10.1186/1476-069X-6-7. PMID 17302981.
- ↑ a b A Decade of Broken Promises: The 1998 State Tobacco Settlement Ten Years Later [online]. Campaign for Tobacco-Free Kids [cit. 2008-12-03]. Dostupné online.
- ↑ GRAY, N. A global approach to tobacco policy. Lung Cancer. BioMed Central, February 2003, roč. 39, čís. 2, s. 113–117. DOI 10.1016/S0169-5002(02)00456-7. PMID 12581561.
- ↑ SLATORE, CG, Littman AJ, Au DH, Satia JA, White E. Long-term use of supplemental multivitamins, vitamin C, vitamin E, and folate does not reduce the risk of lung cancer. American Journal of Respiratory and Critical Care Medicine. 2008, roč. 177, čís. 5, s. 524–30. DOI 10.1164/rccm.200709-1398OC. PMID 17989343.
- ↑ UN health agency calls for total ban on tobacco advertising to protect young. www.un.org. United Nations News service, 2008-05-30. Dostupné online.
- ↑ GOHAGAN, JK, Marcus PM, Fagerstrom RM et al. Final results of the Lung Screening Study, a randomized feasibility study of spiral CT versus chest X-ray screening for lung cancer. Lung Cancer. January 2005, roč. 47, čís. 1, s. 9–15. DOI 10.1016/j.lungcan.2004.06.007. PMID 15603850.
- ↑ Schiller JH, Vidaver RM, Novello S, Brahmer J, Monroe L. Living with a Diagnosis of Lung Cancer [online]. [National Lung Cancer Partnership], 2007 [cit. 2008-12-01]. Dostupné online.
- ↑ STRAND, TE, Rostad H, Damhuis RA, Norstein J. Risk factors for 30-day mortality after resection of lung cancer and prediction of their magnitude. Thorax. BMJ Publishing Group, June 2007, roč. 62, s. 991. DOI 10.1136/thx.2007.079145. PMID 17573442.
- ↑ EL-SHERIF, A, Gooding WE, Santos R et al. Outcomes of sublobar resection versus lobectomy for stage I non-small cell lung cancer: a 13-year analysis. Annals of Thoracic Surgery. August 2006, roč. 82, čís. 2, s. 408–415. DOI 10.1016/j.athoracsur.2006.02.029. PMID 16863738.
- ↑ FERNANDO, HC, Santos RS, Benfield JR et al. Lobar and sublobar resection with and without brachytherapy for small stage IA non-small cell lung cancer. Journal of Thoracic and Cardiovascular Surgery. February 2005, roč. 129, čís. 2, s. 261–267. DOI 10.1016/j.jtcvs.2004.09.025. PMID 15678034.
- ↑ Casali G, Walker WS. Video-assisted thoracic surgery lobectomy: can we afford it?. Eur J Cardiothorac Surg. March 2009, roč. 35, čís. 3, s. 423–8. DOI 10.1016/j.ejcts.2008.11.008. PMID 19136272.
- ↑ Araujo AM, Mendez JC, Coelho AL, et al.. Phase II Study of Celecoxib with Cisplatin Plus Etoposide in Extensive-Stage Small Cell Lung Cancer. Cancer Invest.. March 2009, roč. 27, s. 1. Dostupné online. DOI 10.1080/07357900802232756. PMID 19266367.
- ↑ WINTON, T, Livingston R, Johnson D, et al. Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer. New England Journal of Medicine. Massachusetts Medical Society, June 2005, roč. 352, čís. 25, s. 2589–2597. DOI 10.1056/NEJMoa043623. PMID 15972865.
- ↑ DOUILLARD, JY, Rosell R, De Lena M et al. Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial. Lancet Oncology. Elsevier, September 2006, roč. 7, čís. 9, s. 719–727. DOI 10.1016/S1470-2045(06)70804-X. PMID 16945766.
- ↑ TSUBOI, M, Ohira T, Saji H et al. The present status of postoperative adjuvant chemotherapy for completely resected non-small cell lung cancer. Annals of Thoracic and Cardiovascular Surgery. April 2007, roč. 13, čís. 2, s. 73–77. Dostupné online [PDF]. PMID 17505412.
- ↑ WAGNER, H. Radiation therapy in the management of limited small cell lung cancer: when, where, and how much?. Chest. American College of Chest Physicians, January 1998, roč. 113, čís. Suppl. 1, s. 92S–100S. Dostupné online. DOI 10.1378/chest.113.1_Supplement.92S. PMID 9438697.
- ↑ LALLY, BE, Zelterman D, Colasanto JM et al. Postoperative Radiotherapy for Stage II or III Non–Small-Cell Lung Cancer Using the Surveillance, Epidemiology, and End Results Database. Journal of Clinical Oncology. John Wiley & Sons, July 2006, roč. 24, čís. 19, s. 2998–3006. Dostupné online. DOI 10.1200/JCO.2005.04.6110. PMID 16769986.
- ↑ RABEN, A, Mychalczak B. Brachytherapy for non-small cell lung cancer and selected neoplasms of the chest. Chest. American College of Chest Physicians, October 1997, roč. 112, čís. Suppl. 4, s. 276S–286S. Dostupné online. DOI 10.1378/chest.112.4_Supplement.276S. PMID 9337304.
- ↑ CELEBIOGLU, B, Gurkan OU, Erdogan S et al. High dose rate endobronchial brachytherapy effectively palliates symptoms due to inoperable lung cancer. Japanese Journal of Clinical Oncology. Oxford University Press, November 2002, roč. 32, čís. 11, s. 443–448. Dostupné online. DOI 10.1093/jjco/hyf102. PMID 12499415.
- ↑ NG, M, Chong J, Milner A et al. Tolerability of accelerated chest irradiation and impact on survival of prophylactic cranial irradiation in patients with limited-stage small cell lung cancer: review of a single institution's experience. Journal of Thoracic Oncology. International Association for the Study of Lung Cancer, June 2007, roč. 2, čís. 6, s. 506–513. DOI 10.1097/JTO.0b013e318060095b. PMID 17545845.
- ↑ SLOTMAN, B, Faivre-Finn C, Kramer G et al. Prophylactic cranial irradiation in extensive small-cell lung cancer. New England Journal of Medicine. August 2007, roč. 357, čís. 7, s. 664–672. Dostupné online. DOI 10.1056/NEJMoa071780. PMID 17699816.
- ↑ HOF, H, Muenter M, Oetzel D et al. Stereotactic single-dose radiotherapy (radiosurgery) of early stage nonsmall-cell lung cancer (NSCLC). Cancer. Wiley InterScience, July 2007, roč. 110, čís. 1, s. 148–155. Dostupné online. DOI 10.1002/cncr.22763. PMID 17516437.
- ↑ SIMON, CJ, Dupuy DE, DiPetrillo TA et al. Pulmonary radiofrequency ablation: long-term safety and efficacy in 153 patients. Radiology. April 2007, roč. 243, čís. 1, s. 268–275. DOI 10.1148/radiol.2431060088. PMID 17392258.
- ↑ a b BENCARDINO, K, Manzoni M, Delfanti S et al. Epidermal growth factor receptor tyrosine kinase inhibitors for the treatment of non-small-cell lung cancer: results and open issues. Internal and Emergency Medicine. March 2007, roč. 2, čís. 1, s. 3–12. DOI 10.1007/s11739-007-0002-5. PMID 17551677.
- ↑ FELD, R, Sridhar SS, Shepherd FA et al. Use of the epidermal growth factor receptor inhibitors gefitinib and erlotinib in the treatment of non-small cell lung cancer: a systematic review. Journal of Thoracic Oncology. International Association for the Study of Lung Cancer, May 2006, roč. 1, čís. 4, s. 367–376. DOI 10.1097/01243894-200605000-00018. PMID 17409886.
- ↑ SANDLER, A, Gray R, Perry M et al. Paclitaxel–carboplatin alone or with bevacizumab for non–small cell lung cancer. New England Journal of Medicine. Massachusetts Medical Society, December 2006, roč. 355, čís. 24, s. 2542–2550. DOI 10.1056/NEJMoa061884. PMID 17167137.
- ↑ EDELMAN, MJ. Novel cytotoxic agents for non-small cell lung cancer. Journal of Thoracic Oncology. September 2006, roč. 1, čís. 7, s. 752–755. PMID 17409954.
- ↑ DANESI, R, Pasqualetti G, Giovannetti E, Del Tacca M. The role of pharmacogenetics in adjuvant treatment of non-small cell lung cancer. Journal of Thoracic Oncology. May 2007, roč. 2, čís. 5 Suppl., s. S27–S30. DOI 10.1097/01.JTO.0000268638.10332.07. PMID 17457227.
- ↑ BLACKHALL, FH, Shepherd FA. Small cell lung cancer and targeted therapies. Current Opinion in Oncology. March 2007, roč. 19, čís. 2, s. 103–108. DOI 10.1097/CCO.0b013e328011bec3. PMID 17272981.
- ↑ LEE, JM, Mao JT, Krysan K, Dubinett SM. Significance of cyclooxygenase-2 in prognosis, targeted therapy and chemoprevention of NSCLC. Future Oncology. April 2007, roč. 2, čís. 2, s. 149–153. DOI 10.2217/14796694.3.2.149. PMID 17381414.
- ↑ WHITEHEAD, CM, Earle KA, Fetter J et al. Exisulind-induced Apoptosis in a Non-Small Cell Lung Cancer Orthotopic Lung Tumor Model Augments Docetaxel Treatment and Contributes to Increased Survival. Molecular Cancer Therapeutics. 05/01/2003, roč. 2, čís. 5, s. 479–488. Dostupné online. PMID 12748310.
- ↑ SCAGLIOTTI, G. Proteasome inhibitors in lung cancer. Critical Reviews in Oncology/Haematology. June 2006, roč. 58, čís. 3, s. 177–189. DOI 10.1016/j.critrevonc.2005.12.001. PMID 16427303.
- ↑ DRAGNEV, KH, Petty WJ, Shah SJ et al. A proof-of-principle clinical trial of bexarotene in patients with non-small cell lung cancer. Clinical Cancer Research. American Association for Cancer Research, March 2007, roč. 13, čís. 6, s. 1794–1800. DOI 10.1158/1078-0432.CCR-06-1836. PMID 17363535.
- ↑ READE, CA, Ganti AK. EGFR targeted therapy in non-small cell lung cancer: potential role of cetuximab. Biologics. July 2009, roč. 3, s. 215–224. Dostupné online. PMID 19707410.
- ↑ ALBRIGHT, C, Garst J. Vaccine therapy in non-small cell lung cancer. Current Oncology Reports. July 2007, roč. 9, čís. 4, s. 241–246. DOI 10.1007/s11912-007-0029-9. PMID 17588347.
- ↑ SUN, S, Schiller JH, Spinola M, Minna JD. New molecularly targeted therapies for lung cancer. Journal of Clinical Investigation. American Society for Clinical Investigation, October 2007, roč. 117, čís. 10, s. 2740–2750. Dostupné online. DOI 10.1172/JCI31809. PMID 17909619.
- ↑ Non-Small Cell Lung Cancer Treatment [online]. National Cancer Institute [cit. 2008-11-22]. (PDQ for Health Professionals). Dostupné online.
- ↑ -Small Cell Lung Cancer Treatment [online]. National Cancer Institute [cit. 2008-11-22]. (PDQ for Health Professionals). Dostupné online.
- ↑ MOUNTAIN, CF. Revisions in the international system for staging lung cancer. Chest. American College of Chest Physicians, 1997, roč. 111, s. 1710–1717. Dostupné online [PDF]. DOI 10.1378/chest.111.6.1710. PMID 9187198.
- ↑ Cancer Statistics Review 1975-2002 - Search [online]. [cit. 2007-11-18]. (Surveillance Epidemiology and End Results (SEER)). Dostupné online.
- ↑ Commonly diagnosed cancers worldwide [online]. Cancer Research UK, April 2005 [cit. 2008-01-11]. Dostupné online.
- ↑ Jemal, A., R.C. Tiwari, T. Murray, A. Ghafoor, A. Samuels, El. Ward, E.J. Feuer, and M.J. Thun, Cancer statistics, 2004. CA Cancer J Clin, 2004. 54(1): s. 8–29.
- ↑ PARENT, ME, Rousseau MC, Boffetta P et al. Exposure to diesel and gasoline engine emissions and the risk of lung cancer. American Journal of Epidemiology. January 2007, roč. 165, čís. 1, s. 53–62. DOI 10.1093/aje/kwj343. PMID 17062632.
- ↑ Gender in lung cancer and smoking research [PDF]. World Health Organization, 2004 [cit. 2007-05-26]. Dostupné online.
- ↑ LIU, BQ, Peto R, Chen ZM et al. Emerging tobacco hazards in China: 1. Retrospective proportional mortality study of one million deaths. British Medical Journal. 1998-11-21, roč. 317, čís. 7170, s. 1411–1422. Dostupné online. PMID 9822393.
- ↑ BEHERA, D, Balamugesh T. Lung cancer in India. Indian Journal of Chest Diseases and Allied Sciences. 2004, roč. 46, čís. 4, s. 269–281. Dostupné online [PDF]. PMID 15515828.
- ↑ MOHR, SB, Garland CF, Gorham ED et al. Could ultraviolet B irradiance and vitamin D be associated with lower incidence rates of lung cancer?. Journal of Epidemiology and Community Health. 2008, roč. 62, čís. 1, s. 69–74. DOI 10.1136/jech.2006.052571. PMID 18079336.
- ↑ a b CHEN, F, Bina WF, Cole P. Declining incidence rate of lung adenocarcinoma in the United States. Chest. April 2007, roč. 131, čís. 4, s. 1000–1005. Dostupné online. DOI 10.1378/chest.06-1695. PMID 17426202.
- ↑ MORGAGNI, Giovanni Battista. De sedibus et causis morborum per anatomen indagatis. [s.l.]: [s.n.], 1761. Dostupné online.
- ↑ BAYLE, Gaspard-Laurent. Recherches sur la phtisie pulmonaire. [s.l.]: [s.n.], 1810. (French)
- ↑ Adler, I. Primary Malignant Growths of the Lungs and Bronchi. [s.l.]: Longmans, Green, and Company, 1912. OCLC 14783544, cited in Spiro SG, Silvestri GA. One hundred years of lung cancer. American Journal of Respiratory and Critical Care Medicine. 2005, roč. 172, čís. 5, s. 523–529. DOI 10.1164/rccm.200504-531OE. PMID 15961694.
- ↑ US Department of Health Education and Welfare. Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service [PDF]. US Government Printing Office, 1964. Dostupné online.
- ↑ PIROZYNSKI, M. 100 years of Lung Cancer. Respiratory Medicine. December 2006, roč. 100, čís. 12, s. 2073–2084. DOI 10.1016/j.rmed.2006.09.002. PMID 17056245.
- ↑ HORN, L, Johnson DH. Evarts A. Graham and the first pneumonectomy for lung cancer. Journal of Clinical Oncology. July 2008, roč. 26, čís. 19, s. 3268–3275. Dostupné online. DOI 10.1200/JCO.2008.16.8260. PMID 18591561.
- ↑ KABELA, M. [Experience with radical irradiation of bronchial cancer]. Ceskoslovenská Onkológia. 1956, roč. 3, čís. 2, s. 109–115. PMID 13383622. (German)
- ↑ LENNOX, SC, Flavell G, Pollock DJ et al. Results of resection for oat-cell carcinoma of the lung. Lancet. Elsevier, November 1968, roč. 2, čís. 7575, s. 925–927. DOI 10.1016/S0140-6736(68)91163-X. PMID 4176258.
- ↑ MILLER, AB, Fox W, Tall R. Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus. Lancet. Elsevier, September 1969, roč. 2, čís. 7619, s. 501–505. DOI 10.1016/S0140-6736(69)90212-8. PMID 4184834.
- ↑ COHEN, M, Creaven PJ, Fossieck BE Jr et al. Intensive chemotherapy of small cell bronchogenic carcinoma. Cancer Treatment Reports. 1977, roč. 61, čís. 3, s. 349–354. PMID 194691.
Související články
Externí odkazy
- (česky) Informační web Rakovinaplic.cz
- (anglicky) Detailed guide: Lung cancer – small cell American Cancer Society
- (anglicky) Detailed guide: Lung cancer – non-small cell American Cancer Society
- (anglicky) LungCancer.org — free resources and support services
- (anglicky) Lung cancer National Cancer Institute
- (anglicky) Tobacco smoke and involuntary smoking, summary of data reported and evaluation (2004) IARC
- (anglicky) Lung Cancer Articles & Information Stop smoking articles & information at National Institutes of Health
- (anglicky) Medical Encyclopedia WebMD: Lung Cancer Health Center
- (anglicky) Medical Encyclopedia MayoClinic: Lung cancer
Šablona:Link FA Šablona:Link FA Šablona:Link FA Šablona:Link FA Šablona:Link FA Šablona:Link FA Šablona:Link FA Šablona:Link FA Šablona:Link GA
