Oxidy uhlíku
Oxidy uhlíku jsou chemické sloučeniny obsahující pouze atomy uhlíku a kyslíku.[1][2] Nejjednoduššími a zároveň nejrozšířenějšími zástupci této skupiny jsou oxid uhelnatý (CO) a oxid uhličitý (CO2); je známa i řada dalších, stabilních nebo metastabilních, jako například suboxid uhlíku (C3O2) a anhydrid kyseliny mellitové (C12O9).

| |||||||
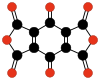
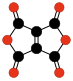
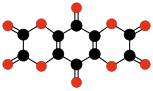
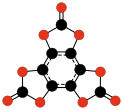
| CO Oxid uhelnatý |
CO2 Oxid uhličitý |
C3O2 Suboxid uhlíku |
C12O9 Anhydrid kyseliny mellitové |
Většina dalších oxidů uhlíku byla připravena po roce 1960. Některé z nich jsou za pokojové teploty stálé, jiné metastabilní nebo stálé jen za nízkých teplot, kdy se při zahřátí rozkládají na jednodušší oxidy. Řada těchto oxidů je nestabilních a vyskytují se pouze jako meziprodukty chemických reakcí, nebo jsou tak reaktivní, že je lze zachytit jen matricovou izolací.
Popsány jsou také oxid grafenu a jiné stabilní polymerní oxidy uhlíku.[3][4]
Přehled[editovat | editovat zdroj]
Oxid uhličitý (CO2) je široce rozšířen v přírodě, vytváří se dýcháním, spalováním látek obsahujících uhlík, a kvašením. Pod různými názvy je znám od 17. století.
Oxid uhelnatý vzniká nedokonalým spalováním a byl využíván (i když ještě nebyl znám jako látka) od starověku při výrobě železa. Podobně jako oxid uhličitý jej alchymisté a chemici zkoumali již ve středověku. Jeho složení zjistil v roce William Cruikshank.
Suboxid uhlíku objevil Benjamin Brodie v roce 1873, získal jej průchodem elektrického proudu oxidem uhličitým.[5]
Anhydrid kyseliny mellitové (C12O9) poprvé připravili Justus Liebig a Friedrich Wöhler v roce 1830 při výzkumu melitu, ale složení bylo určeno až roku 1913.[6][7][8]
V roce 1859 se objevil pátý známý oxid uhlíku, nazvaný oxid grafitu, obsahující uhlík a kyslík v různých poměrech mezi 2:1 a 3:1; ale jeho struktura zůstala po několik let neznámá. Tento oxid má využití v nanotechnologiích.[3]
K nestabilním nebo metastabilním oxidům patří například radikálový monooxid diuhlíku (:C=C=O), trioxid uhlíku (CO3),[9] tetroxid uhlíku (CO4),[10][11] pentoxid uhlíku (CO5),[12] hexoxid uhlíku (CO6)[13] a 1,2-dioxetandion (C2O4).[14][15] Některé z těchto reaktivních oxidů byly rotační spektroskopií nalezeny v molekulárních mezihvězdných mračnech.[16]
Mnoho hypotetických oxidů uhlíku bylo předměty teoretických studií, jako příklady lze uvést oxalanhydrid (C2O3), ethylendion (C2O2)[17] a další lineární nebo cyklické polymery oxidu uhelnatého (-CO-)n (polyketony),[18] a polymery oxidu uhličitého (-CO2-)n, jako je dimer 1,3-dioxetanedion (C2O4).[19]

| |||||
| C2O3 Oxalanhydrid |
C2O2 Ethylendion |
C2O4 1,3-Dioxetan-dion |
Struktura[editovat | editovat zdroj]
Atomy uhlíku jsou obvykle čtyřvazné a kyslík bývá dvojvazný. Zatímco uhlík se může vázat do libovolně dlouhých řetězců, tak řetězce obsahující tři nebo více atomů kyslíku jsou vzácné; popsané elektricky neutrální oxidy uhlíku tak zpravidla obsahují jeden nebo více atomů uhlíku vytvářející řetězce (které mohou být cyklické, dokonce i aromatické) zakončené oxidovými (-O-, =O) nebo peroxidovými (-O-O-) skupinami.
V některých oxidech, jako je diradikál C2O (:C=C=O), se vyskytují uhlíky s nižší vazností; tyto sloučeniny bývají ale příliš reaktivní, aby mohly být izolovány.[20] Ztráta nebo získání elektronů může vést k jednovaznému záporně nabitému kyslíku (-O−), trojvaznému kladně nabitému kyslíku (≡O+), nebo trojvaznému záporně nabitému uhlíku (≡C−). Trojvazný uhlík i kyslík se vyskytují v oxidu uhelnatém, −C≡O+.[21]
Linární dioxidy[editovat | editovat zdroj]
Jedna ze skupin oxidů uhlíku má obecný vzorec CnO2, O=(C=)nO, tedy lineární řetězec uhlíkových atomů s kyslíky na obou koncích. Patří sem:
- CO2 (O=C=O), oxid uhličitý.
- C2O2 (O=C=C=O), velmi nestabilní ethylendion.[17]
- C3O2 (O=C=C=C=O), dioxid triuhlíku neboli suboxid uhlíku.
- C4O2 (O=C=C=C=C=O), dioxid tetrauhlíku, také nazývaný buta-1,2,3-trien-1,4-dion[22]
- C5O2 or O=C=C=C=C=C=O, dioxid pentauhlíku,[23] stálý v roztoku za pokojové teploty a čistý do −90 °C.[24]
Některé vyšší členy této řady, například sloučeniny s n = 7,[24] a n = 17, 19, a 21,[25] se podařilo identifikovat ve stopových množstvích jako plyny o nízkých tlacích a/nebo v matricích za nízkých teplot.
Lineární monoxidy[editovat | editovat zdroj]
Další skupinou jsou lineární monoxidy uhlíku, CnO. První člen této řady, oxid uhelnatý (CO), je jedinou takovou látkou, která je v čistém stavu za pokojové teploty stálá. Fotolýza lineárních dioxidů v kryogenních matricích vyvolává odštěpování CO, čímž vznikají detekovatelná množství monoxidů se sudým počtem uhlíků, jako jsou C2O, C4O,[20] a C6O.[24] Byly vytvořeny i molekuly s n až 9, a to elektrickými výboji ve směsi plynného C3O2 a argonu.[26] CO, C2O a C4O byly nalezeny v mezihvězdném prostoru.[26]
Při sudém n molekuly pravděpodobně zaujímají tripletové stavy podobné kumulenům, jejichž atomy jsou propojeny dvojnými vazbami a první atom uhlíku má nezaplněný orbital; obecný vzorec takových sloučenin je :(C=)n=O. Jestliže má n lichou hodnotu, tak triplet rezonuje se singletem a vzniká molekula podobná acetylenu, která je polární e záporným nábojem na koncovém uhlíku a kladným na koncovém kyslíku; takové molekuly odpovídají obecnému vzorci −(C≡C−)(n−1)/2C≡O+.[26] Takto vypadá i oxid uhelnatý: jeho převažující podobou je −C≡O+.[21]
Radialenové cyklické polyketony[editovat | editovat zdroj]
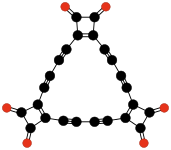
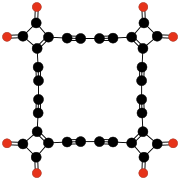
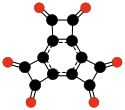
Radialenové oxidy uhlíku mají vzorec (CO)n.[27] Lze je považovat za cyklické polymery oxidu uhelnatého, nebo n-násobné ketony n-uhlíkatých cykloalkanů; za první sloučeninu v této řadě lze považovat samotný oxid uhelnatý (CO). Teoretické studie naznačují, že ethylendion (O=C=C=O) a cyklopropantrion (C3O3) nemohou existovat.[17][18] Následující tři sloučeniny — cyklobutantetron, cyklopentanpenton, a cyclohexanhexon — jsou nestabilní,[18] tak byly vytvořeny pouze v malých množstvích.[28][29]

|

|

|

| ||||||
| (CO)2 Ethylendion |
(CO)3 Cyklopropantrion |
(CO)4 Cyklobutane-tetron |
(CO)5 Cyklopentanpenton |
(CO)6 Cyklohexanhexon |
Anionty odvozené od těchto oxidů jsou poměrně stálé, některé byly objeveny již v 19. století.[27] Patří sem
- C2O22−, acetylendiolát,[30]
- C3O32−, deltát,[31][32]
- C4O42−, squarát,[33]
- C5O 2−
5 , krokonát[34] a - C6O 2−
6 , rodizonát.[35][36]
Cyklický oxid C6O6 také vytváří stabilní anionty, tetrahydroxy-1,4-benzochinon (C6O 4−
6 ) a benzenhexol (C6O 6−
6 ),[37] Aromaticita těchto aniontů byla zkoumána v několika studiích.[38][39]
Nové oxidy[editovat | editovat zdroj]
Od 60. let 20. století bylo připraveno několik dalších stabilních a metastabilních oxidů uhlíku:
- C10O8, dianhydrid kyseliny benzochinontetrakarboxylové[40]
- C6O6, dianhydrid kyseliny ethentetrakarboxylové, stabilní izomer cyklohexanhexonu[41]
- C12O12 )také C6(C2O4)3), hexahydroxybenzentrisoxalát; stabilní jako rozpuštěný v tetrahydrofuranu[42]
- C10O10 (C6O2(C2O4)2), tetrahydroxy-1,4-benzochinonbisoxalát ; stabilní jako rozpuštěný v tetrahydrofuranu[43]
- C8O8 (C6O2(CO3)2), tetrahydroxy-1,4-benzochinonbiskarbonát; při 45–53 °C se rozkládá.[44]
- C9O9 (C6(CO3)3), hexahydroxybenzentriskarbonát; při 45–53 °C se rozkládá.[44]
- C24O6, cyklický trimer biradikálu 3,4-dialkynyl-3-cyklobuten-1,2-dionu -C≡C-(C4O2)-C≡C-;[45]
- C32O8, tetramer 3,4-dialkynyl-3-cyklobutene-1,2-dionu[45]
- C4O6, dioxantetron (dimer oxalanhydridu); při −30 °C stabilní v diethyletherovém roztoku, za teploty 0 °C se rozkládá.[46]
- C12O6, hexaoxotricyklobutabenzen[47][48]
Mnoho dalších oxidů bylo zkoumáno teoreticky, přičemž se některé, jako například karbonáty a oxaláty tetrahydroxy-1,2-benzochinonu a kyseliny rodizonové, krokonové, kvadrátové a deltové, ukázaly jako pravděpodobně stálé.[18]
Polymerní oxidy uhlíku[editovat | editovat zdroj]
Suboxid uhlíku se za pokojové teploty samovolně polymerizuje, vzniklý polymer má poměr počtu uhlíkových a kyslíkových atomů 3:2. Předpokládá se, že obsahuje lineární řetězce šestičlenných laktonových kruhů a uhlíkatý řetězec, ve kterém se střídají jednoduché a dvojné vazby. Střední počet jednotek na molekulu je mezi 5 a 6, přesná hodnota závisí na teplotě, při které polymer vznikal.[4][49]

|

| ||||||||
| Koncové a opakující se jednotky polymerního C3O2[4] | |||||||||

|

|

|

| ||||||
| Oligomery C3O2 obsahující 3 až 6 jednotek.[4] | |||||||||
Oxid uhelnatý za tlaků kolem 5 GPa vytváří červený polymer s mírně vyšším obsahem kyslíku, který je za běžných tlaků metastabilní. Předpokládá se, že se CO při stlačování disproporcionuje na směs CO2 a C3O2, kde následně druhá z těchto látek utvoří polymer podobný výše popsanému (s nepravidelnější strukturou), který ve své matrici zachytí část CO2.[50][51]
Polymerem, s poměrem C:O 5:1 nebo vyšším, je také oxid grafitu[3] a oxid grafenu.
Oxidy a ozonidy fullerenů[editovat | editovat zdroj]
Je známo více než 20 oxidů a ozonidů fullerenů, například:[52]
- C60O (2 izomery)
- C60O2 (6 izomerů)
- C60O3 (3 izomeryrů)
- C120O
- C120O4 (4 izomery)
- C70O
- C140O
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Oxocarbon na anglické Wikipedii.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.o04375. (anglicky) DOI: 10.1351/goldbook.
- ↑ West, R. (ed.) (1980), Oxocarbons. Academic Press, New York.
- ↑ a b c HUMMERS, William S.; OFFEMAN, Richard E. Preparation of Graphitic Oxide. Journal of the American Chemical Society. 1958, s. 1339. DOI 10.1021/ja01539a017.
- ↑ a b c d SNOW, A. W.; HAUBENSTOCK, H.; YANG, N.-L. Poly(carbon suboxide). Characterization, Polymerization, and Radical Structure. Macromolecules. 1978, s. 77–86. DOI 10.1021/ma60061a015. Bibcode 1978MaMol..11...77S.
- ↑ Brodie, B. C. Note on the Synthesis of Marsh-Gas and Formic Acid, and on the Electric Decomposition of Carbonic Oxide. Proceedings of the Royal Society. 1873, s. 245–247. DOI 10.1098/rspl.1872.0052.
- ↑ Liebig, J. and Wöhler, F. (1830), Ueber die Zusammensetzung der Honigsteinsäure Poggendorfs Annalen der Physik und Chemie, vol. 94, issue 2, pp.161–164
- ↑ Meyer H., Steiner K. Über ein neues Kohlenoxyd C12O9 (A new carbon oxide C12O9). Berichte der Deutschen Chemischen Gesellschaft. 1913, s. 813–815. Dostupné online. DOI 10.1002/cber.191304601105.
- ↑ Bugge (1914), Chemie: En neues Kohenoxyd. Review of Meyer and Steiner's discovery of C12O9. Naturwissenschaftliche Wochenschrift, volume 13/29, issue 12, 22 March 1914, p. 188. [1]
- ↑ DeMore, W. B.; JACOBSEN, C. W. Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide. Journal of Physical Chemistry. 1969, s. 2935–2938. DOI 10.1021/j100843a026.
- ↑ YEUNG, L. Y.; OKUMURA, M.; PACI, J. T.; SCHATZ, G. C.; ZHANG, J.; MINTON, T. K. Hyperthermal O-Atom Exchange Reaction O2 + CO2 through a CO4 Intermediate. Journal of the American Chemical Society. 2009, s. 13940–13942. Dostupné online. DOI 10.1021/ja903944k. PMID 19743846.
- ↑ Corey S. Jamieson; ALEXANDER M. MEBEL; RALF I. KAISER. Novel detection of the C-2v isomer of carbon tetraoxide (CO4). Chemical Physics Letters. 2007, s. 105–109. DOI 10.1016/j.cplett.2007.04.043. Bibcode 2007CPL...440..105J.
- ↑ JAMIESON, Corey S.; MEBEL, Alexander M.; KAISER, Ralf I. First detection of the C2 symmetric isomer of carbon pentaoxide (CO5) at 10K. Chemical Physics Letters. 2007-07-26, s. 49–54. Dostupné online. DOI 10.1016/j.cplett.2007.06.009. Bibcode 2007CPL...443...49J.
- ↑ JAMIESON, Corey S.; MEBEL, Alexander M.; KAISER, Ralf I. First detection of the Cs symmetric isomer of carbon hexaoxide (CO6) at 10K. Chemical Physics Letters. 2008-01-04, s. 312–317. DOI 10.1016/j.cplett.2007.11.052. Bibcode 2008CPL...450..312J.
- ↑ CORDES, Herman F.; RICHTER, Herbert P.; HELLER, Carl A. Mass spectrometric evidence for the existence of 1,2-dioxetanedione (carbon dioxide dimer). Chemiluminescent intermediate. Journal of the American Chemical Society. 1969, s. 7209. DOI 10.1021/ja01053a065.
- ↑ BOS, Richard; BARNETT, Neil W.; DYSON, Gail A.; LIM, Kieran F.; RUSSELL, Richard A.; WATSON, Simon P. Studies on the mechanism of the peroxyoxalate chemiluminescence reaction. Analytica Chimica Acta. 2004, s. 141. DOI 10.1016/j.aca.2003.10.014.
- ↑ H. M. Pickett E. A. Cohen B. J. Drouin J. C. Pearson (2003), Submillimeter, Millimeter, and Microwave Spectral Line Catalog. NASA/JPL, Online version
- ↑ a b c SCHRÖDER, Detlef; HEINEMANN, Christoph; SCHWARZ, Helmut; HARVEY, Jeremy N.; DUA, Suresh; BLANKSBY, Stephen J.; BOWIE, John H. Ethylenedione: An Intrinsically Short-Lived Molecule. Chemistry: A European Journal. 1998, s. 2550–2557. DOI 10.1002/(SICI)1521-3765(19981204)4:12<2550::AID-CHEM2550>3.0.CO;2-E.
- ↑ a b c d JIAO, Haijun; WU, Hai-Shun. Are Neutral Oxocarbons Stable?. The Journal of Organic Chemistry. 2003, s. 1475–1479. DOI 10.1021/jo026243m. PMID 12585891.
- ↑ LEWARS, Errol. Polymers and oligomers of carbon dioxide: Ab initio and semiempirical calculations. Journal of Molecular Structure: THEOCHEM. 1996, s. 1–15. DOI 10.1016/0166-1280(95)04420-5.
- ↑ a b Maier, Günter and Reisenauer, Hans Peter (2001) Carbenes in Matrices: Specrospcopy, Structure, and Photochemical Behavior, Advances in carbene chemistry, p. 135. Elsevier ISBN 0-444-50892-9
- ↑ a b Kutzelnigg, W. Einführung in die Theoretische Chemie. [s.l.]: Wiley-VCH, 2002. ISBN 3-527-30609-9.
- ↑ Günther Maier, Hans Peter Reisenauer, Heinz Balli, Willy Brandt, Rudolf Janoschek (1990): C4O2 (1,2,3-Butatriene-1,4-dione), the First Dioxide of Carbon with an Even Number of C Atoms Angewandte Chemie (International Edition in English), volume 29, issue 8, pages 905–908
- ↑ Günther Maier; HANS PETER REISENAUER; ULRICH SCHÄFER; HEINZ BALLI. C5O2 (1,2,3,4-Pentatetraene-1,5-dione), a New Oxide of Carbon. Angewandte Chemie International Edition in English. 1988, s. 566–568. DOI 10.1002/anie.198805661.
- ↑ a b c Eastwood, Frank W. (1997), Gas Phase Pyrolytic Methods for the Preparation of Carbon-Hydrogen and Carbon-Hydrogen-Oxygen Compounds., Gas Phase Reactions in Organic Synthesis CRC Press ISBN 90-5699-081-0
- ↑ Reusch, Roman (2005). Absorptionsspektroskopie von langen Kohlenstoff-Kettenmolekülen und deren Oxide in kryogenen Matrizen. Ruprecht-Karls-Universität Heidelberg
- ↑ a b c Ogata, Teruhiko; TATAMITANI, YOSHIO. The Simplest Linear-Carbon-Chain Growth by Atomic-Carbon Addition and Ring Opening Reactions. The Journal of Physical Chemistry A. 2008, s. 10713–10715. DOI 10.1021/jp806725s. PMID 18834097. Bibcode 2008JPCA..11210713O.
- ↑ a b Gunther Seitz; PETER IMMING. Oxocarbons and pseudooxocarbons. Chemical Reviews. 1992, s. 1227–1260. DOI 10.1021/cr00014a004.
- ↑ SCHRÖDER, Detlef; SCHWARZ, Helmut; DUA, Suresh; BLANKSBY, Stephen J.; BOWIE, John H. Mass spectrometric studies of the oxocarbons CnOn (n = 3–6). International Journal of Mass Spectrometry. May 1999, s. 17–25. DOI 10.1016/S1387-3806(98)14208-2. Bibcode 1999IJMSp.188...17S.
- ↑ WYRWAS, Richard B.; JARROLD, Caroline Chick. Production of C6O6-from Oligomerization of CO on Molybdenum Anions. Journal of the American Chemical Society. 2006, s. 13688–13689. DOI 10.1021/ja0643927. PMID 17044687.
- ↑ WEISS, E.; BÜCHNER, W. Zur Kenntnis der sogenannten "Alkalicarbonyle" I Die Kristallstruktur des Kalium-acetylendiolats, KOCCOK. Helvetica Chimica Acta. 1963, s. 1121. DOI 10.1002/hlca.19630460404.
- ↑ EGGERDING, David; WEST, Robert. Synthesis and properties of deltic acid (dihydroxycyclopropenone) and the deltate ion. Journal of the American Chemical Society. 1976, s. 3641. DOI 10.1021/ja00428a043.
- ↑ Eggerding, David; WEST, ROBERT. Synthesis of Dihydroxycyclopropenone (Deltic Acid). Journal of the American Chemical Society. 1975, s. 207–208. DOI 10.1021/ja00834a047.
- ↑ COHEN, Sidney; LACHER, John R.; PARK, Joseph D. Diketocyclobutanediol. Journal of the American Chemical Society. 1959, s. 3480. DOI 10.1021/ja01522a083.
- ↑ Leopold Gmelin (1825), Ueber einige merkwürdige, bei der Darstellung des Kaliums nach der Brunner'schen Methode, erhaltene Substanzen. Poggendorfs Annalen der Physik und Chemie, volume 4, p. 31
- ↑ Heller, Johann Florian (1837), Die Rhodizonsäure, eine aus den Produkten der Kaliumbereitung gewonnene neue Säure, und ihre chemischen Verhältnisse, Justus Liebigs Annalen der Pharmacie, volume 24, issue 1, pp. 1–16
- ↑ Löwig, Carl (1839), Chemie der organischen Verbindungen. F. Schultess, Zürich
- ↑ CHEN, Haiyan; ARMAND, Michel; COURTY, Matthieu; JIANG, Meng; GREY, Clare P.; DOLHEM, Franck; TARASCON, Jean-Marie. Lithium Salt of Tetrahydroxybenzoquinone: Toward the Development of a Sustainable Li-Ion Battery. Journal of the American Chemical Society. 2009, s. 8984–8988. DOI 10.1021/ja9024897. PMID 19476355.
- ↑ West, R. and Niu, J. (1969). Non-benzenoid aromatics. Vol. 1. J. Snyder (ed.). Academic Press New York
- ↑ Schleyer, P. v. R.; NAJAFIAN, K.; KIRAN, B.; JIAO, H. Are Oxocarbon Dianions Aromatic?. The Journal of Organic Chemistry. 2000, s. 426–431. DOI 10.1021/jo991267n. PMID 10813951.
- ↑ P. R. Hammond. 1,4-Benzoquinone Tetracarboxylic Acid Dianhydride, C10O8: A Strong Acceptor. Science. 1963, s. 502. DOI 10.1126/science.142.3591.502. PMID 17748167. Bibcode 1963Sci...142..502H.
- ↑ SAUER, Jürgen; SCHRÖDER, Barbara; WIEMER, Richard. Eine Studie der Diels-Alder-Reaktion, VI. Kinetischer Nachweis des Moleküls C6O6 (Dianhydrid der Äthylentetracarbonsäure). Chemische Berichte. 1967, s. 306–314. DOI 10.1002/cber.19671000135.
- ↑ VERTER, H. S.; DOMINIC, R. A new carbon oxide synthesis of hexahydroxybenzene tris oxalate. Tetrahedron. 1967, s. 3863. DOI 10.1016/S0040-4020(01)97894-9.
- ↑ VERTER, H. S.; POTTER, H.; DOMINIC, R. A new carbon oxide synthesis of tetrahydroxybenzoquinone bisoxalate. Chemical Communications. 1968, s. 973b. DOI 10.1039/C1968000973b.
- ↑ a b NALLAIAH, C. Synthesis of tetrahydroxy-1,4-benzoquinone biscarbonate and hexahydroxybenzene triscarbonate-new organic carbon oxides. Tetrahedron. 1984, s. 4897–4900. DOI 10.1016/S0040-4020(01)91324-9.
- ↑ a b Yves Rubin; CAROLYN B. KNOBLER; FRANCOIS DIEDERICH. Precursors to the cyclo[n]carbons: from 3,4-dialkynyl-3-cyclobutene-1,2-diones and 3,4-dialkynyl-3-cyclobutene-1,2-diols to cyclobutenodehydroannulenes and higher oxides of carbon. Journal of the American Chemical Society. 1990, s. 1607–1617. DOI 10.1021/ja00160a047.
- ↑ Paolo Strazzolini; ALBERTO GAMBI; ANGELO G. GIUMANINI; HRVOJ VANCIK. The reaction between ethanedioyl (oxalyl) dihalides and Ag2C2O4: a route to Staudinger's elusive ethanedioic (oxalic) acid anhydride. Journal of the Chemical Society, Perkin Transactions. 1998, s. 2553–2558. DOI 10.1039/a803430c.
- ↑ HAMURA, Toshiyuki; IBUSUKI, Yousuke; UEKUSA, Hidehiro; MATSUMOTO, Takashi; SIEGEL, Jay S.; BALDRIDGE, Kim K.; SUZUKI, Keisuke. Dodecamethoxy- and Hexaoxotricyclobutabenzene: Synthesis and Characterization. Journal of the American Chemical Society. 2006, s. 10032–10033. DOI 10.1021/ja064063e. PMID 16881630.
- ↑ Holger Butenschön. A new oxocarbon C12O6 via highly strained benzyne intermediates. Angewandte Chemie International Edition in English. 2007, s. 4012–4014. DOI 10.1002/anie.200700926. PMID 17508349.
- ↑ KYBETT, B. D.; JOHNSON, G. K.; BARKER, C. K.; MARGRAVE, J. L. The Heats of Formation and Polymerization of Carbon Suboxide. The Journal of Physical Chemistry. 1965, s. 3603. DOI 10.1021/j100894a060.
- ↑ KATZ, Allen I.; SCHIFERL, David; MILLS, Robert L. New phases and chemical reactions in solid carbon monoxide under pressure. The Journal of Physical Chemistry. 1984, s. 3176. DOI 10.1021/j150659a007.
- ↑ EVANS, W. J.; LIPP, M. J.; YOO, C.-S.; CYNN, H.; HERBERG, J. L.; MAXWELL, R. S.; NICOL, M. F. Pressure-Induced Polymerization of Carbon Monoxide: Disproportionation and Synthesis of an Energetic Lactonic Polymer. Chemistry of Materials. 2006, s. 2520. Dostupné online. DOI 10.1021/cm0524446.
- ↑ HEYMANN, Dieter; WEISMAN, R. Bruce. Fullerene oxides and ozonides. Comptes Rendus Chimie. 2006, s. 1107–1116. DOI 10.1016/j.crci.2006.02.003.
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Oxidy uhlíku na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxidy uhlíku na Wikimedia Commons