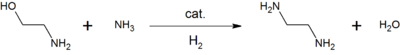Ethanolamin
| Ethanolamin | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 2-aminoethanol |
| Sumární vzorec | C2H7NO |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 141-43-5 |
| EC-no (EINECS/ELINCS/NLP) | 205-483-3 |
| PubChem | 700 |
| ChEBI | 16000 |
| SMILES | C(CO)N |
| InChI | InChI=1/C2H7NO/c3-1-2-4/h4H,1-3H2 |
| Číslo RTECS | KJ5775000 |
| Vlastnosti | |
| Molární hmotnost | 61,083 g/mol |
| Teplota tání | 10,3 °C (283,4 K) |
| Teplota varu | 170 °C (443 K) |
| Hustota | 1,0117 g/cm3 |
| Index lomu | 1,4539 (20 °C)[1] |
| Rozpustnost ve vodě | mísitelný |
| Tlak páry | 64 Pa (20 °C)[2] |
| Bezpečnost | |
| [3] Nebezpečí[3] | |
| H-věty | H302 H312 H314 H332 H335 H412 |
| P-věty | P261 P273 P303+361+353 P305+351+338 |
| Teplota vzplanutí | 85 °C (358 K) |
| Teplota vznícení | 410 °C (683 K) |
| Meze výbušnosti | 5,5 až 17 % |
Některá data mohou pocházet z datové položky. | |
Ethanolamin (též kolamin, zkráceně ETA nebo MEA) je organická sloučenina se vzorcem HOCH2CH2NH2 (C2H7NO). Patří zároveň mezi primární alkoholy i primární aminy. Jedná se o bezbarvou kapalinu s amoniakovým zápachem.[4]
Jeho deriváty mají široký výskyt v přírodě, například lipidové deriváty, ethanolamin je prekurzorem mnoha N-acylethanolaminů, které ovlivňují některé fyziologické procesy u živočichů a rostlin, například klíčení semen, interakce rostlin s patogeny, vývoj chloroplastů a kvetení.[5] S kyselinou arachidonovou vytváří endokanabinoid anandamid.[6]
Ethanolamin patří mezi aminoalkoholy. Mezi deriváty ethanolaminu patří mnohé látky s antihistaminickými účinky, například karbinoxamin, klemastin, dimenhydrinát, difenhydramin a doxylamin.
Výroba
[editovat | editovat zdroj]Ethanolamin se vyrábí reakcí ethylenoxidu s vodným roztokem amoniaku; při této reakci rovněž vznikají diethanolamin a triethanolamin. Množství těchto produktů lze ovlivnit poměrem množství reaktantů.[7]
Biochemické vlastnosti
[editovat | editovat zdroj]V organismech je ethanolamin syntetizován dekarboxylací serinu:[8]
- HOCH2CH(CO2H)NH2 → HOCH2CH2NH2 + CO2
Ethanolamin je druhou nejčastější skupinou tvořící „hlavu“ fosfolipidů, látek tvořících buněčné membrány. Také je součástí molekul jako palmitoylethanolamid, které ovlivňují CB1 receptory.[9]
Použití
[editovat | editovat zdroj]Pro ethanolamin se často používá zkratka MEA, a to za účelem jeho odlišení od diethanolaminu (DEA) a triethanolaminu (TEA). Používá se na výrobu detergentů, emulgátorů, leštidel, léčiv a inhibitorů koroze a také na výrobu dalších látek.[4]
Příkladem je reakce ethanolaminu s amoniakem za vzniku ethylendiaminu, z něhož se dále získává Kyselina ethylendiamintetraoctová používaná jako chelatační činidlo.
Čištění plynů
[editovat | editovat zdroj]Podobně jako ostatní aminy patří i ethanolamin mezi slabé zásady, což se využívá při čištění plynů. Monoethanolaminy mohou velmi účinně z plynů vzniklých spalováním uhlí, methanu či bioplynu účinně odstraňovat oxid uhličitý (CO2). Tento postup se také používá k obnovování vzduchu na palubách ponorek.
MEA ionizuje kyselé látky obsažené v těchto plynech, čímž se jejich molekuly stávají polárními a tak i lépe rozpustnými.
Čisticí roztoky MEA mohou být regenerovány pomocí regeneračních zařízení. Při zahřání MEA uvolňuje rozpuštěné H2S a CO2, čímž opět vzniká čistý roztok.[7][10]
Ostatní použití
[editovat | editovat zdroj]Ve farmacii se MEA obvykle používá na přípravu emulzí nebo tlumivých roztoků. Lze jej využít též v kosmetice jako regulátor pH.[11]
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Ethanolamin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Ethanolamin na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Ethanolaminé na anglické Wikipedii.
- ↑ R. E. Reitmeier; V. Sivertz; H. V. Tartar. Some Properties of Monoethanolamine and its Aqueous Solutions. Journal of the American Chemical Society. 1940, s. 1943–1944.
- ↑ Ethanolamine MSDS [online]. Acros Organics. Dostupné v archivu pořízeném z originálu dne 2011-07-15. (anglicky)
- ↑ a b Ethanolamine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b Matthias Frauenkron; Johann-Peter Melder; Günther Ruider; Roland Rossbacher; Hartmut Höke. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2002. ISBN 3527306730. Kapitola Ethanolamines and Propanolamines.
- ↑ Bruna G. Coutinho; Emily Mevers; Amy L. Schaefer; Dale A. Pelletier; Caroline S. Harwood; Jon Clardy; E. Peter Greenberg. A plant-responsive bacterial-signaling system senses an ethanolamine derivative. Proceedings of the National Academy of Sciences of the United States of America. 25. 9. 2018, s. 9785–9790. Dostupné online. ISSN 0027-8424. PMID 30190434.
- ↑ V. Di Marzo; L. De Petrocellis; N. Sepe; A. Buono. Biosynthesis of anandamide and related acylethanolamides in mouse J774 macrophages and N18 neuroblastoma cells. Biochemical Journal. 15. 6. 1996, s. 977. Dostupné online. PMID 8670178.
- ↑ a b Klaus Weissermel; Hans-Jürgen Arpe; Charlet R. Lindley; Stephen Hawkins. Industrial Organic Chemistry. [s.l.]: Wiley-VCH, 2003. ISBN 3-527-30578-5. Kapitola Chap. 7. Oxidation Products of Ethylene.
- ↑ [cit. 2015-08-09]. Dostupné v archivu pořízeném z originálu dne 2012-08-21. (anglicky)
- ↑ A. Calignano; G. La Rana; D. Piomelli. Antinociceptive activity of the endogenous fatty acid amide, palmitylethanolamide. European Journal of Pharmacology. 2001, s. 191–198. Dostupné online. PMID 11426841.
- ↑ Ethanolamine [online]. Occupational Safety & Health Administration [cit. 2008-05-11]. Dostupné v archivu pořízeném z originálu dne 2013-05-03. (anglicky)
- ↑ F. Carrasco. Industrial Organic Chemistry. [s.l.]: www.imagenpersonal.net, 2009. ISBN 978-84-613-4979-1. Kapitola Ingredientes Cosméticos, s. 306.