Thiolátové komplexy přechodných kovů
Thiolátové komplexy přechodných kovů jsou komplexní sloučeniny obsahující thiolátové ligandy; tyto ligandy jsou „měkkými“ Lewisovými zásadami a nejsilněji se tak navazují na kovy chovající se jako měkké Lewisovy kyseliny. Většina těchto komplexů obsahuje i další ligandy, je ale známa i řada homoleptických, obsahujících pouze thioláty.
Thiolovou funkční skupinu má například aminokyselina cystein, cysteinátové anionty jsou tak součástí mnoha bílkovin i enzymů, kde na sebe navazují kofaktory.[1]


Příprava[editovat | editovat zdroj]
Thiolátové komplexy se obvykle připravují reakcemi jiných komplexů s thioly (RSH), thioláty (RS−), a disulfidy (R2S2). Lze také provést podvojnou záměnu, kdy reaguje thiolát alkalického kovu s halogenidem přechodného kovu za vzniku alkalického halogenidu a thiolátového komplexu:
Terc-butylthiolát lithný s MoCl4 vytváří tetrathiolátovou komplexní sloučeninu:[3]
- MoCl4 + 4 t-BuSLi → Mo(t-BuS)4 + 4 LiCl
Niklocen a ethanthiol vzájemnou reakcí vytvářejí dimerní thiolát, kde jeden cyklopentadienylový ligand slouží jako zásada:
- 2 HSC2H5 + 2 Ni(C5H5)2 → [Ni(SC2H5)(C5H5)]2 + 2 C5H6

Některé thiolátové komplexy mohou být získány deprotonací komplexů thiolů.[4][5]
Redoxní reakce[editovat | editovat zdroj]
Mnohé thiolátové komplexy se připravují redoxními reakcemi. Organické disulfidy oxidují kovy v nízkých oxidačních číslech, například v dikarbonylu titanocenu:
Thioly mohou, za uvolnění vodíku, oxidovat některé kovy:
Tyto reakce pravděpodobně probíhají jako oxidační adice thiolů na Fe0.
Thioly a soli thiolátů působí jako redukční činidla; jimi vyvolané redoxní reakce lze použít k přípravě měďných thiolátů z měďnatých sloučenin:
- 4 HSC6H5 + 2 CuO → 2 Cu(SC6H5) + (C6H5S)2 + 2 H2O
V FeS proteinech se objevují shluky thiolátů odpovídající vzorci [Fe4S4(SR)4]2−. Syntetické analogy těchto thiolátů se dají připravit spojením redoxních reakcí s podvojnými záměnami:[6]
Struktura[editovat | editovat zdroj]
Dvojvaznost síry způsobuje, že vazebné úhly mají velikosti blízko 90°; podobné bývají i úhly M-S-C u thiolátů. Protože mají zaplněné p-orbitaly o vhodných symetriích, tak patří mezi pí-donorové ligandy; tato vlastnost způsobuje stabilizaci čtyřmocného železa v enzymu P450.

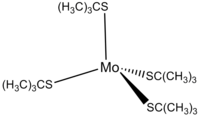
Mo(t-BuS)4, tmavě červený diamagnetický komplex citlivý na vzduch a vlhkost, má Mo centrum se čtyřmi atomy síry vytvářejícími narušenou tetraedrickou geometrii, se symetrií D2.[3]
Reakce[editovat | editovat zdroj]
Thioláty jsou zásaditými ligandy, jejich konjugované kyseliny mají pKa's od 6,5 (thiofenol) po 10,5 (butanthiol). Z tohoto důvodu thiolátové ligandy často tvoří můstky mezi atomy kovů. Příkladem takového komplexu je dimer trikarbonylu methylthioželeza (Fe2(SCH3)2(CO)6). Thioláty jsou, obzvláště jako nemůstkové, náchylné k reakcím s elektrofily, jako například kyselinami a alkylačními či oxidačními činidly.

Výskyt a použití[editovat | editovat zdroj]
Thiolátové funkční skupiny jsou častými složkami metaloenzymů. Obsaženy jsou také v FeS proteinech, Cu proteinech, a v alkoholdehydrogenáze. Obvykle tyto thiolátové ligandy pochází z cysteinových zbytků. Molybdoproteiny obsahují thioláty v podobě cysteinylových skupin a/nebo molybdopterinů.[8]

Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Transition metal thiolate complex na anglické Wikipedii.
- ↑ COTTON, F. Albert; WILKINSON, Geoffrey. Advanced inorganic chemistry. 6th ed. vyd. New York: J. Wiley, 1999. Dostupné online. ISBN 978-0-471-19957-1.
- ↑ Axel Kern; Christian Näther; Felix Studt; Felix Tuczek. Application of a Universal Force Field to Mixed Fe/Mo−S/Se Cubane and Heterocubane Clusters. 1. Substitution of Sulfur by Selenium in the Series [Fe4X4(YCH3)4]2-; X = S/Se and Y = S/Se. Inorganic Chemistry. 2004, s. 5003-5010. DOI 10.1021/ic030347d. PMID 15285677.
- ↑ a b Sei Otsuka; Masato Kamata; Ken Hirotsu; Taiichi Higuchi. A Novel Molybdenum Thiolato Compound, Tetrakis(tert-butylthiolato)molybdenum(IV). Preparation and Crystal and Molecular Structure. Journal of the American Chemical Society. 1981, s. 3011-3014. DOI 10.1021/ja00401a017.
- ↑ Philip G. Jessop; Robert H. Morris. Hydrogen/Deuterium exchange reactions of an iridium dithiol complex. Inorganic Chemistry. 1993, s. 2236-2237. DOI 10.1021/ic00063a006.
- ↑ M. Heller; W. S. Sheldrick. Copper(I) Coordination Polymers with Alkanedithiol and -dinitrile Bridging Ligands. Zeitschrift für anorganische und allgemeine Chemie. 2004, s. 1869-1874. DOI 10.1002/zaac.200400165.
- ↑ S. C. Lee; W. Lo; R. H. Holm. Developments in the Biomimetic Chemistry of Cubane-Type and Higher Nuclearity Iron–Sulfur Clusters. Chemical Reviews. 2014, s. 3759-3600. DOI 10.1021/cr4004067. PMID 24410527.
- ↑ T. Nguyen; A. Panda; M. M. Olmstead; A. F. Richards; M. Stender; M. Brynda; P. P. Power. Synthesis and Characterization of Quasi-Two-Coordinate Transition Metal Dithiolates M(SAr)2 (M = Cr, Mn, Fe, Co, Ni, Zn; Ar = C6H3-2,6(C6H2-2,4,6-Pri3)2). Journal of the American Chemical Society. 2005, s. 8545-8552. DOI 10.1021/ja042958q. PMID 15941290.
- ↑ S. J. Lippard, J. M. Berg „Principles of Bioinorganic Chemistry University“ Science Books: Mill Valley, CA; 1994 ISBN 0-935702-73-3