Cystein
| Cystein | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | (2R)-2-amino-3-sulfanylpropanová kyselina |
| Triviální název | cystein |
| Ostatní názvy | α-amino-β-merkaptopropanová kyselina, thioserin |
| Sumární vzorec | C3H7NO2S |
| Identifikace | |
| Registrační číslo CAS | 52-90-4 |
| Vlastnosti | |
| Molární hmotnost | 121,16 g/mol |
| Teplota tání | 240 °C |
| Disociační konstanta pKa | (I) 8,14 ; (II) 10,34 |
| Bezpečnost | |
| [1] Varování[1] | |
Některá data mohou pocházet z datové položky. | |
Cystein (značka Cys nebo C) je v přírodě se vyskytující neesenciální aminokyselina, která ve své molekule obsahuje thiolovou skupinu -SH. Podílí se významně na struktuře bílkovin (tvoří disulfidové můstky), udržení přiměřeného oxidačně-redukčního prostředí v buňce a účastní se mnoha metabolických drah, a to především v syntéze glutathionu, taurinu a metabolismu methioninu. Látky odvozené od cysteinu jsou důležité pro svou antioxidativní povahu, čímž pomáhají bojovat proti chorobám vyvolaným oxidačním stresem, mimo jiné s chronickými záněty.[2] Vyskytuje se ve většině bílkovin, jeho průměrné zastoupení je ale asi jen 2 %.[3] Thiolová skupina má vysokou afinitu k těžkým kovům. Toho se využívá v proteinech k vazbě kovových ligandů, které slouží například v enzymech, ale i k odstranění těžkých kovů, jako je rtuť, olovo nebo kadmium z těla, i když při akutních otravách se používá jeho derivát N-acetylcystein.[4]
Historie
[editovat | editovat zdroj]
Výzkum cysteinu úzce souvisí s cystinem, což jsou dvě kovalentně propojené molekuly cysteinu. Cystin byl nalezen Wollastonem už roku 1810 v močových kamenech (cystolitech, odtud název) ale v proteinech (v kravím rohu) až Mörnerem roku 1899. Studium komplikoval fakt, že navzdory tomu, že se dlouho vědělo, že proteiny obsahují síru, používané chemické metody srážely sloučeniny síry, mezi nimi cystin a cystein. Relativně dlouho trvalo, než bylo prokázáno, že cystein z močových kamenů a proteinů jsou identické látky a výzkum z tehdejšího pohledu zpomalovalo, že se cystin při izolacích rozpadal na jinou látku – cystein.[5]
Později bylo zjištěno, že do proteinů se jako první vnáší cystein a cystin vzniká až následně z něj, jak zjistil Vincent du Vigneaud při studiu inzulinu, vazopresinu a oxytocinu, což jsou peptidické hormony, které ve své struktuře obsahují kovalentně propojené molekuly cysteinu (tedy cystin), které vytváří tzv. disulfidický můstek, za což dostal roku 1955 Nobelovu cenu.[6] Za studium toho, jak souvisí vznikání a zanikání disulfidických můstků se skládáním proteinů, byla udělena Nobelova cena (1972) také Christianu Anfinsenovi.[7]
Funkce a vlastnosti
[editovat | editovat zdroj]Chemické vlastnosti
[editovat | editovat zdroj]Cystein je spolu s methioninem zástupcem proteinogenní aminokyseliny obsahující síru, ta se v cysteinu vyskytuje jako velmi reaktivní thiolová skupina. Postranní skupina volného cysteinu má pK kolem 8,5 – takže by měla být v neutrálním prostředí buňky protonovaná a nereaktivní; v proteinech se ale běžně pohybuje mezi 5—10 a může klesnout až k 3,5.[8] V alkalickém prostředí je velmi reaktivní a funguje jako nukleofil, je proto často využíván enzymy v aktivních místech, při oxidaci dvou cysteinových zbytků vzniká disulfidická vazba, čímž dochází k propojení mezi polypeptidy s takto propojenými cysteiny. Cystein je dobře rozpustný ve vodě a vytváří vodíkové můstky, je tedy tradičně uváděn jako nenabitá, polární aminokyselina,[3] ve skutečnosti má vlastnosti hydrofóbních aminokyselin, dokáže například stabilizovat tvorbu micel[9] a v proteinech se vyskytuje především ve shlucích hydrofobních aminokyselin.[10] Vysvětlení tohoto neobvyklého chování je zřejmě to, že i když je cystein v mnoha ohledech podobný serinu, tak -SH skupina cysteinu nedokáže vytvářet vodíkové můstky s vodou, na rozdíl od -OH skupiny serinu.[10]
Význam v proteinech
[editovat | editovat zdroj]Role cysteinu v proteinech u eukaryot závisí na tom, kde se protein nachází. V neredukujícím prostředí, tedy mimo buňku a některých organelách, především drsném endoplasmatickém retikulu, vytváří páry cysteinů kovalentně propojené disulfidické můstky, které dramaticky určují prostorové uspořádání proteinů a velmi zvyšují jejich odolnost proti proteázám a celkovou stabilitu proteinu, proto jsou ve velkém zastoupeny například v keratinu. V redukujícím prostředí cytosolu se disulfidické můstky vytváří jen velmi vzácně a role cysteinu je hlavně v koordinační vazbě kovových ligandů, jako je zinek v případě alkoholdehydrogenáza a strukturního motivu nazývaného zinkový prst, mědi v plastocyaninu , železa v cytochromu P450 a NiFe hydrogenázách mnohých dalších.
Cystein využívají cysteinové proteázy (papain, kaspázy) ve svých aktivních místech a metalloproteázy jím do svého aktivního místa vážou kovy.[11]
Antioxidant
[editovat | editovat zdroj]Protože je cystein antioxidant, má spolu se svými sloučeninami významnou roli v udržování oxidačně-redukčního systému. V redukujícím prostředí buněčného cytosolu je cystein schopný navázat nebezpečné oxidující látky, jako jsou kyslíkové radikály, peroxid vodíku, organické hydroperoxidy, peroxynitrity a mnohé další, čímž je redukuje a naopak se sám stává reaktivním. Přes nestabilní meziprodukt následně vzniká nereaktivní, oxidovaná forma cysteinu, nejčastěji disulfidový můstek vznikající s blízkým cysteinem. Pokud se v blízkosti oxidovaného cysteinu nenachází jiný cystein, bývá využíváno navázání jiného cysteinu, nejčastěji cysteinu v glutathionu.[8]
Významným antioxidantem založeným na cysteinu je glutathion, což je neobvyklý tripeptid obsahující glutamin, cystein a glycin. Díky svému cysteinu je schopen redukovat nebezpečné oxidanty, čímž se sám oxiduje a následně vzniká glutathion disulfid, tedy dva glutathiony propojené disulfidickou vazbou. Jeho další funkce je redukovat disulfidické vazby ostatních molekul, mimo jiné disulfidických můstků mezi proteinem a jiným glutathionem, čímž opět vzniká glutathion disulfid. Glutathion disulfid je následně redukován na dvě molekuly glutathionu glutathion reduktázou a může znovu působit jako antioxidant. Antioxidační schopnost glutathionu je umožněná tím, že se glutathion vyskytuje v buňkách ve vysoké koncentraci. Protože glutathion není při trávení dobře vstřebáván, je nutné jej v buňce vytvářet z prekurzorů, a v tomto případě je limitujícím krokem dostupnost cysteinu, který je v proteinech relativně vzácný.[8]
Posttranslační modifikace
[editovat | editovat zdroj]
Cystein je cílem celé řady posttranslačních modifikací, mezi nejdůležitější patří především kovalentní propojení dvou cysteinů vytvářející tzv. disulfidický můstek, schematicky je možné disulfidický můstek znázornit jako R–S–S–R, kde „R“ jsou bílkovinné zbytky.
Velmi reaktivní thiolová skupina umožňuje napojení celé řady ostatních skupin, například palmitoylaci, tedy připojení zbytku palmitové kyseliny nebo v případě C-terminálních cysteinů připojení farnesylu nebo geranyl-geranylu (isopenoidy). Cystein může být cílem připojení ubiquitinu, i když tato modifikace mnohem častěji probíhá na lyzinu. Při vzniku železosirných center v FeS proteinech slouží cystein jako dárce síry: pomocí enzymu jménem cystein desulfuráza je z cysteinu odštěpena síra a přesunuta do vznikajícího železosirného centra, namísto cysteinu zůstane v proteinu alanin.[12]
V některých proteinech se vyskytuje nestandardní aminokyselina selenocystein, ta ale nevzniká modifikací cysteinu, ale je odvozena od serinu.
Metabolismus
[editovat | editovat zdroj]Zdroje v potravě
[editovat | editovat zdroj]Cystein je pro člověka podmínečně esenciální aminokyselina. Jednak vyžaduje zdroj methioninu, který dodává atom síry, a bez něj nemůže být syntetizován. Dále syntéza cysteinu neprobíhá při některých jaderných poruchách a pravděpodobně u novorozenců.[2] Nedostatek aminokyseliny cysteinu navíc vede ke zvýšené spotřebě esenciálního methioninu (který je v metabolismu mimo jiné nezbytný jako zdroj methylových skupin), který následně může tělu chybět.[13]
Nachází se ve všech potravinách bohatých na proteiny, významně je zastoupen např. v syrovátce, cibuli, česneku, brokolici a ovsu.[zdroj?]
Biosyntéza
[editovat | editovat zdroj]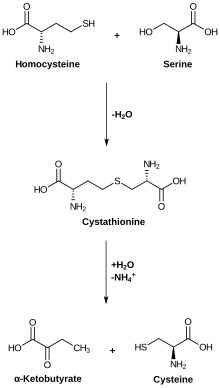
Pro lidi je cystein semiesenciální aminokyselina. Lidské tělo si jej dokáže vytvářet, ale pouze tehdy, pokud má dostatečný přísun aminokyseliny methioninu. Pro biosyntézu cysteinu jsou nezbytné dvě aminokyseliny: serin dodávající uhlíkovou kostru a methionin, který je zdrojem síry. Při tomto procesu je methionin nejdříve zpracován na S-adenosylmethionin a následně přeměněn na homocystein. Enzym cystathionin beta-syntáza poté propojí homocystein a serin za vzniku cystathioninu, ze kterého enzym cystathionin gama-lyáza odštěpí amoniak, alfa-ketoglutarát a cystein.[14]
Bakterie a rostliny jsou schopny pro syntézu cysteinu využívat anorganickou síru v podobě sulfátu (SO42−). Ten je nejdříve ve dvou krocích "aktivován" za vzniku 3'-fosfoadenosin 5'-fosfosulfátu a následně redukován do podoby sulfitu (SO32−). Sulfit je pak ve dvou krocích připojen na serin za vzniku cysteinu.[14]
Odbourávání
[editovat | editovat zdroj]Zpracování cysteinu je klíčový krok pro celkový metabolismus dalších pro organismus významných sloučenin síry: methioninu a homocysteinu. Prakticky všechny molekuly síry z těchto proteinů určené pro vyloučení jsou přeneseny na serin procesem transsulfurace, což vytváří cystein.
Samotná degradace cysteinu může probíhat několika cestami s použitím různých enzymů v závislosti na buněčném typu, ve kterém degradace probíhá, a některým podmínkách, především dostupnosti aminokyselin a některých sloučenin obsahujících síru (např. S-adenosylmethionin). Tyto degradační cesty je možné rozdělit na dva hlavní způsoby degradace – oxidační nebo neoxidační cestu. Cystein může být oxidován a následně přeměněn buď na taurin, nebo na síranový anion, které mohou být vyloučeny močí. Případně se z něj může v několika krocích nezahrnujících oxidaci oddělit toxický sulfan nebo sulfid, které musí být detoxifikovány oxidací v mitochondriích. Při nedostatku cysteinu a dalších sloučenin síry jsou preferovány neoxidační cesty, při nadbytku cesty oxidační.[15]
Reference
[editovat | editovat zdroj]- ↑ a b L-Cysteine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ a b MCPHERSON, RA.; HARDY, G. Clinical and nutritional benefits of cysteine-enriched protein supplements.. Curr Opin Clin Nutr Metab Care. Nov 2011, roč. 14, čís. 6, s. 562–8. DOI 10.1097/MCO.0b013e32834c1780. PMID 21986479.
- ↑ a b WHITFORD, David. Proteins: Structure and Function. 1.. vyd. [s.l.]: Wiley, 2005. 542 s. Dostupné online. ISBN 978-0471498940. Kapitola 2. Amino acids: the building blocks of proteins, s. 44–45. (anglicky)
- ↑ FLORA, SJ.; PACHAURI, V. Chelation in metal intoxication.. Int J Environ Res Public Health. Jul 2010, roč. 7, čís. 7, s. 2745–88. DOI 10.3390/ijerph7072745. PMID 20717537.
- ↑ a b VICKERY, Hubert. The History of the Discovery of the Amino Acids. Chemical reviews. 1931, roč. 9, čís. 2, s. 169–318.
- ↑ Award Ceremony Speech - du Vigneaud [online]. nobelprize.org [cit. 2015-04-03]. Dostupné online. (anglicky)
- ↑ Award Ceremony Speech - Anfinsen [online]. nobelprice.org [cit. 2015-04-03]. Dostupné online. (anglicky)
- ↑ a b c KLOMSIRI, C.; KARPLUS, PA.; POOLE, LB. Cysteine-based redox switches in enzymes.. Antioxid Redox Signal. Mar 2011, roč. 14, čís. 6, s. 1065–77. DOI 10.1089/ars.2010.3376. PMID 20799881.
- ↑ HEITMANN, P. A model for sulfhydryl groups in proteins. Hydrophobic interactions of the cystein side chain in micelles.. Eur J Biochem. Jan 1968, roč. 3, čís. 3, s. 346–50. PMID 5650851.
- ↑ a b NAGANO, N.; OTA, M.; NISHIKAWA, K. Strong hydrophobic nature of cysteine residues in proteins.. FEBS Lett. Sep 1999, roč. 458, čís. 1, s. 69–71. PMID 10518936.
- ↑ BARNES, Michael R. Bioinformatics for Geneticists: A Bioinformatics Primer for the Analysis of Genetic Data. [s.l.]: Wiley, 2007. 576 s. ISBN 978-0470026205. Kapitola 14: Amino Acid Properties and Consequences of Substitutions, s. en. (anglicky)
- ↑ LILL, R.; MÜHLENHOFF, U. Iron-sulfur protein biogenesis in eukaryotes: components and mechanisms.. Annu Rev Cell Dev Biol. 2006, roč. 22, s. 457–86. DOI 10.1146/annurev.cellbio.22.010305.104538. PMID 16824008.
- ↑ FUKAGAWA, NK. Sparing of methionine requirements: evaluation of human data takes sulfur amino acids beyond protein.. J Nutr. Jun 2006, roč. 136, čís. 6 Suppl, s. 1676S-1681S. PMID 16702339.
- ↑ a b NELSON, David L.; COX, Michael M. Lehninger Principles of Biochemistry. [s.l.]: W.H. Freeman, 2013. Dostupné online. ISBN 978-1429234146. Kapitola 22: Biosynthesis of amino acids, nucleotides, and related molecules. (anglicky)
- ↑ STIPANUK, MH.; UEKI, I. Dealing with methionine/homocysteine sulfur: cysteine metabolism to taurine and inorganic sulfur.. J Inherit Metab Dis. Feb 2011, roč. 34, čís. 1, s. 17–32. DOI 10.1007/s10545-009-9006-9. PMID 20162368.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu L-cystein na Wikimedia Commons
Obrázky, zvuky či videa k tématu L-cystein na Wikimedia Commons

