Fosfonáty
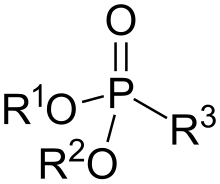
Fosfonáty a fosfonové kyseliny jsou v organické chemii sloučeniny, v jejichž molekulách se nachází skupiny C−PO(OH)2 nebo C−PO(OR)2 (R může být alkyl nebo aryl). Fosfonové kyseliny se obvykle vyrábějí jako soli a jedná se o netěkavé kapaliny málo rozpustné v organických rozpouštědlech, ovšem rozpustné ve vodě a alkoholech. K fosfonátům patří mnoho významných látek, jako je herbicid glyfosát. Bisfosfonáty, molekuly se dvěma fosfonátovými skupinami, jsou součástí některých léčiv proti osteoporóze.[1] V lékařské chemii se fosfonátové skupiny používají jako náhrady fosfátových skupin v léčivech; příkladem je tenofovir, používaný při léčbě HIV.
Vlastnosti[editovat | editovat zdroj]
Molekuly fosfonátů mají tvar tetradedru s atomem fosforu ve středu. Strukturou se podobají kyselině fosfonové, z níž se také často připravují.[2]

Fosfonátové soli vznikají z fosfonových kyselin, které jsou dvojsytné:
- RPO(OH)2 + NaOH → H2O + RPO(OH)(ONa) (monosodný fosfonát)
- RPO(OH)(ONa) + NaOH → H2O + RPO(ONa)2 (disodný fosfonát)
Fosfonátové estery lze připravit reakcí fosfonové kyseliny s příslušným alkoholem.
Příprava[editovat | editovat zdroj]
Existuje několik způsobů přípravy fosfonových kyselin a jejich solí.
Z kyseliny fosfonové[editovat | editovat zdroj]
Nejběžnější metody přípravy fosfonátů vycházejí z kyseliny fosfonové (H3PO3), která je stabilnějším tautomerem kyseliny fosforité, přičemž se využívá reaktivita vazby P-H.[1][2]
Fosfonové kyseliny lze alkylovat Mannichovou reakcí za vzniku aminoalkylovaných fosfonátů, které se dají použít jako komplexační činidla; příkladem může být průmyslová výroba kyseliny nitrilotris(methylen)fosfonové:
- NH3 + 3 H3PO3 + 3 CH2O → (CH2PO3H2)3 + 3 H2O
Další možností je alkylace deriváty kyseliny akrylové za tvorby karboxylovaných fosfonových kyselin; tato reakce je variantou Michaelovy adice:
- CH2=CHCO2R + 3 H3PO3 → (HO)2P(O)CH2CH2CO2R
Při Hiraově reakci reagují dialkylfosfity (které lze považovat za diestery kyseliny fosfonové, s obecným vzorcem (O=PH(OR)2)) s arylhalogenidy za přítomnosti palladiového katalyzátoru, přičemž vznikají fosfonáty.
Michaelisova–Arbuzovova reakce[editovat | editovat zdroj]
Estery fosfonových kyselin se připravují Michaelisovou–Arbuzovovou reakcí. Příkladem je přeměna trimethylfosfitu na dimethylmethylfosfonát za katalýzy jodmethanem:
- P(OMe)3 → MePO(OMe)2
Tyto estery je možné hydrolyzovat na kyseliny
- CH3PO(OMe)2 + H2O → CH3PO(OH)2 + 2 CH3OH
Při Michaelisově–Beckerově reakci je nejprve deprotonován hydrogenfosfonátový diester a vzniklý anion se poté alkyluje.
Z chloridu fosforitého[editovat | editovat zdroj]
Vinylfosfonové kyseliny se dají připravit reakcí chloridu fosforitého s acetaldehydem:
- PCl3 + CH3CHO → CH3CH(O−)PCl +
3
Takto vzniklý adukt reaguje s kyselinou octovou:
- CH3CH(O−)PCl +
3 + 2 CH3CO2H → CH3CH(Cl)PO(OH)2 + 2 CH3COCl
Připravený chlorid se nakonec dechloruje za vzniku konečného produktu:
- CH3CH(Cl)PO(OH)2 → CH2=CHPO(OH)2 + HCl
V Kinnearově–Perrenově reakci se tvoří alkyldifosfonylové estery a chloridy za přítomnosti chloridu hlinitého. Meziprodukty jsou alkyltrichlorfosfoniové soli.[1]
- PCl3 + RCl + AlCl3 → RPCl +
3 + AlCl -
4
Produkt této reakce (RPCl +
3 ) je možné hydrolyzovat na alkylfosfoniumdichlorid RP(=O)Cl2.
Reakce[editovat | editovat zdroj]
Hydrolýza[editovat | editovat zdroj]
Fosfonátové estery podléhají hydrolýze, a to v kyselém i zásaditém prostředí.
- O=PC(OR)2 + 2 H2O → O=PC(OH)2 + 2 ROH
Rozštěpení vazby P-C je obtížnější, ale v agresivnějších podmínkách jej lze provést.
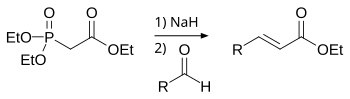
Hornerova–Wadsworthova–Emmonsova reakce[editovat | editovat zdroj]
Při Hornerově–Wadsworthově–Emmonsově reakci se dialkylfosfonáty deprotonují za vzniku stabilních karboaniontů, které reagují s aldehydy na E-alkeny za současného odštěpení dialkylfosfátu.[3]
Rozdělení podle struktury[editovat | editovat zdroj]
Bisfosfonáty[editovat | editovat zdroj]

Sloučeniny, které mají na stejný atom uhlíku navázány dvě fosfonátové skupiny, se nazývají bisfosfonáty. Poprvé je připravili v roce 1897 Adolf von Baeyer a Fritz Hofmann; v současnosti se bisfosfonátové skupiny využívají jako součásti molekul některých léčiv na osteoporózu, jako je kyselina etidronová, jež se připravuje reakcí kyseliny fosforečné s acetanhydridem:[1]
- 2 H3PO3 + (CH3CO)2O → CH3C(OH)(PO3H2)2 + CH3CO2H
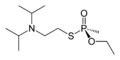
Thiofosfonáty[editovat | editovat zdroj]
-
kyselina O-ethyl-methylfosfonothiová (thionová forma)
-
VX (thiolová forma)
Thiofosfonátová skupina je od fosfonátové formálně odvozena náhradou kyslíkového atomu atomem síry. Je častou složkou pesticidů a nervových jedů. Substituované thiofosfonáty mohou mít dva strukturní izomery - pokud je na fosfor dvojnou vazbou napojen atom síry, jedná se o thionovou formu, pokud je takto napojen kyslík, jde o formu thiolovou; podobná vlastnost existuje například u thiokarboxylových kyselin a organothiofosfátů.
Fosfonamidáty[editovat | editovat zdroj]
Fosfonamidátovou skupinu lze od fosfonátové odvodit nahrazením kyslíkového atomu dusíkovým. Jde o poměrně málo používanou funkční skupinu, která se nachází například v molekule tabunu.
Výskyt[editovat | editovat zdroj]
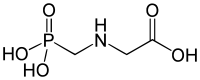

V roce 1959 byla u některých rostlin a živočichů objevena kyselina 2-aminoethylfosfonová, která je přírodním fosfonátem, vyskytujícím se v buněčných membránách. Fosfonáty se vyskytují například v bakteriích, houbách, měkkýších a hmyzu. V půdě byly přírodní fosfonáty poprvé nalezeny v roce 1980. Jejich biologické funkce dosud nejsou dobře známy. Bisfosfonáty a polyfosfonáty se v přírodě nevyskytují.
Je známo několik přírodních fosfonátů s antibiotickými vlastnostmi,[4] například fosfomycin, používaný při léčbě infekcí močových cest, nebo fosmidomycin (inhibitor isoprenylsyntázy), SF-2312 (inhibitor enolázy)[5] a látky, jejichž účinek není přesně znám, jako například alahopcin. Tato antibiotika jsou účinná proti velkému počtu bakterií, protože ty často mají přenašeče glycerol-3-fosfátu a glukóza-6-fosfátu, jejich funkci lze narušit fosfonáty. Kmeny bakterií odolné vůči fosfomycinu mívají mutace, které tyto přenašeče deaktivují.
Použití[editovat | editovat zdroj]
Chelatační činidla[editovat | editovat zdroj]
Gerold Schwarzenbach v roce 1949 zjistil, že fosfonáty jsou účinná chelatační činidla. Schopnost fosfonátu vázat kovy je možné vylepšit připojení aminové skupiny (−NH2) na molekulu fosfonátu za vzniku −NH2−C−PO(OH)2; takovými látkami jsou například NTMP, EDTMP a DTPMP, které jsou strukturními analogy aminopolykarboxylátů, jako je kyselina ethylendiamintetraoctová. Stabilita komplexů se zvyšuje s počtem fosfonátových skupin.
Fosfonáty na sebe mohou navázat dvojmocné a trojmocné ionty , čehož lze využít k odstraňování tvrdosti vody; tímto způsobem lze i vylepšit katalytické vlastnosti iontů. Z těchto důvodů se fosfonáty využívají k zamezení tvorby vodního kamene v průmyslu nebo v přístrojích provádějících reverzní osmózu. Tam, kde se voda používá jako chladivo, také zabraňují korozi. Při výrobě papíru stabilizují peroxidy (používané k bělení) tím, že zachytávají ionty kovů, které by mohly způsobovat rozklad peroxidů. Jako chelatační činidla a k omezení tvorby vodního kamene se používají i v tenzidech.
Lékařství[editovat | editovat zdroj]
V lékařství se monofosfonáty a bisfosfonáty používají jako inhibitory enzymů, které katalyzují reakce fosfátů a bisfosfátů, jako jsou například enzymy podílející se na syntéze cholesterolu.[6]
Fosfonátové analogy nukleotidů, například tenofovir, cidofovir a adefovir se používají jako antivirotika mimo jiné při léčbě HIV nebo hepatitidy B.
Toxicita[editovat | editovat zdroj]
Fosfonáty nejsou příliš toxické pro vodní organismy. Hodnoty LC50 při 48hodinovém vystavení těmto látkám se pohybují mezi 0,1 a 1,1 mmol/l.
Příklady[editovat | editovat zdroj]
- Tenofovir alafenamid - proléčivo tenofoviru, používaného při léčbě HIV
- Kyselina aminomethylfosfonová - produkt rozkladu glyfosátu
- Kyselina vinylfosfonová - surovina na výrobu polymerů
- Dimethylmethylfosfonát - jeden z nejjednodušších fosfonátových diesterů
- Kyselina etidronová (1-hydroxyethyliden-1,1-difosfonová) - používá se jako tenzid při úpravě vody, výrobě kosmetických přípravků a léčiv
- Kyselina ethylendiamintetra(methylenfosfonová), chelatační činidlo
- Kyselina tetramethylendiamintetra(methylenfosfonová), chelatační činidlo
- Kyselina hexamethylendiamintetra(methylenfosfonová), chelatační činidlo
- Kyselina diethylentriaminpenta(methylenfosfonová), chelatační činidlo
- Glyfosát, herbicid
Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Fosfonáty na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fosfonáty na Wikimedia Commons
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Phosphonate na anglické Wikipedii.
- ↑ a b c d Svara, J.; Weferling, N.; Hofmann, T. "Phosphorus Compounds, Organic," in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2008. DOI:10.1002/14356007.a19_545.pub2.
- ↑ a b Modern Phosphonate Chemistry by Philippe Savignac and Bogdan Iorga, CRC Press, Boca Raton, FL, 2003. ISBN 0-8493-1099-7
- ↑ John Boutagy; Richard Thomas. Olefin synthesis with organic phosphonate carbanions. Chemical Reviews. 1974, s. 87–99.
- ↑ K. S. Ju; J. R. Doroghazi; W. W. Metcalf. Genomics-enabled discovery of phosphonate natural products and their biosynthetic pathways. J. Ind. Microbiol. Biotechnol.. 2014, s. 345–356. PMID 24271089.
- ↑ SF2312 is a natural phosphonate inhibitor of enolase. Nature Chemical Biology. 2016, s. 1053–1058. PMID 27723749.
- ↑ A. J. Wiemer; R. J. Hohl; D. F. Wiemer. The intermediate enzymes of isoprenoid metabolism as anticancer targets. Anti-Cancer Agents in Medicinal Chemistry. 2009, s. 526–542. PMID 19519294.