Aminopolykarboxylové kyseliny



Aminopolykarboxylové kyseliny jsou organické sloučeniny, které mají v molekule alespoň jeden atom dusíku navázán přes uhlíkové atomy na dvě nebo více karboxylových skupin. Anionty těchto kyselin mohou s kovy tvořit velmi stabilní komplexy, díky čemuž nacházejí využití v chemii i lékařství.[1]
Struktura[editovat | editovat zdroj]
Aminopolykarboxylové kyseliny lze odvodit od glycinu (H2NCH2CO2H), který má aminovou skupinu od karboxylové oddělenou jednou methylenovou skupinou. Pokud dojde k deprotonaci karboxylové skupiny, tak se ze vzniklého aniontu stane bidentátní ligand, který se může na kovové centrum navázat přes aminový atom dusíku a jeden z kyslíkových atomů karboxylátu a vytvářet tak komplexy s ionty kovů.[2]
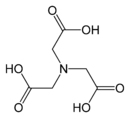
Nahrazením atomu vodíku v aminové skupině glycinu skupinou –CH2COOH vznikne kyselina iminodioctová, která je tridentátním ligandem. Dalším takovým nahrazením vznikne kyselina nitrilotrioctová, což už je tetradentátní ligand.[3] Tyto sloučeniny se řadí mezi polyaminokarboxylové kyseliny. Podobné ligandy lze odvodit i od jiných aminokyselin než je glycin, například od kyseliny asparagové.

Vyšší dentacity lze dosáhnout spojením několika glycinátových nebo iminodioctanových jednotek. Kyselina ethylendiamintetraoctová má v molekule dvě iminodioctanové jednotky s dusíkovými atomy spojenými dvěma methylenovými skupinami, kyselina diethylentriaminpentaoctová má dva řetězce CH2CH2 spojující tři atomy dusíku a je oktadentátní. TTHA[1] má v molekule deset atomů, které mohou sloužit jako donory.
Použití[editovat | editovat zdroj]
Schopnost aminopolykarboxylových kyselin vytvářet cheláty lze upravovat změnou skupin navázaných na atomny dusíku, čímž se zvýší selektivita vzhledem ke kationtům jednoho určitého kovu. Počet uhlíkových atomů mezi dusíkem a karboxylovou skupinou lze rovněž měnit a na tyto uhlíky je možné navázat různé substituenty a tím získat velký počet různých produktů. Látka Fura-2 má dva druhy funkčních skupin a je velmi selektivní k vápníku (oproti hořčíku) a její substituent způsobuje, že po navázání vápníku vykazuje fluorescenci, což se využívá ke stanovení obsahu vápníku uvnitř buněk. V mnoha druzích rostlin se vyskytuje aminopolykarboxylová kyselina nikotianamin, která zde funguje jako přenašeč železa.[4]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Aminopolycarboxylic acid na anglické Wikipedii.
- ↑ a b c d e f G. Anderegg; F. Arnaud-Neu; R. Delgado; J. Felcman; K. Popov. Critical evaluation of stability constants of metal complexes of complexones for biomedical and environmental applications* (IUPAC Technical Report). Pure and Applied Chemistry. 2005, s. 1445–1495. DOI 10.1351/pac200577081445. pdf
- ↑ G. Schwarzenbach. Der Chelateffekt. Helvetica Chimica Acta. 1952, s. 2344–2359. DOI 10.1002/hlca.19520350721.
- ↑ a b G. Anderegg. Critical survey of stability constants of NTA complexes. Pure and Applied Chemistry. 1982, s. 2693–2758. DOI 10.1351/pac198254122693 http://media.iupac.org/publications/pac/1982/pdf/5412x2693.pdf pdf].
- ↑ Metal movement within the plant: contribution of nicotianamine and yellow stripe 1-like transporters. Annals of Botany. 2009, s. 1–11. DOI 10.1093/aob/mcn207. PMID 18977764.