Kyselina ftalová
| Kyselina ftalová | |
|---|---|
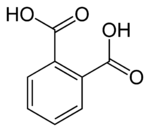 Strukturní vzorec | |
 Prostorový model | |
| Obecné | |
| Systematický název | kyselina benzen-1,2-dikarboxylová |
| Triviální název | kyselina ftalová |
| Anglický název | phthalic acid |
| Funkční vzorec | C6H4(COOH)2 |
| Sumární vzorec | C8H6O4 |
| Vzhled | bezbarvá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 88-99-3 |
| Vlastnosti | |
| Molární hmotnost | 166,14 g/mol |
| Teplota tání | 210 °C |
| Hustota | 1,593 g/cm³ |
| Disociační konstanta pKa | pKa1=2,943 pKa2 = 5,432 |
| Rozpustnost ve vodě | málo rozpustná |
| Rozpustnost v nepolárních rozpouštědlech | rozpustná |
| Bezpečnost | |
| [1] Varování[1] | |
Některá data mohou pocházet z datové položky. | |
Kyselina ftalová je aromatická dikarboxylová kyselina. Racionální vzorec je C6H4(COOH)2 a jedná se o bílou krystalickou látku. Patří do skupiny ftalových kyselin a jejími izomery jsou kyseliny isoftalová a tereftalová.
Využití
[editovat | editovat zdroj]Kyselina ftalová se v chemickém průmyslu používá k výrobě barviv (např. fenolftaleinu a naftoftaleinu), změkčovadel na bázi ftalátů (nejčastěji DEHP – bis(2-ethylhexyl) ftalát), sacharinu a k výrobě syntetických voňavek.
Historie
[editovat | editovat zdroj]Kyselina ftalová byla poprvé vyrobena v roce 1836 francouzským chemikem Augustem Laurenem oxidací naftalenu, který ji ve víře, že se jedná o kyselinu odvozenou od naftalenu, pojmenoval kyselina naftalenová. První, kdo objevil strukturu ftalové kyseliny byl Švýcar Jean Charles Galissard de Marignac, který kyselině ftalové dal její správné jméno.
Chemie
[editovat | editovat zdroj]Při průmyslové výrobě se vychází z o-xylenu nebo naftalenu. Ty jsou v plynné fázi oxidovány vzdušným kyslíkem na katalyzátoru na bázi oxidu vanadičného za vzniku ftalanhydridu. Kyselina se z ftalanhydridu získává hydrolýzou, většinou se ale při dalších reakcích vychází přímo z ftalanhydridu, který je mimo jiné dostupnější.
Kyselina ftalová jako dvojsytná kyselina poskytuje dvě řady solí. Hydrogenftalát draselný se používá jako primární standard při acidobazických titracích.
Jako jedna z mála odštěpuje kyselina ftalová při dostatečném zahřátí vodu a vzniká její anhydrid – ftalanhydrid, který za této teploty sublimuje. Vznik anhydridu je umožněn vznikem výhodného pětičlenného kruhu. Kyselina i její anhydrid se používají k výrobě barevných indikátorů (fenolftalein).
Reference
[editovat | editovat zdroj]- ↑ a b Phthalic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu kyselina ftalová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina ftalová na Wikimedia Commons

