Triethylhliník
| Triethylhliník | |
|---|---|
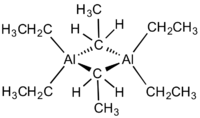 Strukturní vzorec triethylhliníku | |
 Krystalová struktura triethylhliníku | |
| Obecné | |
| Systematický název | Triethylhliník |
| Anglický název | Triethylaluminium |
| Německý název | Triethylaluminium |
| Sumární vzorec | C12H30Al2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 97-93-8 |
| PubChem | 16682930 |
| SMILES | CC[Al](CC)CC |
| InChI | InChI=1S/3C2H5.Al/c3*1-2;/h3*1H2,2H3; |
| Vlastnosti | |
| Molární hmotnost | 228,335 g/mol |
| Teplota tání | −46 °C |
| Teplota varu | 128–130 °C při 50 mmHg |
| Hustota | 0,83240 g/cm3 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| NFPA 704 |  4
3
3
W
|
Některá data mohou pocházet z datové položky. | |
Triethylhliník (TEA, též TEAL) je organokovová sloučenina hliníku. Tato těkavá, bezbarvá kapalina je silně pyroforická, při styku se vzduchem se okamžitě vznítí. Běžně se skladuje v nádobách z korozivzdorné oceli jako čistá kapalina nebo jako roztok v uhlovodíkových rozpouštědlech, například hexanu, heptanu nebo toluenu. Používá se hlavně jako kokatalyzátor při průmyslové výrobě polyethylenu a alkoholů se středně dlouhými řetězci.
Struktura a vazby
[editovat | editovat zdroj]
Přestože se sloučenina nazývá triethylhliník, má dimerní strukturu se vzorcem Al2Et6, kde Et je ethyl, CH2CH3. Jeden pár ethylových skupin tvoří můstky a čtyři jsou koncovými ligandy. Dvě můstková uhlíková centra mají koordinační číslo 5. Vazby připomínají ty, které známe z diboranu, jsou to třícenterní, dvouelektronové vazby. Podobně jako trimethylhliník, i triethylhliník je strukturálně nestálý a koncové ethylové skupiny se rychle vyměňují s můstkovými. Při vyšších teplotách se dimer rozpadá na monomerní AlEt3.[2]
Syntéza a reakce
[editovat | editovat zdroj]TEA lze připravovat různými cestami. Objev efektivní cesty byl technologicky významný. Vícekrokový proces lze shrnout do následující reakce:[3]
- 2 Al + 3 H2 + 6 C2H4 → Al2Et6
Díky této účinné syntéze je triethylhliník jednou z nejdostupnějších organohlinitých sloučenin.
Lze ho ale také generovat z triethyl-dialuminium-trichloridu (Al2Cl3Et3), který se získá působením chlorethanu na hliníkový prášek. Redukcí triethyl-dialuminium-trichloridu alkalickým kovem, například sodíkem, se získá TEA:[4]
- 3 Al2Cl3Et3 + 9 Na → 2 Al2Et6 + 2 Al + 9 NaCl
Reaktivita
[editovat | editovat zdroj]Vazby Al-C jsou polarizovány, takže lze triethylhliník snadno protonovat za uvolnění ethanu:[5]
- Al2Et6 + 6 HX → 2 Al2X6 + 6 EtH
V této reakci lze použít i slabé kyseliny, například koncové acetyleny nebo alkoholy.
Můstky mezi páry hliníkových center jsou poměrně slabé a lze je štěpit zásadami za vzniku aduktů se vzorcem AlEt3L:
- Al2Et6 + 2 L → 2 LAlEt3
Použití
[editovat | editovat zdroj]TEA se průmyslově využívá jako surovina pro výrobu mastných alkoholů, které se převádějí na tenzidy. Prvním krokem je oligomerizace ethylenu, která poskytuje směs trialkylhlinitých sloučenin (zjednodušeně zde znázorněny jako oktylové skupiny):[3]
- Al2(C2H5)6 + 18 C2H4 → Al2(C8H17)6
Následně se tyto sloučeniny oxidují na alkoxidy hliníku a ty jsou potom hydrolyzovány:
- Al2(C8H17)6 + 3/2 O2 → Al2(OC8H17)6
- Al2(OC8H17)6 + 3/2 H2O → 6 C8H17OH + 2 "Al(OH)3"
Reagens v organické a organokovové chemii
[editovat | editovat zdroj]TEA má použití jako prekurzor dalších organohlinitých sloučenin, například diethylaluminium-kyanidu:[6]
- 0.5 Al2Et6 + HCN → 1/n [Et2AlCN]n + C2H6
Pyroforické činidlo
[editovat | editovat zdroj]TEA se zapaluje při styku se vzduchem a rozkládá se či vzněcuje také při kontaktu s vodou nebo oxidačními činidly.[7] Je jednou z několika tak těkavých látek, že je lze zapálit i kapalným kyslíkem. Snadná vznětlivost je zvláště vhodná pro použití jako iniciátor (zapalovač) raketového paliva. TEA lze i přímo použít jako raketové palivo, nicméně nikdy takto v praxi používán nebyl.[8] Nosná raketa Falcon 9 společnosti SpaceX používá směs triethylhliník-triethylboritan jako zapalovač prvního raketového stupně.[9]
Triethylhliník zahuštěný polyisobutylenem se používá jako zápalná zbraň, pyroforická alternativa k napalmu, například v raketách M74 pro raketomet M202A1.[10] V této aplikace je znám jako TPA (thickened pyrotechnic agent či thickened pyrophoric agent, tedy česky zahuštěné pyrotechnické činidlo, resp. zahuštěné pyroforické činidlo). Obvyklé množství zahušťovadla je 6 %. Lze ho snížit až na 1 %, přidávají-li se další ředidla. Pro zvýšení bezpečnosti lze použít například n-hexan; zajišťuje nepyroforické chování do odpaření ředidla, kdy vznikne „ohnivá koule“ jak z par TEA, tak hexanu.[11]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Triethylaluminium na anglické Wikipedii.
- ↑ a b Triethylaluminum. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Gábor Vass, György Tarczay, Gábor Magyarfalvi, András Bödi, and László Szepes “HeI Photoelectron Spectroscopy of Trialkylaluminum and Dialkylaluminum Hydride Compounds and Their Oligomers” Organometallics, 2002, volume 21, pp. 2751–2757. DOI:10.1021/om010994h
- ↑ a b Michael J. Krause, Frank Orlandi, Alfred T. Saurage, Joseph R. Zietz Jr. “Aluminum Compounds, Organic” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a01_543
- ↑ Krause, M. J; Orlandi, F; Saurage, A T.; Zietz, J R, "Organic Aluminum Compounds" Wiley-Science 2002.
- ↑ Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim. ISBN 3-527-29390-6
- ↑ WATARU NAGATA AND YOSHIOKA MITSURU. Diethylaluminum Cyanides. Org. Synth.. 1988. Dostupné online.; Coll. Vol.. S. 436.
- ↑ TEA Material Safety Data Sheet Archivováno 14. 11. 2006 na Wayback Machine., accessed March 27, 2007
- ↑ Clark, John D., Ignition! An Informal History of Liquid Rocket Propellants, Rutgers University Press, New Brunswick, NJ, 1972
- ↑ Mission Status Center, June 2, 2010, 1905 GMT, SpaceflightNow, accessed 2010-06-02, Quotation: "The flanges will link the rocket with ground storage tanks containing liquid oxygen, kerosene fuel, helium, gaserous nitrogen and the first stage ignitor source called triethylaluminum-triethylborane, better known as TEA-TAB."
- ↑ M202A1 Flame Assault Shoulder Weapon (Flash), inetres.com
- ↑ Encyclopedia of Explosives and Related Items, Vol.8, US Army
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Triethylhliník na Wikimedia Commons
Obrázky, zvuky či videa k tématu Triethylhliník na Wikimedia Commons


