Acetaldehyd
| Acetaldehyd | |
|---|---|
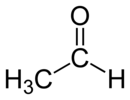 Strukturní vzorec | |
 Prostorový model | |
| Obecné | |
| Systematický název | ethanal |
| Triviální název | acetaldehyd |
| Funkční vzorec | CH3CHO |
| Sumární vzorec | C2H4O |
| Vzhled | bezbarvá kapalina se štiplavou ovocnou vůní |
| Identifikace | |
| Registrační číslo CAS | 75-07-0 |
| EC-no (EINECS/ELINCS/NLP) | 200-836-8 |
| Indexové číslo | 605-003-00-6 |
| Vlastnosti | |
| Molární hmotnost | 44,05 g/mol |
| Teplota tání | −124 °C |
| Teplota varu | 20,2 °C |
| Hustota | 0,788 g/cm³ |
| Rozpustnost ve vodě | neomezeně mísitelný |
| Struktura | |
| Dipólový moment | 2,7 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H224 H319 H335 H341 H350 |
| P-věty | P210 P233 P261 P264 P271 P281 P305+351+308 P403+235 [2] |
| R-věty | R12 R36/37 R40 |
| S-věty | (S2) S16 S33 S36/37 |
| Teplota vzplanutí | −39 °C |
| Teplota vznícení | 185 °C |
Některá data mohou pocházet z datové položky. | |
Acetaldehyd, nazývaný též ethanal či aldehyd kyseliny octové, je bezbarvá těkavá hořlavá kapalina štiplavého zápachu.
Výskyt v přírodě
[editovat | editovat zdroj]Acetaldehyd se v přírodě vyskytuje ve zralém ovoci, kávě apod. Je produkován rostlinami jako součást jejich metabolismu. V lidském organismu vzniká při metabolizování ethanolu alkoholdehydrogenázou. Stav po vystřízlivění (kocovina) je zčásti způsoben acetaldehydem.
Příprava
[editovat | editovat zdroj]Acetaldehyd se připravuje oxidací ethanolu kyslíkem nebo oxidem měďnatým:
- 2 C2H5OH + O2 → 2 CH3CHO + 2 H2O
- C2H5OH + CuO → CH3CHO + Cu + H2O
Může se také připravovat hydratací acetylenu (ethynu):
- HC≡CH + H2O → CH2=CHOH → CH3CHO
Meziproduktem je vinylalkohol, na jehož molekule dochází k přesmyku na acetaldehyd. Touto reakcí se vyrábí acetaldehyd průmyslově.
Lze jej připravit také oxidací ethanolu manganistanem draselným v kyselém prostředí.
Chemické reakce
[editovat | editovat zdroj]Acetaldehyd má ve své molekule obsaženou dvojnou vazbu, proto u tohoto aldehydu mohou probíhat adiční reakce, při kterých dochází k rozpadu této násobné vazby. Příkladem je reakce acetaldehydu s ethanolem:
- CH3CHO + C2H5OH → CH3-CH(OH)-O-C2H5
- CH3CHO + 2C2H5OH → CH3-CH(OC2H5)2 + H2O
V prvním případě vzniká ethylacetal ethanalu, ve druhém diethylacetal ethanalu.
Acetaldehyd také reaguje s amoniakem za vzniku sloučeniny, která ve své molekule obsahuje aminovou a hydroxylovou skupinu; její redukcí pak vzniká primární alkohol.
Cyklické polymery aldehydu
[editovat | editovat zdroj]Působením kyseliny sírové na acetaldehyd vzniká kapalný cyklický trimer nazývaný paraldehyd. Působením plynného chlorovodíku na roztok acetaldehydu vzniká cyklický tetramer metaldehyd, jehož vzorec je (CH3CHO)4.
Použití
[editovat | editovat zdroj]Acetaldehyd je důležitým meziproduktem, používá se při výrobě hydroxidu sodného (NaOH) a kyseliny octové, která vzniká jeho oxidací. Polymer paraldehyd se používá jako uspávací prostředek, metaldehyd se používá jako moluskocid.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]- ↑ a b Acetaldehyde. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Acetaldehyde [online]. PubChem [cit. 2020-11-27]. Dostupné online.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu acetaldehyd na Wikimedia Commons
Obrázky, zvuky či videa k tématu acetaldehyd na Wikimedia Commons  Slovníkové heslo acetaldehyd ve Wikislovníku
Slovníkové heslo acetaldehyd ve Wikislovníku



