Thiofen
| Thiofen | |
|---|---|
 Struktura thiofenu – vzorce a model | |
| Obecné | |
| Systematický název | thiofen |
| Ostatní názvy | thiofuran, thiol[pozn. 1] |
| Anglický název | Thiophene |
| Německý název | Thiophen |
| Sumární vzorec | C4H4S |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 110-02-1 |
| PubChem | 8030 |
| SMILES | c1ccsc1 |
| InChI | InChI=1S/C4H4S/c1-2-4-5-3-1/h1-4H |
| Číslo RTECS | XM7350000 |
| Vlastnosti | |
| Molární hmotnost | 84,14 g/mol |
| Teplota tání | −38 °C |
| Teplota varu | 84 °C |
| Hustota | 1,051 g/cm³ |
| Dynamický viskozitní koeficient | 0,871 2 cP (0,2 °C) 0,643 2 cP (22,4 °C) |
| Index lomu | 1,528 7 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Thiofen je heterocyklická organická sloučenina se sumárním vzorcem C4H4S. Jeho molekula sestává z planárního pětičlenného kruhu. Jedná se o aromatickou sloučeninu, což se projevuje výraznými substitučními reakcemi. Příbuznými sloučeninami jsou benzothiofen a dibenzothiofen, obsahující thiofenový kruh spojený s jedním, resp. dvěma benzenovými kruhy. Mezi sloučeniny analogické thiofenu patří furan (C4H4O) a pyrrol (C4H4NH).
Izolace a výskyt
Thiofen byl objeven jako kontaminant v benzenu.[2] Bylo zjištěno, že isatin tvoří modré barvivo, pokud je smíchán s kyselinou sírovou a surovým benzenem. Tvorba modrého indofeninu byla delší dobu považována za reakci samotného benzenu. Viktor Meyer byl schopen izolovat thiofen jako skutečnou látku, která je zodpovědná za tuto reakci. [3]
Thiofen a především jeho deriváty se vyskytují v ropě, kde jsou někdy až v koncentracích 1 - 3 %. Obsah thiofenu v oleji a uhlí se odstraňuje procesem hydroodsíření. Thiofeny procházejí hydrogenolýzou, během které vznikají uhlovodíky a sirovodíky. Samotný thiofen je tedy přeměněn na butan a sulfan (H2S).
Problematičtější v ropě jsou benzothiofen a dibenzothiofen, kteří jsou zápachem podobní naftalenu.
Na Marsu
Deriváty thiofenu byly detekovány na úrovni nanomolů v 3,5 miliardy let starých marťanských půdních sedimentech roverem Curiosity v kráteru Gale na Marsu mezi lety 2012 až 2017. Tímto thiofen představuje důležitý milník pro misi Mars Science Laboratory při dlouhém hledání organické hmoty na rudé planetě. [4]
Zahřívání vzorků lakustrinních jílovců při vysoké teplotě (500 °C až 820 °C) umožnilo analýzu uvolňovaných plynů plynovou chromatografií a hmotnostní spektrometrií a detekci aromatických a alifatických molekul včetně několika sloučenin thiofenu. Přítomnost vazeb uhlík - síra v makromolekulách mohla přispět k zachování organické hmoty ve velmi dlouhodobém období.
Odhaduje se, že zhruba 5 % analyzovaných organických molekul obsahuje organickou síru. Původ a způsob vzniku těchto molekul jsou stále neznámé. Jejich objev předložil otázku thiofenických sloučenin jako možné starověké biosignatury, vědecký důkaz o minulém životě, na Marsu. Podrobné analýzy izotopů uhlíku budou nezbytné k určení, zda jsou takové organické molekuly obohaceny o lehký uhlík, jako jsou obvykle živé mikroorganismy na Zemi.
Syntéza a výroba
Vzhledem k vysoké stabilitě lze thiofeny získávat mnoha reakcemi mezi zdroji síry a uhlovodíky, zvláště nenasycenými – například reakcí acetylenu a elementární síry, což byla první syntéza thiofenu, kterou použil Viktor Meyer v roce jeho objevu. Thiofeny se klasicky připravují reakcí 1,4-diketonů, diesterů nebo dikarboxylátů se sulfidizačními činidly, například P4S10. Této reakci se říká Paalova-Knorrova syntéza. Speciální thiofeny lze syntetizovat podobně za použití Lawessonova činidla jako sulfidizačního činidla nebo prostřednictvím Gewaldovy reakce, která zahrnuje kondenzaci dvou esterů za přítomnosti elementární síry. Další metodou je Volhardova–Erdmannova cyklizace.
Ročně se ve světě vyrobí cca 2 000 tun thiofenu. Při výrobě se používá reakce, kdy je zdroj síry v plynné fázi – typicky reakce sirouhlíku a butanolu. Tato činidla přicházejí do styku s oxidovým katalyzátorem při teplotě 500–550 °C.[5]
Vlastnosti a struktura
Thiofen je v pokojové teplotě bezbarvá kapalina s mírně příjemným zápachem, který připomíná benzen. Je vysoce reaktivní, což je základem pro separaci thiofenu od benzenu, který je obtížné oddělit destilací kvůli podobným bodům varu. Thiofen tvoří azeotrop, stejně jako benzen. Molekula thiofenu je planární.
Reaktivita
Thiofen je považován za aromatický, ale jeho aromaticita je dle teoretických výpočtů nižší než u benzenu. Elektronové páry na síře jsou významně delokalizovány v pí elektronovém systému. V důsledku své aromaticity thiofen nevykazuje vlastnosti pozorované u konvenčních sulfidů, například atom síry odolává alkylaci a oxidaci.
Oxidace
Oxidace thiofenu může být dobrá pro metabolickou aktivaci různých léčiv, které již obsahují thiofen. Je to například kyselina tienilová a protinádorové léčivo OSI-930.
Oxidace derivátů thiofenu peroxidem vodíku je katalyzována methyltrioxorheniem. Tato sloučenina reaguje a peroxidem vodíku za vzniku peroxidů rhenia, z nichž každý přenáší atom kyslíku na atom síry thiofenu a jeho derivátů. Úplná oxidace na sulfon probíhá pomocí jeho sulfoxidového meziproduktu.[6]
Odsíření thiofenu niklem
Odsíření thiofenu houbovitým niklem poskytuje butan. Ve spojení s jednoduchou 2,5-difunkcionalizací thiofenu poskytuje odsíření cestu k 1,4-disubstituovaným butanům.

Polymerace
Polymer vytvořený spojením thiofenu přes jeho 2 a 5 polohy se nazývá polythiofen. Polymerace se provádí oxidací pomocí elektrochemických metod (elektropolymerace) nebo za pomocí elektronových činidel.
Polythiofen sám o sobě má špatné zpracovatelské vlastnosti, což vede k tomu, že je málo zkoumán. Užitečnější jsou polymery odvozené z thiofenů substituovaných na pozicích 3 a 4, jako je například ethylendioxythiofen. Polythiofeny se při částečné oxidaci stávají elektricky vodivými, což znamená, že získávají některé z charakteristik, které jsou typicky pozorované v kovech.
Deriváty thiofenu
-
Thieno[3,2-b]thiofen
-
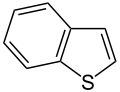
Benzothiofen
Použití
Thiofeny jsou důležité heterocyklické sloučeniny, které jsou používány jako stavební jednotky v mnoha léčivech a agrochemikáliích. Jsou také používány jako látky pro snížení pravděpodobnosti koroze kovů.
Poznámky
Reference
V tomto článku byl použit překlad textu z článku Thiophene na anglické Wikipedii.
- ↑ a b Thiophene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ MEYER, Victor. Ueber den Begleiter des Benzols im Steinkohlentheer. Berichte der deutschen chemischen Gesellschaft. 1883-01, roč. 16, čís. 1, s. 1465–1478. Dostupné online [cit. 2022-02-12]. ISSN 0365-9496. DOI 10.1002/cber.188301601324. (anglicky)
- ↑ SUMPTER, Ward C. The Chemistry of Isatin.. Chemical Reviews. 1944-06-01, roč. 34, čís. 3, s. 393–434. Dostupné online [cit. 2022-02-12]. ISSN 0009-2665. DOI 10.1021/cr60109a003. (anglicky)
- ↑ VOOSEN, Paul. NASA rover hits organic pay dirt on Mars. Science. 2018-06-07. Dostupné online [cit. 2022-02-12]. ISSN 0036-8075. DOI 10.1126/science.aau3992.
- ↑ Jonathan Swanston “Thiophene” in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006.
- ↑ BROWN, Kylie N.; ESPENSON, James H. Stepwise Oxidation of Thiophene and Its Derivatives by Hydrogen Peroxide Catalyzed by Methyltrioxorhenium(VII). Inorganic Chemistry. 1996-01-01, roč. 35, čís. 25, s. 7211–7216. Dostupné online [cit. 2022-02-12]. ISSN 0020-1669. DOI 10.1021/ic960607+.
Externí odkazy
 Obrázky, zvuky či videa k tématu Thiofen na Wikimedia Commons
Obrázky, zvuky či videa k tématu Thiofen na Wikimedia Commons - International Chemical Safety Card 1190





![Thieno[3,2-b]thiofen](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cf/Thienothiophene251-41-2.png/120px-Thienothiophene251-41-2.png)