Mesitylen
| Mesitylen | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1,3,5-trimethylbenzen |
| Sumární vzorec | C9H12 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 108-67-8 |
| EC-no (EINECS/ELINCS/NLP) | 203-604-4 |
| PubChem | 7947 |
| ChEBI | 34833 |
| SMILES | CC1=CC(=CC(=C1)C)C |
| InChI | InChI=1S/C9H12/c1-7-4-8(2)6-9(3)5-7/h4-6H,1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 120,19 g/mol |
| Teplota tání | −44,7 °C (228,4 K)[1] |
| Teplota varu | 164,7 °C (437,8 K)[1] |
| Hustota | 0,86 g/cm3[1] |
| Rozpustnost ve vodě | 0,004 82 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu a ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu a diethyletheru[1] |
| Tlak páry | 248 Pa (20 °C) 331 Pa (25 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H226 H335 H411[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P271 P273 P280 P303+361+353 P304+340 P319 P370+378 P391 P403+233 P403+235 P405 P501[1] |
| Teplota vzplanutí | 50 °C (323 K)[1] |
Některá data mohou pocházet z datové položky. | |
Mesitylen, systematickým názvem 1,3,5-trimethylbenzen, je organická sloučenina odvozená od benzenu navázáním tří methylových skupin na kruh symetricky. Jedná se o izomer 1,2,4-trimethylbenzenu (pseudokumenu) a 1,2,3-trimethylbenzenu (hemimelitenu); všechny tyto sloučeniny mají vzorec C6H3(CH3)3, často zkracovaný na C6H3Me3.
Mesitylen je bezbarvá kapalina. Nachází se v uhelném dehtu. Používá se na výrobu dalších sloučenin. Je od něj odvozena mesitylová skupina (zkráceně Mes), C6H2Me3, která je součástí mnoha dalších sloučenin.[2]
Příprava a výroba
[editovat | editovat zdroj]Mesitylen se vyrábí transalkylací xylenu na pevném kyselém katalyzátoru:[2]
- 2 C6H4(CH3)2 ⇌ C6H3(CH3)3 + C6H5CH3
- C6H4(CH3)2 + CH3OH → C6H3(CH3)3 + H2O
I když je to nepraktické, tak jej lze získat také trimerizací propynu, také vyžadující kyselý katalyzátor, kde vzniká směs 1,3,5- a 1,2,4-trimethylbenzenu.
Mesitylen rovněž vzniká trimerizací acetonu aldolovou kondenzací za přítomnosti kyseliny sírové.[3]
Reakce
[editovat | editovat zdroj]Oxidací mesitylenu kyselinou dusičnou vzniká kyselina trimesinová, C6H3(COOH)3. Za přítomnosti oxidu manganičitého, který je slabším oxidačním činidlem, se vytváří 3,5-dimethylbenzaldehyd. Kyselinou trifluorperoctovou se mesitylen oxiduje na mesitol (2,4,6-trimethylfenol).[4]
Snadno probíhá také bromace, jejímž produktem je mesitylbromid:[5]
- (CH3)3C6H3 + Br2 → (CH3)3C6H2Br + HBr
Mesitylen může sloužit jako ligand v organomkovové chemii, například v organomolybdenovém komplexu [(η6-C6H3Me3)Mo(CO)3][6], který může být připraven z hexakarbonylu molybdenu.
Použití
[editovat | editovat zdroj]Mesitylen se převážně používá na výrobu 2,4,6-trimethylanilinu, sloužícího jako prekurzor barviv. Tato látka vzniká selektivní mononitrací mesitylenu, při níž nedochází k oxidaci methylových skupin.[7]
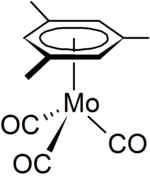
Mesitylen se používá také jako laboratorní rozpouštědlo.
Tři aromatické atomy vodíku u mesitylenu vykazují stejné chemické posuny a v protonové NMR se tak objevuje jediný signál kolem 6,8 ppm; obdobně devět methylových protonů poskytuje jediný signál o chemickém posunu 2,3 ppm. Díky těmto vlastnostem se mesitylen někdy používá jako standard ve vzorcích pro NMR obsahujících aromatické protony.[8]
Oxidací mesitylenu nebo kondenzací kyseliny pyrohroznové s vodným roztokem hydroxidu barnatého vzniká kyselina uvitová.[9]
Gattermannovu reakci lze zjednodušit nahrazením HCN/AlCl3 kyanidem zinečnatým (Zn(CN)2).[10]
Zn(CN)2 je silně toxický, jde ovšem o pevnou látku, takže se s ním zachází snadněji než s plynným kyanovodíkem (HCN).[11]
Zn(CN)2 reaguje s HCl za vývinu HCN jako reaktantu a ZnCl2, sloužícího jako katalyzátor v podobě Lewisovy kyseliny. Zn(CN)2 se používá například na přípravu mesitaldehydu z mesitylenu.[12]
Historie
[editovat | editovat zdroj]Mesitylen poprvé připravil irský chemik Robert Kane zahříváním acetonu s koncentrovanou kyselinou sírovou.[13] Označení vzniklé látky jako „mesitylenu“ vychází z názvu „mesit“, který použil Karl Reichenbach pro aceton,[14] přičemž Kane předpokládal, že získal dehydratovaný mesit, přeměněný na alken.[15] Kaneovo určení složení produktu se ovšem ukázalo jako nesprávné. Správný empirický vzorec nalezl August Wilhelm von Hofmann roku 1849.[16] V roce 1866 zjistil Adolf von Baeyer, že struktura mesitylenu odpovídá 1,3,5-trimethylbenzenu;[17] ovšem důkaz této struktury zajistil až v roce 1874 Albert Ladenburg.[18]
Mesitylová skupina
[editovat | editovat zdroj]Skupina (CH3)3C6H2- se nazývá mesityl (zkráceně symbol: Mes). Sloučeniny s touto skupinou, například tetramesityldiželezo, se obvykle připravují z Grignardova činidla (CH3)3C6H2MgBr.[19]
V důsledku silných sterických efektů se mesitylové skupiny používají k blokování skupin při asymetrické katalýze, kde se tím zlepšuje diastereo- nebo enantioselektivita, a v organokovové chemii, kde stabilizuje nízká oxidační nebo koordinační čísla. Ještě účinnější mohou být analogy s většími sterickými efekty, jako 2,6-diisopropylfenyl (Dipp), Tripp ((iPr)3C6H2, Is) a supermesityl ((tBu)3C6H2, Mes*).
V životním prostředí
[editovat | editovat zdroj]Mesitylen je jednou z hlavních těkavých organických sloučenin vznikajících při spalování. Účastní se tvorby aerosolů a přízemního ozonu.
Odkazy
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Mesitylen na Wikimedia Commons
Obrázky, zvuky či videa k tématu Mesitylen na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Mesitylene na anglické Wikipedii.
- ↑ a b c d e f g h i j k l https://pubchem.ncbi.nlm.nih.gov/compound/7947
- ↑ a b Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke “Hydrocarbons” in Ullmann's Encyclopedia of Industrial Chemistry 2002 Wiley-VCH, Weinheim. DOI:10.1002/14356007.a13_227
- ↑ W. M. Cumming. Systematic organic chemistry (3E). New York, USA: D. Van Nostrand, 1937. Dostupné online. S. 57.
- ↑ Richard D. Chambers. Fluorine in Organic Chemistry. [s.l.]: CRC Press, 2004. ISBN 9780849317903. Kapitola Functional Compounds Containing Oxygen, Sulphur or Nitrogen and their Derivatives, s. 242–243.
- ↑ Lee Irvin Smith. Bromomesitylene. Organic Syntheses. 1931, s. 24. DOI 10.15227/orgsyn.011.0024.
- ↑ Girolami, G. S.; Rauchfuss, T. B. and Angelici, R. J., Synthesis and Technique in Inorganic Chemistry, University Science Books: Mill Valley, CA, 1999. ISBN 0-93570248-2
- ↑ Gerald Booth. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: Wiley-VCH, 2007. ISBN 978-3527306732. DOI 10.1002/14356007.a17_411. Kapitola Nitro Compounds, Aromatic.
- ↑ Mesitylene (1,3,5-Trimethyl Benzene [online]. Dostupné online.
- ↑ Definition of uvitic acid [online]. [cit. 2016-10-31]. Dostupné online.
- ↑ R. Adams; I. Levine. Simplification of the Gattermann Synthesis of Hydroxy Aldehydes. Journal of the American Chemical Society. 1923, s. 2373–2377. DOI 10.1021/ja01663a020.
- ↑ Roger Adams. Organic Reactions, Volume 9. [s.l.]: John Wiley & Sons, 1957. ISBN 9780471007265. DOI 10.1002/0471264180.or009.02. S. 38, 53-54.
- ↑ FUSON, R. C.; HORNING, E. C.; ROWLAND, S. P.; WARD, M. L. Mesitaldehyde. Org. Synth.. 1955. DOI 10.15227/orgsyn.023.0057.; Coll. Vol.. S. 549.
- ↑ Robert Kane (1839) "On a series of combinations derived from pyroacetic spirit [acetone]" Transactions of the Royal Irish Academy, vol. 18, pages 99–125
- ↑ C. Reichenbach (1834) "Ueber Mesit (Essiggeist) und Holzgeist", Annalen der Pharmacie, vol. 10, no. 3, pages 298–314.
- ↑ Henry E. Roscoe, A Treatise on Chemistry (New York, New York: D. Appleton and Co., 1889), vol. III, page 102, footnote 2
- ↑ A.W. Hofmann (1849) "On the composition of mesitilole [mesitylene], and some of its derivatives", The Quarterly Journal of the Chemical Society of London, vol. 2, pages 104–115.)
- ↑ Adolf von Baeyer (1866) "Ueber die Condensationsproducte des Acetons", Annalen der Chemie und Pharmacie, vol. 140, pages 297–306
- ↑ Albert Ladenburg (1874) "Ueber das Mesitylen" (On mesitylene), Berichte der deutschen chemischen Gesellschaft, vol. 7, pages 1133–1137. DOI: 10.1002/cber.18740070261
- ↑ Lee Irvin Smith. Isoodurene. Organic Syntheses. 1931, s. 66. DOI 10.15227/orgsyn.011.0066.



