Buchwaldova–Hartwigova aminace
Buchwaldova–Hartwigova aminace je organická reakce používaná k tvorbě vazeb uhlík-dusík reakcí arylhalogenidů s aminy za katalýzy palladiem.[1] Takové reakce poprvé popsali v roce 1983 Stephen Buchwald a John F. Hartwig. Buchwaldova–Hartwigova aminace překonává nedostatky jiných metod, jako je nukleofilní substituce, protože při ní lze použít více různých substrátů i funkčních skupin.[2] Její rozvoj umožnil snadnější přípravu arylaminů oproti dosavadním postupům (nukleofilní aromatické substituci nebo Goldbergové reakci).
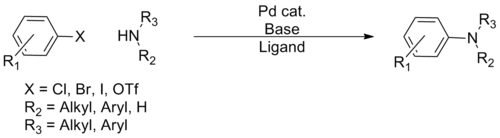
Bylo vytvořeno několik „generací“ katalytických systémů pro Buchwaldovu–Hartwigovu aminaci, přičemž každá nová umožnila využití většího rozsahu reaktantů i zmírnění reakčních podmínek, díky čemuž může každý amin reagovat s téměř všemi arylovými deriváty. Vzhledem k častému výskytu vazeb C-N v molekulách léčiv a přírodních látek má tato reakce v organické syntéze značné využití.
Historie[editovat | editovat zdroj]
První palladiem katalyzovaná reakce vytvářející vazbu C-N byla popsána roku 1983; šlo o reakci určitých arylbromidů s N,N-diethylamino-tributylcínem za přítomnosti 1 molárního procenta PdCl2[P(o-tolyl)3]2. Bylo vyzkoušeno několik arylbromidů, ovšem jen při použití elektronově neutrálních a stericky nenarušovaných bylo dosaženo dobrých výtěžností.[3]

V roce 1984 popsali Dale L. Boger a James S. Panek vznik vazby C–N za přítomnosti stechiometrického množství tetrakis(trifenylfosfin)palladia v reakci, která byla součástí syntézy lavendamycinu. Pokusy o opakování této reakce byly neúspěšné.[4]

V roce 1994 zveřejnil John F. Hartwig studii zaměřenou na sloučeniny palladia, které použil Migita, a zjistil, že aktivním katalyzátorem je d10 komplex Pd[P(o-tolyl)3]2, rovněž navrhl katalytický cyklus, jehož součástí je oxidační adice arylbromidu.[5]
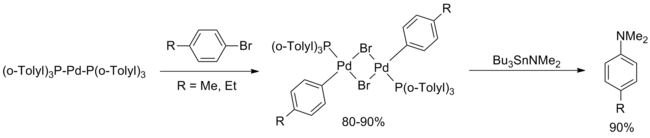
Ve stejném roce Stephen Buchwald zveřejnil rozšíření Migitova výzkumu, v němž uvedl dvě významná vylepšení. První z nich byla transaminační reakce Bu3SnNEt2 následovaná odstraněním těkavého diethylaminu pomocí argonu, což umožnilo použití většího počtu primárních i sekundárních, acyklických i cyklických, aminů. Druhá spočívala v menších změnách při použití arenů s vysokými či nízkými elektronovými hustotami (vyšší teploty, delší reakční doba); nebyly ovšem použity ortho-substituované areny.[6]

Roku 1995 se ukázalo, že tyto reakce lze provádět pomocí volných aminů za přítomnosti terc-butoxidu sodného nebo bis(trimethylsilyl)amidu lithného jako zásady, která umožnila spojování molekul organocínové sloučeniny s aminy. I když tak bylo dosaženo vyšší rychlosti reakce, tak bylo možné použít téměř výhradně jen sekundární aminy, protože docházelo k beta-hydridové eliminaci bromarenů.[7][8]

Tyto studie vedly k vývinu první generace Buchwaldových–Hartwigových katalytických systémů. Později byly objeveny fosfinové ligandy, které umožnily použití širšího spektra aminů i arylových skupin, jako jsou aryljodidy, arylchloridy a aryltrifláty, a také provádění reakcí za pokojové teploty a pomocí slabších zásad.
Mechanismus[editovat | editovat zdroj]
Reakční mechanismus Buchwaldovy–Hartwigovy aminace je podobný jako u palladiem katalyzovaných reakcí vytvářejících vazbu C-C. Jeho součástí jsou oxidační adice arylhalogenidu na sloučeninu Pd(0), adice aminu na oxidačně adiční komplex a deprotonace následovaná redukční eliminací. Společně s redukční eliminací mohou probíhat vedlejší reakce, při kterých u aminu dochází k beta-hydridové eliminaci za vzniku iminu dehydrohalogenovaného arenu.[9]
V průběhu vývoje reakce byly pomocí mechanistických studií identifikovány některé vedlejší produkty. Při těchto studiích se také ukázalo, že může, v závislosti na tom, zda jsou použity monodentátní či chelatující fosfinové ligandy, probíhat různými způsoby.
Katalytický cyklus probíhá takto:[10][11][12][13]
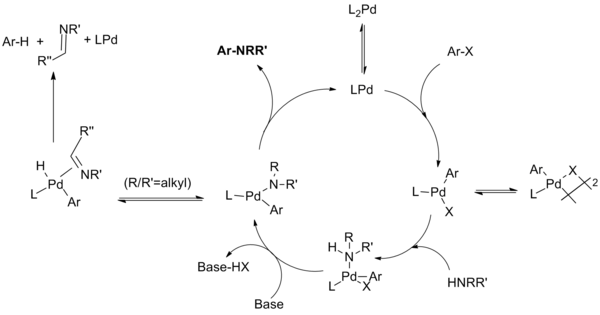
Při použití systému monodentátního ligandu a monofosfinové sloučeniny palladia pravděpodobně vzniká palladnatá sloučenina, která je v rovnováze s μ-halogenovým dimerem. Stabilita tohoto dimeru závisí na druhu halogenu a klesá v pořadí I > Br > Cl, proto nejspíše aryljodidy s katalyzátory první generace reagují pomalu. Poté se vytvoří komplex aminu s ligandem, který je deprotonován zásadou a vznikne amid palladia (při použití chelatujícího ligandu tyto dva kroky probíhají v obráceném pořadí, ke komplexaci zásady dojde před vznikem amidu). Vzniklý meziprodukt podléhá redukční eliminaci, čímž se utvoří produkt a dojde k obnovení katalyzátoru. Může se ovšem objevit vedlejší reakce v podobě beta-hydridové eliminace, která vede ke tvorbě iminu a dehydrohalogenovaného arenu.
Je-li použit chelatující ligand, tak nedochází ke vzniku monofosfinového meziproduktu; místo toho za přítomnosti L2Pd komplexu proběhne oxidační adice, tvorba aminu a redukční eliminace. K redukční eliminaci může dojít u tetrakoordinovaného bisfosfinového i trikoordinovaného monofosfinového arylpalladiumamidového komplexu, přičemž u trikoordinovaného probíhá obecně rychleji. U trikoordinovaných ligandů se navíc objevuje také β-hydridové eliminace. U arylpalladiových komplexů obsahujících chelatující fosfiny probíhá pomalu, a tak je v těchto případech nejvýznamnější reakcí redukční eliminace.[14]
Využití[editovat | editovat zdroj]
Vzhledem k významu tvorby vazeb C-N při syntéze léčiv a přírodních látek se Buchwaldova–Hartwigova aminace často používá v organické syntéze při jejich úplných syntézách a průmyslové výrobě.[22] Průmyslová využití zahrnují α-arylaci karbonylových sloučenin (ketonů, aldehydů, esterů, amidů karboxylových kyselin) a nitrilů.[23]
Možnosti reakce[editovat | editovat zdroj]
I když lze Buchwaldovu–Hartwigovu aminaci provést s velkým počtem různých dvojic aryl-amin, tak jsou potřebné podmínky reakce značně závislé na volbě substrátu. Používá se několik systémů ligandů, každý s různými možnostmi použití i omezeními; vhodné reakční podmínky závisejí na sterických a elektronových vlastnostech obou složek systému. Níže jsou uvedeny substráty a vhodné podmínky reakce pro nejčastější katalytické systémy (nejsou uvedeny N-heterocyklické karbenové ligandy a ligandy s velkými úhly ligand-kov-ligand, jako například Xantfos a SPANfos).[9]
Katalytické systémy první generace[editovat | editovat zdroj]
První generace katalytických systémů pro Buchwaldovu-Hartwigovu aminaci zahrnuje (Pd[P(o-tolyl)3]2) systémy, které fungují dobře u acyklických i cyklických sekundárních, alkylových i arylových (ovšem ne diarylových), aminů kombinovaných s širokou skupinou arylbromidů. Většinou je nelze použít na primární aminy, protože pak dochází k dehydrohalogenaci aminu.[7][8]
K provedení vnitromolekulární varianty této reakce lze použít aryljodidy[8], ovšem pouze tehdy, pokud se jako rozpouštědlo místo toluenu použije dioxan, i když s dobrou výtěžností.[24]
Bidentátní fosfinové ligandy[editovat | editovat zdroj]
Vývin difenylfosfinonaftylových (BINAP) a (difenylfosfino)ferrocenových (DPPF) ligandů pro Buchwaldovu–Hartwigovu aminaci umožnil první provedení této reakce u primárních aminů a také zapojení aryljodidů a triflátů (předpokládá se, že bidentátní ligandy zamezují tvorbě dimeru jodidu palladnatého po oxidační adici, což reakci urychluje). Při použití těchto ligandů reakce obvykle probíhá rychleji a dosahuje se vyšší výtěžnosti než s katalyzátory první generace. Jejich objev se původně zdál být v rozporu s mechanistickými studiemi naznačujícími, že jako aktivní katalyzátor působí u katalyzátorů první generace monodentátní komplexy.[25][26][27]

Chelatační účinky těchto ligandů pravděpodobně zamezují beta-hydridové eliminaci tím, že znepřístupňují reakční místo. U α-chirálních aminů při jejich použití nedochází k racemizaci, která se objevuje při použití katalytických systémů první generace.[28]

Stericky stíněné ligandy[editovat | editovat zdroj]
Objemné tri- a dialkylové fosfinové ligandy použité jako součásti katalytických systémů při Buchwaldově–Hartwigově aminaci umožňují reakce velkého počtu aminů (primárních, sekundárních, odtahujících elektrony, heterocyklických...) s arylchloridy, bromidy, jodidy i trifláty. Jako zásady lze pak navíc obvyklých alkoxidů či silylamidů použít hydroxidy, uhličitany nebo fosforečnany. Buchwaldova skupina vyvinula řadu dialkylbiarylfosfinových ligandů, zatímco Hartwigova skupina se soustředila na ligandy odvozené od ferrocenu a trialkylfosfinů.[29][30][31][32][33][34]

Výrazný nárůst aktivity u těchto ligandů bývá spojován se sterickým upřednostňováním jednovazných sloučenin palladia v celém průběhu katalytického cyklu, což vede k urychlení oxidační adice, tvorby amidu a redukční eliminace. Některé z těchto ligandů také navyšují poměr rychlosti redukční eliminace k rychlosti beta-hydridové eliminace pomocí interakce arenu s palladiem, která zvyšuje elektronovou hustotu.[19][20]
Při použití katalyzátorů s takovými ligandy je dokonce možné použít aminy se skupinami odtahujícími elektrony a heterocyklické substráty, které často deaktivují katalyzátory obsahující palladium.[35][36]

Ekvivalenty amoniaku[editovat | editovat zdroj]
Buchwaldovy–Hartwigovy aminace s použitím amoniaku jsou obtížně proveditelné kvůli jeho silné vazbě na palladnaté komplexy. Tento problém se podařilo vyřešit s použitím reaktantů, které slouží jako ekvivalenty amoniaku; příkladem takových látek jsou benzofenonimin a silylamidy.[37][38][39]
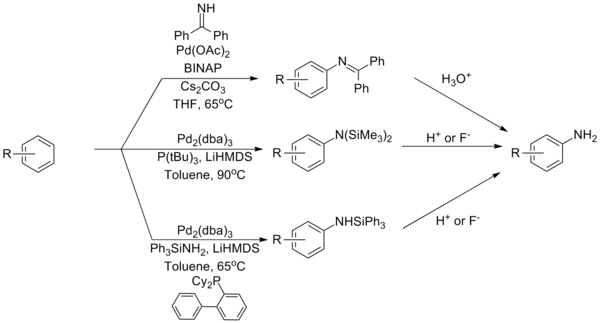
Je znám katalytický systém, obsahující ligand typu josifos, za jehož přítomnosti lze provést Buchwaldovu–Hartwigovu aminaci přímo s amoniakem.[40]
Obdobné reakce vytvářející vazby C-O, C-S a C-C[editovat | editovat zdroj]
Za podobných podmínek jako při aminaci lze provést také reakce alkoholů s arylhalogenidy za vzniku příslušných aryletherů. Touto reakcí lze nahradit jiné, probíhající za tvrdších podmínek, jako je Ullmannova kondenzace.[41][42]

Podobně mohou také reagovat thioly a thiofenoly za tvorby arylthioetherů. Jsou také známy reakce ekvivalentů sulfanu s arylhalogenidy, při kterých rovněž vznikají thiofenoly.[43]
Enoláty a podobné uhlíkaté nukleofily mohou reagovat například s α-arylketony, malonáty a nitrily. Možnosti těchto reakcí jsou ovlivňovány použitými ligandy podobně jako Buchwaldova–Hartwigova aminace a i zde je známo několik katalytických systémů.[44] U těchto procesů bylo vyvinuto několik enantioselektivních variant.[45][46]

Bylo také vyvinuto několik variant této reakce, při kterých se jako katalyzátory místo sloučenin palladia používají komplexy mědi a niklu.[18]
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Buchwald–Hartwig amination na anglické Wikipedii.
- ↑ Paola A. Forero-Cortés; Alexander M. Haydl. The 25th Anniversary of the Buchwald–Hartwig Amination: Development, Applications, and Outlook. Organic Process Research & Development. 2019-07-02, s. 1478–1483.
- ↑ Conrad Weygand. Weygand/Hilgetag Preparative Organic Chemistry. Příprava vydání G. Hilgetag, A. Martini. New York: John Wiley & Sons, Inc., 1972. Dostupné online. ISBN 0471937495. S. 461.
- ↑ M. Kosugi; M. Kameyama; T. Migita. Palladium-Catalyzed Aromatic Amination of Aryl Bromides Withn,n-Di-Ethylamino-Tributyltin. Chemistry Letters. 1983, s. 927–928.
- ↑ D. L. Boger; J. S. Panek. Palladium(0)- mediated [beta]-carboline synthesis: Preparation of the CDE ring system of lavendamycin. Tetrahedron Letters. 1984, s. 3175–3178.
- ↑ F. Paul; J. Patt; J. F. Hartwig. Palladium-catalyzed formation of carbon-nitrogen bonds. Reaction intermediates and catalyst improvements in the hetero cross-coupling of aryl halides and tin amides. Journal of the American Chemical Society. 1994, s. 5969–5970.
- ↑ A. S. Guram; S. L. Buchwald. Palladium-Catalyzed Aromatic Aminations with in situ Generated Aminostannanes. Journal of the American Chemical Society. 1994, s. 7901–7902.
- ↑ a b J. Louie; J. F. Hartwig. Palladium-catalyzed synthesis of arylamines from aryl halides. Mechanistic studies lead to coupling in the absence of tin reagents. Tetrahedron Letters. 1995, s. 3609–3612.
- ↑ a b c A. S. Guram; R. A. Rennels; S. L. Buchwald. A Simple Catalytic Method for the Conversion of Aryl Bromides to Arylamines. Angewandte Chemie International Edition. 1995, s. 1348–1350.
- ↑ a b c Muci, A.R.; BUCHWALD, S.L. Practical Palladium Catalysts for C-N and C-O Bond Formation. Topics in Curr. Chem.. 2002, s. 131–209. ISBN 978-3-540-42175-7. DOI 10.1007/3-540-45313-x_5.
- ↑ M. S. Driver; J. F. Hartwig. Carbon−Nitrogen-Bond-Forming Reductive Elimination of Arylamines from Palladium(II) Phosphine Complexes. Journal of the American Chemical Society. 1996, s. 8232–8245.
- ↑ J. F. Hartwig; S. Richards; D. Barañano; F. Paul. Influences on the Relative Rates for C−N Bond-Forming Reductive Elimination and β-Hydrogen Elimination of Amides. A Case Study on the Origins of Competing Reduction in the Palladium-Catalyzed Amination of Aryl Halides. Journal of the American Chemical Society. 1995, s. 3626–3633.
- ↑ M. S. Driver; J. F. Hartwig. A Rare, Low-Valent Alkylamido Complex, a Diphenylamido Complex, and Their Reductive Elimination of Amines by Three-Coordinate Intermediates. Journal of the American Chemical Society. 1995, s. 4708–4709.
- ↑ R. A. Widenhoefer; S. L. Buchwald. Halide and Amine Influence in the Equilibrium Formation of Palladium Tris(o-tolyl)phosphine Mono(amine) Complexes from Palladium Aryl Halide Dimers. Organometallics. 1996, s. 2755–2763.
- ↑ a b Hartwig, J.F. Approaches to catalyst discovery. New carbon-heteroatom and carbon-carbon bond formation. Pure Appl. Chem.. 1999, s. 1416–1423. DOI 10.1351/pac199971081417.
- ↑ Hartwig, J.F. Palladium-Catalyzed Amination of Aryl Halides: Mechanism and Rational Catalyst Design. Synlett. 1997, s. 329–340. DOI 10.1055/s-1997-789.
- ↑ Hartwig, J.F. Carbon-Heteroatom Bond-Forming Reductive Eliminations of Amines, Ethers, and Sulfides. Acc. Chem. Res.. 1998, s. 852–860. DOI 10.1021/ar970282g.
- ↑ Wolfe, J.P.; WAGAW, S.; MARCOUX, J.F.; BUCHWALD, S.L. Rational Development of Practical Catalysts for Aromatic Carbon-Nitrogen Bond Formation. Acc. Chem. Res.. 1998, s. 805–818. DOI 10.1021/ar9600650.
- ↑ a b Hartwig, J.F. Transition Metal Catalyzed Synthesis of Arylamines and Aryl Ethers from Aryl Halides and Triflates: Scope and Mechanism. Angew. Chem. Int. Ed.. 1998, s. 2046–2067. DOI 10.1002/(sici)1521-3773(19980817)37:15<2046::aid-anie2046>3.0.co;2-l.
- ↑ a b Hartwig, J.F. Evolution of a Fourth Generation Catalyst for the Amination and Thioetherification of Aryl Halides. Acc. Chem. Res.. 2008, s. 1534–1544. DOI 10.1021/ar800098p. PMID 18681463.
- ↑ a b Surry, D.S.; BUCHWALD, S.L. Biaryl Phosphane Ligands in Palladium-Catalyzed Amination. Angew. Chem. Int. Ed.. 2008, s. 6338–6361. DOI 10.1002/anie.200800497. PMID 18663711.
- ↑ Surry, D.S.; BUCHWALD, S.L. Dialkylbiaryl phosphines in Pd-catalyzed amination: a user's guide. Chem. Sci.. 2011, s. 27–50. DOI 10.1039/c0sc00331j. PMID 22432049.
- ↑ [9][14][15][16][17][18][19][20][21]
- ↑ Thomas J. Colacot. The 2010 Nobel Prize in Chemistry: Palladium-Catalysed Cross-Coupling. Archivováno 2. 6. 2020 na Wayback Machine. Platinum Metals Rev., 2011, 55, (2) doi:10.1595/147106711X558301
- ↑ J. P. Wolfe; S. L. Buchwald. Palladium-Catalyzed Amination of Aryl Iodides. The Journal of Organic Chemistry. 1996, s. 1133–1135.
- ↑ M. S. Driver; J. F. Hartwig. A Second-Generation Catalyst for Aryl Halide Amination: Mixed Secondary Amines from Aryl Halides and Primary Amines Catalyzed by (DPPF)PdCl2. Journal of the American Chemical Society. 1996, s. 7217–7218.
- ↑ J. P. Wolfe; S. Wagaw; S. L. Buchwald. An Improved Catalyst System for Aromatic Carbon-Nitrogen Bond Formation: The Possible Involvement of Bis(Phosphine) Palladium Complexes as Key Intermediates. Journal of the American Chemical Society. 1996, s. 7215–7216.
- ↑ J. Louie; M. S. Driver; B. C. Hamann; J. F. Hartwig. Palladium-Catalyzed Amination of Aryl Triflates and Importance of Triflate Addition Rate. The Journal of Organic Chemistry. 1997, s. 1268–1273.
- ↑ S. Wagaw; R. A. Rennels; S. L. Buchwald. Palladium-Catalyzed Coupling of Optically Active Amines with Aryl Bromides. Journal of the American Chemical Society. 1997, s. 8451–8458.
- ↑ D. W. Old; J. P. Wolfe; S. L. Buchwald. A Highly Active Catalyst for Palladium-Catalyzed Cross-Coupling Reactions: Room-Temperature Suzuki Couplings and Amination of Unactivated Aryl Chlorides. Journal of the American Chemical Society. 1998, s. 9722–9723.
- ↑ J. P. Wolfe; S. L. Buchwald. A Highly Active Catalyst for the Room-Temperature Amination and Suzuki Coupling of Aryl Chlorides. Angewandte Chemie International Edition. 1999, s. 2413–2416.
- ↑ B. C. Hamann; J. F. Buchwald. Sterically Hindered Chelating Alkyl Phosphines Provide Large Rate Accelerations in Palladium-Catalyzed Amination of Aryl Iodides, Bromides, and Chlorides, and the First Amination of Aryl Tosylates. Journal of the American Chemical Society. 1998, s. 7369–7370.
- ↑ J. P. Wolfe; H. Tomori; J. P. Sadighi; J. Yin; S. L. Buchwald. Simple, Efficient Catalyst System for the Palladium-Catalyzed Amination of Aryl Chlorides, Bromides, and Triflates. The Journal of Organic Chemistry. 2000, s. 1158–1174. Dostupné online. Bibcode 2007JOCh...72.1134P.
- ↑ J. P. Stambuli; R. Kuwano; J. F. Hartwig. Unparalleled Rates for the Activation of Aryl Chlorides and Bromides: Coupling with Amines and Boronic Acids in Minutes at Room Temperature. Angewandte Chemie International Edition. 2002, s. 4746–4748.
- ↑ X. Huang; K. W. Anderson; D. Zim; L. Jiang; A. Klapars; S. L. Buchwald. Expanding Pd-Catalyzed C-N Bond-Forming Processes: The First Amidation of Aryl Sulfonates, Aqueous Amination, and Complementarity with Cu-Catalyzed Reactions. Journal of the American Chemical Society. 2003, s. 6653–6655. PMID 12769573.
- ↑ K. W. Anderson; R. E. Tundel; T. Ikawa; R. A. Altman; S. L. Buchwald. Monodentate Phosphines Provide Highly Active Catalysts for Pd-Catalyzed CN Bond-Forming Reactions of Heteroaromatic Halides/Amines and (H)N-Heterocycles. Angewandte Chemie International Edition. 2006, s. 6523–6527.
- ↑ T. Ikawa; T. E. Barder; M. R. Biscoe; S. L. Buchwald. Pd-Catalyzed Amidations of Aryl Chlorides Using Monodentate Biaryl Phosphine Ligands: A Kinetic, Computational, and Synthetic Investigation. Journal of the American Chemical Society. 2007, s. 13001–13007. PMID 17918833.
- ↑ J. P. Wolfe; J. Ahman; J. P. Sadighi; R. A. Singer; S. L. Buchwald. An Ammonia Equivalent for the Palladium-Catalyzed Amination of Aryl Halides and Triflates. Tetrahedron Letters. 1997, s. 6367–6370.
- ↑ S. Lee; M. Jorgensen; J. F. Hartwig. Palladium-Catalyzed Synthesis of Arylamines from Aryl Halides and Lithium Bis(trimethylsilyl)amide as an Ammonia Equivalent. Tetrahedron Letters. 2001, s. 2729–2732.
- ↑ X. Huang; S. L. Buchwald. New Ammonia Equivalents for the Pd-Catalyzed Amination of Aryl Halides. Organic Letters. 2001, s. 3417–3419.
- ↑ G. D. Vo; J. F. Hartwig. Palladium-Catalyzed Coupling of Ammonia with Aryl Chlorides, Bromides, Iodides, and Sulfonates: A General Method for the Preparation of Primary Arylamines. Journal of the American Chemical Society. 2009, s. 11049–11061. PMID 19591470.
- ↑ G. Mann; C. Incarvito; A. L. Rheingold; J. F. Hartwig. Palladium-Catalyzed C-O Coupling Involving Unactivated Aryl Halides. Sterically Induced Reductive Elimination To Form the C-O Bond in Diaryl Ethers. Journal of the American Chemical Society. 1999, s. 3224–3225.
- ↑ K. E. Torraca; X. Huang; C. A. Parrish; S. L. Buchwald. An Efficient Intermolecular Palladium-Catalyzed Synthesis of Aryl Ethers. Journal of the American Chemical Society. 2001, s. 10770–10771.
- ↑ Heesgaard Jepsen Tue. Synthesis of Functionalized Dibenzothiophenes - An Efficient Three-Step Approach Based on Pd-Catalyzed C-C and C-S Bond Formations. European Journal of Organic Chemistry. 2011, s. 53–57.
- ↑ D. A. Culkin; J.F. Hartwig. Palladium-Catalyzed r-Arylation of Carbonyl Compounds and Nitriles. Accounts of Chemical Research. 2003, s. 234–245.
- ↑ T. Hamada; A. Chieffi; J. Ahman; S. L. Buchwald. An Improved Catalyst for the Asymmetric Arylation of Ketone Enolates. Journal of the American Chemical Society. 2002, s. 1261–1268.
- ↑ X. Liao; Z. Weng; J. F. Ahman; S. L. Buchwald. Enantioselective r-Arylation of Ketones with Aryl Triflates Catalyzed by Difluorphos Complexes of Palladium and Nickel. Journal of the American Chemical Society. 2008, s. 195–200. PMID 18076166.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Buchwaldova–Hartwigova aminace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Buchwaldova–Hartwigova aminace na Wikimedia Commons

