2-pyridon
| 2-pyridon | |
|---|---|
 Strukturní vzorec laktimové formy | |
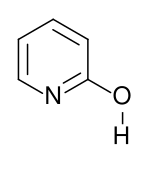 Strukturní vzorec laktamové formy | |
 Model molekuly laktamové formy | |
| Obecné | |
| Systematický název | pyridin-2(1H)-on |
| Sumární vzorec | C5H5NO |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 142-08-5 |
| EC-no (EINECS/ELINCS/NLP) | 205-520-3 |
| PubChem | 8871 |
| ChEBI | 16540 |
| SMILES | Oc1ccccn1 (laktimová forma) C1=CC=CNC(=O)1 (laktamová forma) |
| InChI | 1S/C5H5NO/c7-5-3-1-2-4-6-5/h1-4H,(H,6,7) |
| Číslo RTECS | UV1144050 |
| Vlastnosti | |
| Molární hmotnost | 95,099 g/mol |
| Teplota tání | 107,8 °C (381,0 K)[1] |
| Teplota varu | 280 °C (553 K)[1] |
| Rozpustnost ve vodě | 100 g/100 ml (20 °C)[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v methanolu a acetonu |
| Bezpečnost | |
| [1] | |
| H-věty | H301 H315 H319 H335[1] |
| P-věty | P261 P264 P270 P271 P280 P301+310 P302+352 P304+340 P305+351+338 P312 P321 P330 P332+313 P337+313 P362 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
2-pyridon je organická sloučenina se vzorcem C5H4NH(O), za standardních podmínek bezbarvá pevná látka. Vytváří dimery spojené vodíkovými vazbami a existuje ve dvojici tautomerů.
Výskyt[editovat | editovat zdroj]
Samotný 2-pyridon se v přírodě nevyskytuje, jeho deriváty byly ovšem identifikovány jako kofaktory v některých hydrogenázách.[2]
Příprava[editovat | editovat zdroj]
Pomocí cyklizační reakce lze připravit 2-pyron, který se přemění na 2-pyridon reakcí s amoniakem:
Pyridin vytváří reakcemi s některými oxidačními činidly, jako je peroxid vodíku, N-oxid nazývaný pyridin-N-oxid; tato látka může za přítomnosti acetanhydridu podstoupit přesmyk na 2-pyridon:[3][4][5]
V Guareschiově-Thorpeově kondenzaci reaguje kyanoacetamid s 1,3-diketonem za vzniku 2-pyridonu.[6][7]
Reakci objevili Icilio Guareschi a Jocelyn Field Thorpe.[8][9]
Chemické vlastnosti[editovat | editovat zdroj]
Tautomerie[editovat | editovat zdroj]

Druhou tautomerní formou 2-pyridonu je 2-hydroxypyridin. Obdobná laktam-laktimová tautomerie se vyskytuje i u mnoha odvozených sloučenin.[10]
Tautomerie v pevném skupenství[editovat | editovat zdroj]
Amidová skupina [vytváří vodíkové vazby s ostatními sloučeninami obsahujícími dusík a kyslík.
V pevném skupenství převažuje 2-pyridon, což bylo potvrzeno rentgenovou krystalografií, kde se ukázalo, že vodík se v pevném skupenství nachází blíže k dusíku než ke kyslíku (v důsledku nízké elektronové hustoty na vodíku je přesné určení obtížné), a infračervenou spektroskopií, kde byly patrné frekvence odpovídající vazbám C=O, zatímco frekvence příslušící vazbám O-H nebyly zaznamenány.[11][12][13][14]
Tautomerie v roztoku[editovat | editovat zdroj]
Určení konkrétního tautomeru přítomného v roztoku bylo předmětem několika prací. Rozdíly v jejich energiích jsou velmi malé a vliv na ně má polarita rozpouštědla. V nepolárních rozpouštědlech převládá 2-hydroxypyridin, zatímco u polárních rozpouštědlech, jako jsou alkoholy a voda, je většinovou formou 2-pyridon.[10][15][16][17][18][19][20][21][22]
Rozdíl energií mezi oběma tautomery lze změřit infračervenou spektroskopií, v pevném skupenství činí 2,43 až 3,3 kJ/mol a v kapalném 8,95 kJ/mol a 8,83 kJ/mol.[23][24][25]
Tautomerizační mechanismus A[editovat | editovat zdroj]
Jednomolekulární tautomerizace by probíhala přes zakázaný 1-3 suprafaciální přechodný stav a má tak vysokou energetickou bariéru, jejíž hodnota byla vypočítána metodami teoretické chemie na 125 nebo 210 kJ/mol. Přímá tautomerizace je energeticky nevýhodná; existuje zde několik jiných možných mechanismů.[25]
Dimerizace[editovat | editovat zdroj]
2-pyridon a 2-hydroxypyridin mohou skrz dvojice vodíkových vazeb tvořit dimery.[26]
Shlukování v pevném skupenství[editovat | editovat zdroj]
V pevném skupenství se dimer nevyskytuje; 2-pyridony zde zaujímají helikální strukturu vytvářenou vodíkovými vazbami. Některé substituované 2-pyridony, například 5-methyl-3-karbonitril-2-pyridon, vytváří v pevném skupenství dimery. Tyto struktury lze popsat s využitím rentgenové krystalografie. V pevné fázi se vodík nachází blíže ke kyslíku a název 2-pyridon je tak odpovídající.[10][11][12][13][14]
Shlukování v roztoku[editovat | editovat zdroj]
V roztoku se vyskytuje dimerní forma; míra dimerizace závisí na polaritě rozpouštědla. Polární protická rozpouštědla interagují s vodíkovými vazbami, což vede k většímu podílu monomeru. Hydrofobní efekty nepolárních rozpouštědel způsobují převahu dimeru. Vlastnosti rozpouštědla ovlivňují také poměrné zastoupení tautomerů. V rovnovážné soustavě mohou být přítomny všechny možné kombinace tautomerů a dimerů, přesné určení všech rovnovážných konstant je tak obtížné.[26][6][7][8][9][27][28][29][2][30]
Analýza pomocí NMR spektroskopie je pomalá, provedení infračervené spektroskopie s vysokým rozlišením je v roztoku náročné a široké absorpční pásy v ultrafialové spektroskopii způsobují obtížné rozlišování tří nebo více podobných molekul.
Tautomerizační mechanismus B[editovat | editovat zdroj]
Přímá tautomerizace je energeticky nevýhodná, dimerizace následovaná dvojitým přesunem protonu a disociace dimeru představuje autokatalytickou přeměnu jednoho tautomeru v druhý. Protická rozpouštědla mohou přenos protonu usnadňovat.
Katalytická aktivita[editovat | editovat zdroj]
2-pyridon katalyzuje několik reakcí závislých na protonech, například aminolýzy esterů. V některých případech se používá kapalný 2-pyridon jako rozpouštědlo. Současný výzkum se zaměřuje na přesuny protonů z 2-pyridonu a jeho tautomeru s využitím izotopového značkování a kinetických a kvantově chemických metod; přitom se určuje krok určující rychlost reakce.[27][28][31]
Koordinační chemie[editovat | editovat zdroj]
2-pyridon a některé jeho deriváty se používají jako ligandy v koordinační chemii, často jako 1,3-můstkové ligandy podobné karboxylátovým.[29]
V životním prostředí[editovat | editovat zdroj]
2-pyridone je mikroorganismy v půdě rychle rozkládán, s poločasem kratším než týden.[30]
Bylo objeveno několik organismů schopných využívat 2-pyridon jako zdroj uhlíku, dusíku, a energie, jsou mezi nimi například grampozitivní bakterie Arthrobacter crystallopoietes[32] a některé aktinobakterie (Actinobacteria), které mohou pyridin a jeho jedno- či vícenásobně substituované alkyl-, karboxyl- a hydroxylderiváty. Rozklad 2-pyridonu je obvykle iniciován atakem monooxygenázy, čímž se vytváří diol, jako například 2,5-dihydroxypyridin, jenž je metabolizován v maleamátové dráze. Decyklizaci zprostředkovává enzym 2,5-dihydroxypyridinmonooxygenáza, který je také zapojen do metabolismu kyseliny nikotinové. U Arthrobacter crystallopoietes probíhá přinejmenším část rozkladu v plazmidech.[33]
Pyridindioly v roztocích mohou být přeměněny na barevné produkty; při rozkladu mnoha pyridinových rozpouštědel, jako jsou nesubstituovaný pyridin a pikoliny, byly pozorovány žluté pigmenty, příslušné metabolické dráhy často vedou k nadprodukci riboflavinu za přítomnosti těchto rozpouštědel.[34]
Rozklad pyridonů, dihydroxypyridinů a pyridinkarboxylových kyselin je často řízen oxygenázami, zatímco u pyridinových rozpouštědel obvykle tyto enzymy zapojeny nejsou a někdy dráha začíná redukčním krokem.[33]
Podobné pigmenty byly pozorovány při rozkladu chinolinů.[35]
Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu 2-pyridon na Wikimedia Commons
Obrázky, zvuky či videa k tématu 2-pyridon na Wikimedia Commons
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku 2-Pyridone na anglické Wikipedii.
- ↑ a b c d e f https://pubchem.ncbi.nlm.nih.gov/compound/8871
- ↑ a b Shima, S.; Lyon, E. J.; Sordel-Klippert, M.; Kauss, M.; Kahnt, J.; Thauer, R. K.; Steinbach, K.; Xie, X.; Verdier, L. and Griesinger, C., "Structure elucidation: The cofactor of the iron-sulfur cluster free hydrogenase Hmd: structure of the light-inactivation product", Angewandte Chemie International Edition, 2004, 43, 2547-2551
- ↑ Pyridin-N-oxydと酸無水物との反應. Yakugaku Zasshi. 1947, s. 51–52. DOI 10.1248/yakushi1947.67.3-4_51.
- ↑ Eiji Ochiai. Recent Japanese Work on the Chemistry of Pyridine 1-Oxide and Related Compounds. The Journal of Organic Chemistry. 1953, s. 534–551. DOI 10.1021/jo01133a010.
- ↑ V. Boekelheide; W. L. Lehn. The Rearrangement of Substituted Pyridine N-Oxides with Acetic Anhydride1.2. The Journal of Organic Chemistry. 1961, s. 428–430. DOI 10.1021/jo01061a037.
- ↑ a b Gilchrist, T.L. (1997). Heterocyclic Chemistry ISBN 0-470-20481-8
- ↑ a b V. R. Rybakov; A. A. Bush; E. B. Babaev; L. A. Aslanov. 3-Cyano-4,6-dimethyl-2-pyridone (Guareschi Pyridone). Acta Crystallographica E. 2004, s. o160–o161. DOI 10.1107/S1600536803029295.
- ↑ a b I. Guareschi. Mem. Reale Accad. Sci. Torino II.Chybí název periodika! 1896.
- ↑ a b H. Baron; F. G. P. Remfry; J. F. Thorpe. CLXXV.-The formation and reactions of imino-compounds. Part I. Condensation of ethyl cyanoacetate with its sodium derivative. Journal of the Chemical Society. 1904, s. 1726–1761. Dostupné online. DOI 10.1039/ct9048501726.
- ↑ a b c Forlani L.; CRISTONI G.; BOGA C.; TODESCO P. E.; DEL VECCHIO E.; SELVA S.; MONARI M. Reinvestigation of tautomerism of some substituted 2-hydroxypyridines. Arkivoc. 2002, s. 198–215. Dostupné online. DOI 10.3998/ark.5550190.0003.b18.[nedostupný zdroj]
- ↑ a b H. W. Yang; B. M. Craven. Charge Density of 2-Pyridone. Acta Crystallographica B. 1998, s. 912–920. DOI 10.1107/S0108768198006545. PMID 9880899.
- ↑ a b B. R. Penfold. The Electron Distribution in Crystalline Alpha Pyridone. Acta Crystallographica. 1953, s. 591–600. DOI 10.1107/S0365110X5300168X.
- ↑ a b U. Ohms; H. Guth; E. Heller; H. Dannöhl; A. Schweig. Comparison of Observed and Calculated Electron-Density 2-Pyridone, C5H5NO, Crystal-Structure Refinements at 295K and 120K, Experimental and Theoretical Deformation Density Studies. Zeitschrift für Kristallographie. 1984, s. 185–200. DOI 10.1524/zkri.1984.169.14.185.
- ↑ a b J. Almlöf; A. Kvick; I. Olovsson. Hydrogen Bond Studies Crystal Structure of Intermolecular Complex 2-Pyridone-6-Chloro-2-Hdroxypyridine. Acta Crystallographica B. 1971, s. 1201–1208. DOI 10.1107/S0567740871003753.
- ↑ Vögeli U.; VON PHILIPSBORN W. C-13 and H-1 NMR Spectroscopie Studies on Structure of N-Methyle-3-Pyridone and 3-Hydroypyridine. Organic Magnetic Resonance. 1973, s. 551–559. DOI 10.1002/mrc.1270051202.
- ↑ Specker H.; GAWROSCH H. Ultraviolet absorption of benztriaxole, pryridone and its salts. Chemische Berichte. 1942, s. 1338–1348. DOI 10.1002/cber.19420751115.
- ↑ Leis D. G.; CURRAN B. C. Electric Moments of Some Gamma-Substituted Pyridines. Journal of the American Chemical Society. 1945, s. 79–81. DOI 10.1021/ja01217a028.
- ↑ Albert A.; PHILLIPS J. N. Ionisation Constants of Heterocyclic Substances Hydroxy-Derivates of Nitrogenous Six-Membered Ring-Compounds. Journal of the Chemical Society. 1956, s. 1294–1304. DOI 10.1039/jr9560001294.
- ↑ Cox R. H.; BOTHNER-BY A. A. Proton Magnetic Resonance Spectra of Tautomeric Substituted Pyridines and Their Conjugated Acides. J. Phys. Chem.. 1969, s. 2465–2468. DOI 10.1021/j100842a001.
- ↑ Aksnes DW, Kryvi; KRYVI, Håkon; SAMUELSON, Olof; SJÖSTRAND, Elisabeth; SVENSSON, Sigfrid. Substituent and Solvent Effects in Proton Magnetic -Resonance (PMR) Spectra of 6 2-Substituted Pyridines. Acta Chem. Scand.. 1972, s. 2255–2266. DOI 10.3891/acta.chem.scand.26-2255.
- ↑ Aue DH, Betowski LD, Davidson WR, Bower MT, Beak P. Gas-Phase Basicities of Amides and Imidates - Estimation of Protomeric Equilibrium-Constantes by the Basicity methode in the Gas-Phase. Journal of the American Chemical Society. 1979, s. 1361–1368. DOI 10.1021/ja00500a001.
- ↑ Frank J., Alan R. Katritzky. Tautomeric pyridines. XV. Pyridone-hydroxypyridine equilibria in solvents of different polarity. J Chem Soc Perkin Trans 2. 1976, s. 1428–1431. DOI 10.1039/p29760001428.
- ↑ R. S. Brown; A. Tse; J. C. Vederas. Photoelectro-Determined Core Binding Energies and Predicted Gas-Phase Basicities for the 2-Hydroxypyridine 2-Pyridone System. Journal of the American Chemical Society. 1980, s. 1174–1176. DOI 10.1021/ja00523a050.
- ↑ P. Beak. Energies and Alkylation of Tautomeric Heterocyclic-Compounds - Old Problems New Answers. Accounts of Chemical Research. 1977, s. 186–192. DOI 10.1021/ar50113a006.
- ↑ a b H. I. Abdulla; M. F. El-Bermani. Infrared studies of tautomerism in 2-hydroxypyridine 2-thiopyridine and 2-aminopyridine. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2001, s. 2659–2671. DOI 10.1016/S1386-1425(01)00455-3. PMID 11765793. Bibcode 2001AcSpA..57.2659A.
- ↑ a b G. G. Hammes; P. J. Lillford. A Kinetic and Equilibrium Study of Hydrogen Bond Dimerization of 2-Pyridone in Hydrogen Bonding Solvent. Journal of the American Chemical Society. 1970, s. 7578–7585. DOI 10.1021/ja00729a012.
- ↑ a b C. B. Fischer; H. Steininger; D. S. Stephenson; H. Zipse. Catalysis of Aminolysis of 4-Nitrophenyl Acetate by 2-Pyridone. Journal for Physical Organic Chemistry. 2005, s. 901–907. DOI 10.1002/poc.914.
- ↑ a b L.-H. Wang; H. Zipse. Bifunctional Catalysis of Ester Aminolysis - A Computational and Experimental Study. Justus Liebigs Annalen der Chemie. 1996, s. 1501–1509. DOI 10.1002/jlac.199619961003.
- ↑ a b J. M. Rawson; R. E. P. Zipse. The coordination chemistry of 2-pyridones and its derivatives. Coordination Chemistry Reviews. 1995, s. 313–374. DOI 10.1016/0010-8545(94)01117-T.
- ↑ a b Gerald K. Sims. Degradation of Pyridine Derivatives in Soil. Journal of Environmental Quality. 1985, s. 580–584. Dostupné online. DOI 10.2134/jeq1985.00472425001400040022x.
- ↑ C. B. Fischer; K. Polborn; H. Steininger; H. Zipse. Synthesis and Solid-State Structures of Alkyl-Substituted 3-Cyano-2-pyridones. Zeitschrift für Naturforschung. 2004, s. 1121–1131. Dostupné online. DOI 10.1515/znb-2004-1008. Archivováno 30. 10. 2008 na Wayback Machine.
- ↑ Jerald C. Ensign; Sydney C. Rittenberg. A crystalline pigment produced from 2-hydroxypyridine by arthrobacter crystallopoietes n.sp. Archiv für Mikrobiologie. 1963, s. 137–153. DOI 10.1007/BF00422519. PMID 14106078.
- ↑ a b G. K. Sims; E. J. O'Loughlin; Ronald Crawford. Degradation of pyridines in the environment. CRC Critical Reviews in Environmental Control. 1989, s. 309–340. Dostupné online. DOI 10.1080/10643388909388372.
- ↑ Gerald K. Sims. Riboflavin Production during Growth of Micrococcus luteus on Pyridine. Applied and Environmental Microbiology. 1992, s. 3423–3425. DOI 10.1128/AEM.58.10.3423-3425.1992. PMID 16348793.
- ↑ E. J. O'Loughlin; S. Kehrmeyer; G. Sims. Isolation, characterization, and substrate utilization of a quinoline-degrading bacterium. International Biodeterioration & Biodegradation. 1996, s. 107–118. DOI 10.1016/S0964-8305(96)00032-7.
- Engdahl K.; AHLBERG P. Journal of Chemical Research. 1977, s. 340–341.
- Bensaude O., Chevrier M., Dubois J. Lactim-Lactam Tautomeric Equilibrium of 2-Hydroxypyridines. 1.Cation Binding, Dimerization and Interconversion Mechanism in Aprotic Solvents. A Spectroscopic and Temperature-Jump Kinetic Study. Journal of the American Chemical Society. 1978, s. 7055–7066. DOI 10.1021/ja00490a046.
- Bensaude O, Dreyfus G, Dodin G, Dubois J. Intramolecular Nondissociative Proton Transfer in Aqueous Solutions of Tautomeric Heterocycles: a Temperature-Jump Kinetic Study. Journal of the American Chemical Society. 1977, s. 4438–4446. DOI 10.1021/ja00455a037.
- Bensaude O, Chevrier M, Dubois J. Influence of Hydration upon Tautomeric Equilibrium. Tetrahedron Letters. 1978, s. 2221–2224. DOI 10.1016/S0040-4039(01)86850-7.
- Hammes GG, Park AC. Kinetic and Thermodynamic Studies of Hydrogen Bonding. Journal of the American Chemical Society. 1969, s. 956–961. DOI 10.1021/ja01032a028.
- Hammes GG, Spivey HO. A Kinetic Study of the Hydrogen-Bond Dimerization of 2-Pyridone. Journal of the American Chemical Society. 1966, s. 1621–1625. DOI 10.1021/ja00960a006. PMID 5942979.
- Beak P, Covington JB, Smith SG. Structural Studies of Tautomeric Systems: the Importance of Association for 2-Hydroxypyridine-2-Pyridone and 2-Mercaptopyridine-2-Thiopyridone. Journal of the American Chemical Society. 1976, s. 8284–8286. DOI 10.1021/ja00441a079.
- Beak P, Covington JB, White JM. Quantitave Model of Solvent Effects on Hydroxypyridine-Pyridone and Mercaptopyridine-Thiopyridone Equilibria: Correlation with Reaction-Field and Hydrogen-Bond Effects. The Journal of Organic Chemistry. 1980, s. 1347–1353. DOI 10.1021/jo01296a001.
- Beak P, Covington JB, Smith SG, White JM, Zeigler JM. Displacement of Protomeric Equilibria by Self-Association: Hydroxypyridine-Pyridone and Mercaptopyridine-Thiopyridone Isomer Pairs. The Journal of Organic Chemistry. 1980, s. 1354–1362. DOI 10.1021/jo01296a002.





