Aniontová adiční polymerizace
Aniontová adiční polymerizace je druh polymerizační reakce, patřící mezi iontové polymerizace, při které jsou aktivními centry anionty. Má mnoho různých využití, jako monomery se však při ní nejčastěji používají vinylové sloučeniny.[1][2] U některých takových reakcí je možné ovlivňovat strukturu a složení produktů.[1][2]
Historie[editovat | editovat zdroj]

Roku 1936 Karl Ziegler navrhl aniontovou polymerizaci styrenu a butadienu postupnou adicí monomeru na alkyllithný iniciátor probíhající bez přenosu řetězce či terminace. O dvacet let později Szwarc pozoroval živou polymerizaci.[4][5] V jedné z průlomových prací v oblasti studia polymerů Szwarc ukázal, že při radikálové adici naftalenu na styren probíhá přesun elektronů, což vede k tvorbě dianionu, který rychle reaguje se styrenem za vzniku „živého“ polymeru. Důležité je, že při reakci použil aprotické rozpouštědlo, konkrétně tetrahydrofuran. Szwarc zdůraznil, že kinetika a termodynamika mají velký význam v tomto ději. Ve stejné době zkoumal vzájemná působení několika iontových párů a radikálových iontů. Tato práce vedla k objevu použitelné syntézy polymerů s možností ovlivňovat jejich molekulové hmotnosti, rozdělení molekulových hmotností a strukturu.[6]
Použití alkalických kovů k iniciaci polymerizace 1,3-dienů vedlo k objevu cis-1,4-polyizoprenu.[7] Tento objev nastartoval vývoj průmyslových aniontových polymerizací s využitím alkyllithných iniciátorů.[2]
Vlastnosti monomeru[editovat | editovat zdroj]
Monomery použitelné při aniontové polymerizaci lze rozdělit do dvou větších skupin.[2]
Vinylové monomery mají obecný vzorec CH2=CHR, nejvýznamnější z nich jsou styren (C6H5-CH=CH2), buta-1,3-dien (CH2=CH-CH=CH2) a isopren (CH2=C(CH3)CH=CH2). Patří sem také vinylpyridin, vinylsulfony, vinylsulfoxidy a vinylsilany.[2]
Druhou skupinou jsou akrylátové estery, jako akrylonitril, methakryláty, kyanoakryláty a akrolein.


Cyklické monomery[editovat | editovat zdroj]
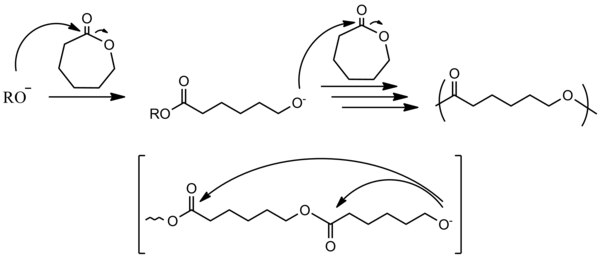

Aby mohlo dojít k polymeraci u vinylových sloučenin, tak musí substituenty na dvojné vazbě být schopné stabilizovat záporný náboj. Stabilizace probíhá prostřednictvím delokalizace tohoto náboje. Vzhledem k vlastnostem karboaniontového propagačního centra nesmí být přítomny substituenty reagující se zásadou nebo s nukleofilem, případně musí být chráněny.[2]
Iniciace[editovat | editovat zdroj]
Iniciátory aniontové polymerizace se vybírají podle reaktivity monomerů. S velmi elektrofilními monomery, jako jsou kyanoakryláty, se používají pouze slabé nukleofily, například aminy, fosfiny, nebo dokonce alkylhalogenidy. U méně reaktivních monomerů, například styrenu, je třeba použít silné nukleofily, jako je N-butyllithium. U reaktantů střední reaktivity se používají i středně reaktivní nukleofily, což je například vinylpyridin.[2]
Použité rozpouštědlo se určuje podle reaktivity iniciátoru a vlastností vznikajícího řetězce. U aniontových sloučenin s nízkou reaktivitou, například heterocyklických monomerů, lze použít mnoho různých rozpouštědel.[2]
Iniciace přesunem elektronů[editovat | editovat zdroj]
Iniciace polymerizace styrenu naftalenidem sodným probíhá skrz přesun elektronů z naftalenového radikálového aniontu na monomer. Vzniklý radikál se dimerizuje na dilithiosloučeninu, která následně funguje jako iniciátor. Při tomto postupu je nutné použít polární rozpouštědlo, potřebná je i stabilita radikálového aniontu a solvatace vznikajících kationtů.[7] Poté se může přesunout elektron z radikálového aniontu na monomer. Při iniciaci může rovněž dojít k přesunu elektronů z alkalického kovu na monomer, čímž také vzniká radikálový anion. Iniciátor se objevuje na poverchu kovu, přičemž dochází k vratnému přesunu elektronu na adsorbovaný monomer.[2]
Iniciace silnými anionty[editovat | editovat zdroj]
K nukleofilním iniciátorům patří kovalentní i iontové amidy kovů, alkoxidy, hydroxidy, kyanidy, fosfiny, aminy a organokovové sloučeniny (alkyllithné sloučeniny a Grignardova činidla). POři iniciaci dochází k adici neutrálního (B:) nebo záporného (B:-) nukleofilu na monomer.[7] Nejčastěji se používají alkyllithné sloučeniny, a to obvykle při polymerizaci styrenů a dienů.[2]
Monomery aktivované silně elektronegativními skupinami mohou být iniciovány slabými anionty i neutrálními nukleofily (například aminy a fosfiny). Příkladem je polymerace kyanoakrylátů, která se využívá na výrobu sloučenin, které jsou základními složkami sekundových lepidel. V tomto případě stačí stopová množství nečistot k iniciaci aniontové nebo zwitteriontové polymerace.
Propagace[editovat | editovat zdroj]

Během propagace aniontové adiční polymerizace dojde k úplnému spotřebování monomeru. Tato fáze je často velmi rychlá i za nízkých teplot.[1]
Živá aniontová polymerizace[editovat | editovat zdroj]
Živá aniontová polymerizace je živá varianta aniontové polymerizace.
Živé aniontové polymerizace byly poprvé provedeny v roce 1956, kdy šlo o polymerizace styrenu a dienů. Při živé polymerizaci prakticky nedochází k terminaci a za nepřítomnosti nečistot by byl karboanion stále aktivní, s možností navázání dalšího monomeru. Řetězec se prodlužuje do chvíle, kdy je do reakce záměrně zavedena terminace nebo přenos řetězce. Tímto dochází ke dvěma důležitým následkům:
- Číselnou střední molekulovou hmotnost, Mn, lze určit podle množství spotřebovaného monomeru a použitého iniciátoru, protože stupeň polymerizace by měl na poměru látkového množství spotřebovaného monomeru a látkového množství přidaného iniciátoru.
- , kde Mo = hmotnost opakující se jednotky, [M]o = původní koncentrace monomeru, [I] = koncentrace iniciátoru
- Všechny řetězce se iniciují téměř najednou a syntézu polymeru tak lze snadněji řídit z hlediska molekulových hmotností.
Polymerizaci lze považovat za živou, jestliže má následující vlastnosti
- Polymerizace probíhá do úplného využití monomeru a spouští se po přidání dalšího.
- Stálý počet aktivních částic (center).
- Rozdělení molekulových hmotností je Poissonovo.
- Funkcionalizace koncových skupin lze provést kvantitativně.
V praxi se i za nepřítomnosti terminujících částic koncentrace aktivních aniontů postupně snižuje, protože dochází k samovolné terminaci.[7]
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Anionic addition polymerization na anglické Wikipedii.
- ↑ a b c Hsieh, H.;Quirk, R. Anionic Polymerization: Principles and practical applications; Marcel Dekker, Inc: New York, 1996.
- ↑ a b c d e f g h i j Quirk, R. Anionic Polymerization. In Encyclopedia of Polymer Science and Technology; John Wiley and Sons: New York, 2003.
- ↑ Sebastian Koltzenburg; Michael Maskos; Oskar Nuyken. Polymer Chemistry. [s.l.]: Springer ISBN 978-3-662-49279-6.
- ↑ M. Szwarc; M. Levy; R. Milkovich. Polymerization Initiated by Electron Transfer to Monomer. A New Method of Formation of Block Polymers. Journal of the American Chemical Society. 1956, s. 2656–2657.
- ↑ M. Szwarc. "Living" polymers. Nature. 1956, s. 1168.
- ↑ Smid, J. Historical Perspectives on Living Anionic Polymerization. J. Polym. Sci. Part A.; 2002, 40,pp. 2101-2107. DOI=10.1002/pola.10286
- ↑ a b c d Odian, G. Ionic Chain Polymerization; In Principles of Polymerization; Wiley-Interscience: Staten Island, New York, 2004, pp. 372-463.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Aniontová adiční polymerizace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Aniontová adiční polymerizace na Wikimedia Commons

![{\displaystyle M_{n}=M_{o}{\frac {[{\mbox{M}}]_{o}}{[{\mbox{I}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/86220a1bcee2334650c55dd7e3525f348836042b)