Tetrahydridoboritany
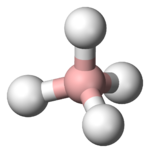
Tetrahydridoboritany, též nazývané borohydridy, jsou soli tetrahydridoboritanového (borohydridového) aniontu, [BH4]−.[1]
Jako borohydridy či tetrahydroboritany se také označují sloučeniny obsahující ionty [BH4−nXn}]−, kde n je celé číslo od 0 do 3; příkladem jsou kyanoborohydridy (kyanotrihydridoboritany), [BH3(CN)]− a triethylborohydridy (triethylhydridoboritany), [BH(CH2CH3)3]−. Borohydridy se používají v organických syntézách jako redukční činidla. Nejvýznamnějšími sloučeninami z této skupiny jsou tetrahydridoboritan lithný a tetrahydridoboritan sodný.[2] Tetrahydridoboritany mají také využití v průmyslové anorganické chemii.[3]
Historie[editovat | editovat zdroj]
Borohydridy alkalických kovů byly poprvé popsány v roce 1940, kdy Hermann Irving Schlesinger a Herbert C. Brown připravili borohydrid lithný (LiBH4) z diboranu (B2H6):[4][5]
- 2 MH + B2H6 → 2 M[BH4] (M = například Li, Na, K, Rb, Cs)
V současnosti se borohydridy připravují reakcemi diboranu nebo trimethylboritanu s hydridy kovů ve vhodném rozpouštědle.[2][6]
Struktura[editovat | editovat zdroj]
Borohydridový anion a většina jeho derivátů obsahují atom boru v tetraedrickém uspořádání.[6] Reaktivita vazeb B−H závisí na přítomných ligandech. Ethylové skupiny, které dodávají elektrony, například u triethylborohydridu, dodávají B−H centrům vysokou nukleofilitu. Skupiny odtahující elektrony, například kyanidové ionty u kyanoborohydridu, jsou elektrofilní a jedná se o slabší redukční činidla.
| Sloučenina číslo CAS |
molární hmotnost (g/mol) |
Vodíková hustota | Hustota (g/cm3) |
teplota tání (°C) |
rozpustnost ve vodě (g/100 ml při 25 °C) |
rozpustnost v methanolu (g/100 ml, 25 °C) |
rozpustnost v diethyletheru (g/100 ml, 25 °C) |
rozpustnost v tetrahydrofuranu (g/100 ml při 25 °C) |
|---|---|---|---|---|---|---|---|---|
| borohydrid lithný (LiBH4) [16949-15-8] |
21,78 | 18,5 | 0,66 | 280 | 20,9 | rozklad (v ethanolu 44) | 4,3 | 22,5 |
| borohydrid sodný (NaBH4) [16940-66-2] |
37,83 | 10,6 | 1,07 | 505 | 55 | 16,4 (20 °C) | nerozpustný | 0,1 (20 °C) |
| kyanoborohydrid sodný (Na[BH3(CN)]) [25895-60-7] |
62,84 | 6,4 | 1,20 | 240 (současně se rozkládá) | nereaguje[7] | 217 | nerozpustný | 36 |
| borohydrid draselný (KBH4)} [13762-51-1] |
53,94 | 7,4 | 1,17 | 585 (ve vodíkové atmosféře) | 19 | nerozpustný | nerozpustný | nerozpustný |
| triethylborohydrid lithný (LiBHEt3) [22560-16-3] |
105,94 | 0,95 | není známo | není známo | rozklad | rozklad | není známo | vysoká |
Použití[editovat | editovat zdroj]
V největším množství, kolem 5 000 tun ročně, se vyrábí borohydrid sodný. Jeho hlavním využitím je redukce oxidu siřičitého na dithioničitan sodný:
- Na[BH4] + 8 NaOH + 8 SO2 → 4 Na2S2O4 + NaBO2 + 6 H2O
Dithioničitan se používá na bělení celulózy.[2]
Borohydridem sodným se také redukují aldehydy a ketony při výrobě některých léčiv, například chloramfenikolu, thiofenikolu, vitaminu A, atropinu a skopolaminu, a řady aromat a ochucovadel.
Možná využití[editovat | editovat zdroj]
Vzhledem k vysokému obsahu vodíku se borohydridové komplexy a soli zkoumají pro možné využití při skladování vodíku.[8] Největšími překážkami jsou pomalý průběh reakcí, nízké výtěžky vodíku a obtížné obnovování původních borohydridů.
Komplexy[editovat | editovat zdroj]

Ve svých komplexech jsou borohydridové ionty na kovy navázány přes jeden až tři můstkové atomy vodíku.[9][10]
Ve většině případů je [BH4]− bidentátním ligandem.
Některé homoleptické borohydridy, například borohydrid uraničitý, jsou těkavé.
Komplexy borohydridů se často dají připravit podvojnými záměnami:[11]
Rozklad[editovat | editovat zdroj]
Některé tetrahydridoboritany se při zahřívání rozkládají na boridy. U těkavých tetrahydridoboritanů lze tento rozklad použít k chemické depozici z plynné fáze, kde se ukládají tenké vrstvy boridů.[12] Takto se dají vytvářet například vrstvy boridu zirkoniového (ZrB2) z tetrahydridoboritanu zirkoničitého (Zr[BH4]4) a hafniového (HfB2) z tetrahydridoboritanu hafničitého (Hf[BH4]4):[12]
- M[BH4]4 → MB2 + B2H6 + 5 H2
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Borohydride na anglické Wikipedii.
- ↑ Tetrahydroborate [online]. [cit. 2013-02-26]. Dostupné online.
- ↑ a b c RITTMEYER, Peter; WIETELMANN, Ulrich. Hydrides. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a13_199. S. a13_199. (anglicky) DOI: 10.1002/14356007.a13_199.
- ↑ V. D. Makhaev. Borohydride. Russian Chemical Reviews. 2000, s. 727–746. DOI 10.1070/RC2000v069n09ABEH000580.
- ↑ H. C. Schlesinger; H. R. Brown. Metallo Borohydrides. III. Lithium Borohydride. Journal of the American Chemical Society. 1940, s. 3429–3435. DOI 10.1021/ja01869a039.
- ↑ H. C. Schlesinger; H. R. Brown; L. R. Hoekstra. Reactions of Diborane with Alkali Metal Hydrides and Their Addition Compounds. New Syntheses of Borohydrides. Sodium and Potassium Borohydrides. Journal of the American Chemical Society. 1953, s. 199–204. DOI 10.1021/ja01097a053.
- ↑ a b GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. Dostupné online. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. OCLC 320245801 S. 207–208.
- ↑ Robert O. Hutchins; MaryGail K. Hutchins; Matthew L. Crawley. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: John Wiley & Sons, 2007. ISBN 978-0471936237. DOI 10.1002/047084289X.rs059.pub2. Kapitola Sodium Cyanoborohydride.
- ↑ Tomasz Jaroń; Wojciech Wegner; Wojciech Grochala. M[Y(BH4)4] and M2Li[Y(BH4)6−xClx] (M = Rb, Cs): new borohydride derivatives of yttrium and their hydrogen storage properties. Dalton Transactions. 2018-08-17, s. 6886–6893. DOI 10.1039/C3DT33048F. PMID 23503711.
- ↑ T. J. Marks; J. R. Kolb. Borohydride. Chemical Reviews. 1977, s. 263. DOI 10.1021/cr60306a004.
- ↑ M. Besora; A. Lledós. Coordination Modes and Hydride Exchange Dynamics in Transition Metal Tetrahydroborate Complexes. Structure and Bonding. 2008, s. 149–202. ISBN 978-3-540-78633-7. DOI 10.1007/430_2007_076.
- ↑ H. Franz; H. Fusstetter; H. Nöth. Borohydride. Zeitschrift für anorganische und allgemeine Chemie. 1976, s. 97–113. DOI 10.1002/zaac.654270202.
- ↑ a b J. A. Jensen; J. E. Gozum; D. M. Pollina; G. S. Girolami. Titanium, Zirconium, and Hafnium tetrahydroborates as "tailored" CVD precursors for metal diboride thin films. Journal of the American Chemical Society. 1988, s. 1643–1644. DOI 10.1021/ja00213a058.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Tetrahydridoboritany na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tetrahydridoboritany na Wikimedia Commons - Tetrahydridoboritan sodný na organic-chemistry.org
