Seyferthova–Gilbertova homologace
Seyferthova–Gilbertova homologace je reakce arylového ketonu 1 (nebo aldehydu) s dimethyl(diazomethyl)fosfonátem 2 a terc-butoxidem draselným za vzniku substituovaného alkynu 3.[1][2]
Dimethyl(diazomethyl)fosfonáty 2 bývají občas nazývány Seyferthova–Gilbertova činidla.[3]

Tato reakce patří mezi homologace, protože její produkt obsahuje o jeden atom uhlíku více než původní reaktant.
Mechanismus
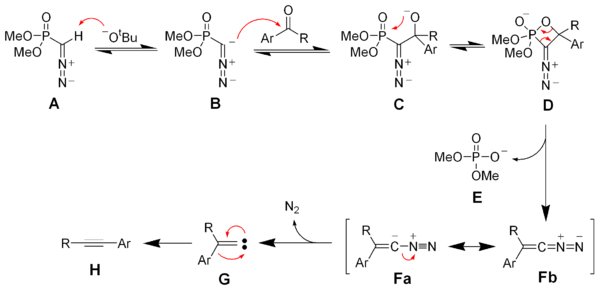
[editovat | editovat zdroj]Deprotonací Seyferthova–Gilbertova činidla A vzniká anion B, který reaguje s ketonem za tvorby oxafosfetanu D. Eliminací dimethylfosfátu E se vytvoří vinyldiazo meziprodukt s rezonančními strukturami Fa a Fb. Po vzniku plynného dusíku vznikne vinylkarben G, jenž se 1,2-přesmykem změní na alkyn H.
Bestmannova varianta
[editovat | editovat zdroj]| Ohirovo–Bestmannovo činidlo | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | dimethyl(1-diazo-2-oxopropyl)fosfonát |
| Sumární vzorec | C5H9N2O4P |
| Identifikace | |
| Registrační číslo CAS | 90965-06-3 |
| PubChem | 11106189 |
| SMILES | O=P(OC)(OC)C(C(C)=O)=[N+]=[N-] |
| InChI | InChI=1/C5H9N2O4P/c1-4(8)5(7-6)12(9,10-2)11-3/h1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 192,11 g/mol |
Některá data mohou pocházet z datové položky. | |
Dimethyl(diazomethylfosfonátový karboanion lze získat reakcí dimethyl-1-diazo-2-oxopropylfosfonátu, také nazývaného Ohirovo-Bestmannovo činidlo) s methanolem a uhličitanem draselným (sloužícím jako zásada), při kterém dojde k odštěpení acetylové skupiny v podobě methylacetátu. Reakcemi Bestmannova činidla s aldehydy vznikají koncové alkyny, často s velmi vysokými výtěžnostmi, v méně krocích než v Coreyově–Fuchsově reakci.[4][5]

Použití uhličitanu draselného umožňuje zapojit do této reakce širší rozmezí funkčních skupin.
Upravená in situ příprava Ohirova-Bestmannova činidla
[editovat | editovat zdroj]
Byl vyvinut bezpečnější a lépe laditelný postup přípravy alkynů z aldehydů. Jeho výhodami jsou použití stabilního sulfonylazidu, místo tosylazidu, k získání Ohirova−Bestmannova činidla.[6]
Ostatní obměny
[editovat | editovat zdroj]U méně reaktivních aldehydů lze uhličitan draselný nahradit uhličitanem cesným a methanolem, čímž se výrazně navýší výtěžnost.[7]
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Seyferthova–Gilbertova homologace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Seyferthova–Gilbertova homologace na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Seyferth–Gilbert homologation na anglické Wikipedii.
- ↑ D. Seyferth; R. S. Marmor. Reactions of dimethylphosphono-substituted diazoalkanes. (MeO)2P(O)CR transfer to olefins and 1,3-dipolar additions of (MeO)2P(O)C(N2)R. The Journal of Organic Chemistry. 1971, s. 1379–1386. DOI 10.1021/jo00809a014.
- ↑ J. C. Gilbert; U. Weerasooriya. Diazoethenes: their attempted synthesis from aldehydes and aromatic ketones by way of the Horner-Emmons modification of the Wittig reaction. A facile synthesis of alkynes. The Journal of Organic Chemistry. 1982, s. 1837–1845. DOI 10.1021/jo00349a007.
- ↑ D. G. Brown; E. J. Velthuisen; J. R. Commerford; R. G. Brisbois; T. H. Hoye. A Convenient Synthesis of Dimethyl (Diazomethyl)phosphonate (Seyferth/Gilbert Reagent). The Journal of Organic Chemistry. 1996, s. 2540–2541. DOI 10.1021/jo951944n.
- ↑ S. Müller; B. Liepold; G. Roth; H. J. Bestmann. An Improved One-pot Procedure for the Synthesis of Alkynes from Aldehydes. Synlett. 1996, s. 521–522. DOI 10.1055/s-1996-5474.
- ↑ G. Roth; B. Liepold; S. Müller; H. J. Bestmann. Further Improvements of the Synthesis of Alkynes from Aldehydes. Synthesis. 2004, s. 59–62. DOI 10.1055/s-2003-44346.
- ↑ Jepsen, T.H, Kristensen, J.L. J. Org. Chem. 2014, "In Situ Generation of the Ohira–Bestmann Reagent from Stable Sulfonyl Azide: Scalable Synthesis of Alkynes from Aldehydes". http://pubs.acs.org/doi/abs/10.1021/jo501803f
- ↑ Lidija Bondarenko; Ina Dix. Cyclophanes. Part LII:1 Ethynyl[2.2]paracyclophanes – New Building Blocks for Molecular Scaffolding. Synthesis. 2004, s. 2751–2759. DOI 10.1055/s-2004-834872.
