Pniktogenovodíky
Pniktogenovodíky jsou kovalentní sloučeniny pniktogenů (prvků 15. skupiny periodické tabulky) s vodíkem.
Trihydridy pniktogenů
[editovat | editovat zdroj]Nejjednodušší příklady mají chemický vzorec XH3, kde X může být libovolný pniktogen. Mají pyramidální molekuly na rozdíl od hydridů trielů, jejichž molekuly jsou rovinného trojúhelníkovitého tvaru. S rostoucím protonovým číslem prvku klesá jejich stabilita a stávají se více toxickými.
Podobně jako halogenovodíky a chalkogenovodíky jsou rozpustné ve vodě. Amoniak je dobře rozpustný a na rozdíl od hydridů ostatních prvků bloku p je jeho roztok zásaditý. Fosfan se také rozpouští ve vodě, arsan a stiban jsou méně rozpustné a rozpustnost bismutanu není známa.
| Sloučenina | Chemický vzorec | Délky a úhly vazeb | Model molekuly |
|---|---|---|---|
azan |
 |
 | |
fosfin |
 |
 | |
arsin |
 |
 | |
stibin |
 |
 | |
bismutin |
 |
 |
| Vlastnost | NH3 | PH3 | AsH3 | SbH3 | BiH3 |
|---|---|---|---|---|---|
| Teplota tání (°C) | −77,8 | −133,5 | −116,3 | −88 | ? |
| Teplota varu (°C) | −34,5 | −87,5 | −62,4 | −18,4 | 16,8 (odhad) |
| Hustota kapaliny (g/cm3) | 0,683 (−34 °C) | 0,746 (−90 °C) | 1,640 (−64 °C) | 2,204 (−18 °C) | ? |
| ΔH ° f /kJ mol−1 |
−46,1 | −9,6 (?) | +66,4 | +145,1 | +277,8 |
| Délka vazby (X–H)/pm | 101,7 | 141,9 | 151,9 | 170,7 | 177,59 |
| Úhel H–X–H | 107,8° | 93,6° | 91,8° | 91,3° | 90,48° |
Zajímavou vlastností těchto sloučenin je, že v čisté podobě nemají žádný zápach, ovšem získávají jej při kontaktu se vzduchem. Amoniak má zápach podobný moči, při jejímž rozkladu také vzniká. Fosfan má zápach jako ryby nebo česnek a stiban jako zkažená vejce, v čemž se podobá sulfanu a selanu.
Tetrahydridy dipniktogenů
[editovat | editovat zdroj]| Sloučenina | Chemický vzorec | Délka vazby | Model molekuly |
|---|---|---|---|
diazan |
 |
 | |
difosfin |
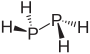 |
 | |
diarsin |
Vlastnosti
[editovat | editovat zdroj]Všechny nasycené pniktogenovodíky mají vzorec XnHn+2.
Amoniak má díky vodíkovým vazbám vysokou teplotu tání a varu, podobně jako voda. 26 % jich zaniká při tání, dalších 7 % při zahřívání k varu a zbylých 67 % u plynného skupenství. Vodíkové vazby také způsobují vysokou dielektrickou konstantu a nízkou hustotu, viskozitu a elektrickou vodivost. S vodou má společné i to, že jde o velmi dobré a často používané rozpouštědlo. Je známo asi 20 dalších sloučenin dusíku a vodíku, z nichž jsou nejvýznamnější hydrazin (N2H4) a azoimid (N3H). Fyzikální vlastnosti hydrazinu jsou podobné jako u vody: teplota tání 2,0 °C a teplota varu 113,5 °C, hustota pevné látky při -5 °C je 1,146 g/cm3 a kapaliny při 25 °C 1,00 g/cm3. Azany tvoří řadu obsahující amoniak, hydrazin a triazan.
Fosfan, toxický bezbarvý plyn, je nejstabilnější hydrid fosforu a první člen homologické řady polyfosfanů PnHn+2 (n = 1-9), které jsou s rostoucím n stále méně stabilní. Jsou známy rovněž jiné série cyklických a kondenzovaných polyfosfanů od PnHn do PnHn-18. Fosfan je silné redukční činidlo nerozpustné ve vodě, rozpustné v sirouhlíku a kyselině trichloroctové.
Arsan, stiban a bismutan jsou vysoce toxické, tepelně nestabilní a bezbarvé plyny. V fosfanu, arsanu, stibanu a bismutanu se nevyskytují vodíkové vazby a tyto látky nedisociují jako amoniak na MH +
4 a MH -
2 (M = P, As, Sb, Bi). S rostoucím protonovým číslem pniktogenu klesá standardní slučovací entalpie, což je v souladu s klesající stabilitou. Arsan se rozkládá na arsen a vodík při teplotě 250-300 °C, stiban na antimon a vodík za pokojové teploty a bismutan už při -45 °C. Arsan a stiban se snadno oxidují na oxid arsenitý/antimonitý a vodu; podobné reakce probíhají u sulfanu a selanu. Reakce s kovy vedou ke vzniku arsenidů a selenidů.
Imidogen, radikál složený z jednoho atomu dusíku a jednoho vodíku (NH), stejně jako diimid (N2H2) lze také řadit mezi pniktogenovodíky.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Pnictogen hydride na anglické Wikipedii.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Pniktogenovodíky na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pniktogenovodíky na Wikimedia Commons
