Dithiolenové komplexy kovů

Dithiolenové komplexy kovů jsou komplexní sloučeniny obsahující alespoň jeden 1,2-dithiolenový ligand. 1,2-dithioleny, patřící spolu s 1,2-diselenoleny mezi 1,2-dichalkogenoleny,[1][2] jsou nenasycené bidentátní ligandy obsahující jako donory dva atomy síry.[3]
Většina molybdenových a wolframových proteinů má v aktivních místech dithiolenové komplexy s molybdopterinovými kofaktory, na které je navázán Mo nebo W.[4]
Dithiolenové komplexy se zkoumají od 60. let 20. století, kdy Gerhard N. Schrauzer a Volker P. Mayweg připravili bis(stilben-1,2-dithiolát) nikelnatý (Ni(S2C2Ph2)2) reakcí sulfidu nikelnatého a difenylacetylenu.[5]
Struktura[editovat | editovat zdroj]
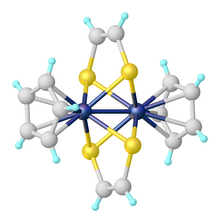
Jsou známy dithiolenové komplexy s jedním, dvěma, i třemi dithiolenovými ligandy. Tris(dithioleny), jako například Mo(S2C2Ph2)3, se staly prvními známými komplexními sloučeninami s trigonálně prizmatickou molekulovou geometrií; tyto struktury byly pozorovány u komplexů několika různých kovů.[6]

Vzhledem k neobvyklým redoxním a optickým vlastnostem je často zkoumána elektronová struktura dithiolenů. 1,2-dithiolenové ligandy mohou mít tři podoby, s rozdílnými oxidačními čísly: dianiontové en-1,2-dithioláty, neutrální 1,2-dithioketony, a monoaniontové radikály, které jsou přechodem mezi těmito dvěma formami.[7] U druhé a třetí uvedené podoby nelze po navázání na kov snadno určit oxidační číslo ligandu (a tedy ani kovu). Substituenty v hlavním řetězci dithiolenu, R a R', ovlivňují vlastnosti vzniklého komplexu předvídatelným způsobem, komplexy s delšími řetězci jsou lépe rozpustné v méně polárních rozpouštědlech. Akceptory elektronů (například kyanidy, CN−, a octany, CH3COO−) stabilizují redukované a aniontové komplexy. Symetrické dithioleny (R = R') jsou častější než nesymetrické.
Vzhledem k delokalizovaným elektronům vstupují 1,2-dithioleny lehce do vratných redoxních reakcí. Oxidované se chovají více jako 1,2-dithioketony, u redukovaných převažují en-1,2-dithioátové struktury.[7] U neutrálních bis(1,2-dithiolenů) dvouvazných iontů přechodných kovů se objevuje diamagnetismus, jako důsledek antiferomagnetického spojování dvou radikálových ligandů.

Hraniční rezonanční struktury C2S2M kruhů u sloučenin typu R2C2S2M; R je obvykle H, CN, nebo organyl.
Použití a výskyt[editovat | editovat zdroj]
1,2-dithiolenové komplexy tvoří molybdopteriny, které jsou součástmi molybdenových a wolframových enzymů.

1,2-dithioleny mají široký okruh využití, od supravodičů, přes lineární a nelineární optiku, po biochemii. V průmyslu se některé dithioleny používají jako barviva v laserech. 1,2-dithiolenové komplexy bývají zkoumány s ohledem na vodivostní]] a magnetické vlastnosti a v nelineární optice. Dithiolenové komplexy s navázanými nenasycenými uhlovodíky na sirná centra mohou být použity při průmyslovém přečišťování alkenů;[9] k jejich praktickému využití je ale potřeba provést další výzkum.[10]
Příprava[editovat | editovat zdroj]
Z alkendithiolátů[editovat | editovat zdroj]
Většina komplexů dithiolenů se připravuje reakcemi 1,2-alkendithiolátů alkalických kovů s halogenidy. K běžně používaným alkendithiolátům patří 1,3-dithiol-2-thion-4,5-dithiolát sodný[11] a maleonitrildithiolát sodný.[12]
- Ni2+ + 2 (NC)2C2S 2−
2 → Ni[S2C2(CN)2] 2−
2
Některé alkendithioláty se připravují těsně před použitím, často složitými organickými reakcemi:
- cis-H2C2(SCH2Ph)2 + 4 Na → cis-H2C2(SNa)2 + 2 NaCH2Ph
Tyto anionty se poté použijí jako ligandy:
- NiCl2 + 2 cis-H2C2(SNa)2 → Na2[Ni(S2C2H2)2] + 2 NaCl
Komplexy bohaté na elektrony se na vzduchu často oxidují:
- 2 [Ni(S2C2H2)2]2− + 4 H+ + O2 → 2 Ni(S2C2H2)2 + 2 H2O
Z acyloinů[editovat | editovat zdroj]
Dithioleny lze také získat reakcemi acyloinů (α-hydroxyketonů), se sulfidem fosforečným, následnou hydrolýzou, a přidáním solí kovů. Takto se připravují například komplexy typu Ni[S2C2Ar2]2 (Ar = aryl).
Z dithietů[editovat | editovat zdroj]
1,2-dithiony nejsou příliš vhodné, lze ale použít jejich valenční izomery, 1,2-dithiety, jako je například destilovatelný 3,4-bis(trifluormethyl)-1,2-dithiet. Tyto elektrofilní sloučeniny se oxidačně adují na na kovy s nízkými oxidačními čísly, za vzniku bis- a tris(dithiolen)ových komplexů.
- Mo(CO)6 + 3 (CF3)2C2S2 → [(CF3)2C2S2]3Mo + 6 CO}}
- Ni(CO)4 + 2 (CF3)2C2S2 → [(CF3)2C2S2]2Ni + 4 CO}}
Ze sulfidů a alkynů[editovat | editovat zdroj]
Sloučeniny odpovídající vzorci Ni[S2C2Ar2]2byly poprvé připraveny reakcemi sulfidu nikelnatého s difenylacetylenem. Novější varianty tohoto postupu využívají elektrofilní acetyleny, jako je dimethylacetylendikarboxylát, a polysulfidové komplexy s dobře určeným složením.
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Metal dithiolene complex na anglické Wikipedii.
- ↑ Anna Pintus; Massimiliano Arca. 1,2-Diselenolene ligands and related metal complexes: Design, synthesis and applications. Coordination Chemistry Reviews. 2022, s. 214444. Dostupné online. ISSN 0010-8545. DOI 10.1016/j.ccr.2022.214444.
- ↑ M. Arca; M. C. Aragoni; A. Pintus. Handbook of Chalcogen Chemistry. [s.l.]: [s.n.], 2013-07-25. Dostupné online. ISBN 978-1-84973-624-4. DOI 10.1039/9781849737463-00127. Kapitola 11.3:1,2‐Dichalcogenolene Ligands and Related Metal Complexes, s. 127-179.
- ↑ K. D. Karlin; E. I. Stiefel. Progress in Inorganic Chemistry, Dithiolene Chemistry: Synthesis, Properties, and Applications. New York: Wiley-Interscience, 2003. ISBN 978-0-471-37829-7.
- ↑ M. J. Romão, M. Archer, I. Moura, J. J. Moura, J. LeGall, R. Engh, M. Schneider, P. Hof, R. Huber. Crystal structure of the xanthine oxidase-related aldehyde oxido-reductase from D. gigas. Science. 1995, s. 1170-1176. DOI 10.1126/science.270.5239.1170. PMID 7502041. Bibcode 1995Sci...270.1170R.
- ↑ G. N. Schrauzer; V. Mayweg. Reaction of Diphenylacetylene with Ni Sulfides. Journal of the American Chemical Society. 1962, s. 3221. DOI 10.1021/ja00875a061.
- ↑ R. Eisenberg; H. B. Gray. Trigonal-prismatic coordination. Crystal and Molecular Structure of Tris (cis-1,2-diphenylethylene-1,2-dithiolato)vanadium. Inorganic Chemistry. 1967, s. 1844-1849. DOI 10.1021/ic50056a018.
- ↑ a b M. C. Aragoni, C. Caltagirone, V. Lippolis, E. Podda, A. M. Slawin, J. D. Woollins, A. Pintus, M. Arca. Diradical Character of Neutral Heteroleptic Bis(1,2-dithiolene) Metal Complexes: Case Study of [Pd(Me2timdt)(mnt)] (Me2timdt = 1,3-Dimethyl-2,4,5-trithioxoimidazolidine; mnt2- = 1,2-Dicyano-1,2-ethylenedithiolate). Inorganic Chemistry. 2020, s. 17385-17401. DOI 10.1021/acs.inorgchem.0c02696. PMID 33185438.
- ↑ A. G. McEwan; J. P. Ridge; C. A. McDevitt; P. Hugenholtz. The DMSO Reductase Family of Microbial Molybdenum Enzymes; Molecular Properties and Role in the Dissimilatory Reduction of Toxic Elements. Geomicrobiology Journal. 2002, s. 3-21. DOI 10.1080/014904502317246138. Bibcode 2002GmbJ...19....3M.
- ↑ K. Wang; E. I. Stiefel. Toward separation and purification of olefins using dithiolene complexes: an electrochemical approach. Science. 2001, s. 106-109. DOI 10.1126/science.291.5501.106. PMID 11141557. Bibcode 2001Sci...291..106W.
- ↑ D. J. Harrison; N. Nguyen; A. J. Lough; U. Fekl. New insight into reactions of Ni(S2C2(CF3)2)2 with simple alkenes: alkene adduct versus dihydrodithiin product selectivity is controlled by [Ni(S2C2(CF3)2)2]- anion. Journal of the American Chemical Society. 2006, s. 11026-11027. DOI 10.1021/ja063030w. PMID 16925411.
- ↑ W. Dietzsch; P. Strauch; E. Hoyer. Thio-oxalates: Their Ligand Properties and Coordination Chemistry. Coordination Chemistry Reviews. 1992, s. 43-130. DOI 10.1016/0010-8545(92)80065-Y.
- ↑ R. H. Holm; A. Davison. Metal Complexes Derived from cis ‐1,2‐dicyano‐1,2‐ethylenedithiolate and Bis(Trifluoromethyl)‐1,2‐dithiete. Inorganic Syntheses. 1967, s. 8-26. ISBN 978-0-470-13241-8. DOI 10.1002/9780470132418.ch3.
- ↑ W. K. Miller; R. C. Haltiwanger; M. C. VanDerveer; M. R. DuBois. Syntheses and structures of new molybdenum complexes with dithiobenzoate and dimercaptotoluene ligands. Structural Comparisons in a Series of Dithiolate-Bridged Dimers of Molybdenum(III). Inorganic Chemistry. 1983, s. 2973-2979. ISBN 978-0-470-13241-8. DOI 10.1021/ic00163a001.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu dithiolenové komplexy kovů na Wikimedia Commons
Obrázky, zvuky či videa k tématu dithiolenové komplexy kovů na Wikimedia Commons

