Prion
Prion, označovaný také jako infekční prionová bílkovina – PrPSc, je odborný název popisující vadnou formu tzv. prionové bílkoviny – PrPc, která se zcela běžně vyskytuje v savčí mozkové tkáni a pravděpodobně se spolupodílí na výkonnosti dlouhodobé paměti. Tyto nakažlivé molekuly jsou poté zodpovědné za vznik transmisivních spongiformních encefalopatií, neboli prionopatií, jejichž ústředními projevy jsou mozečkové poruchy a mimořádně rychle postupující demence. Platí-li tzv. prionová teorie, jsou priony původci celé řady nemocí CNS živočichů (včetně člověka). Priony však hrají úlohu i při dědičných změnách a evoluci.[1]
Prionová teorie
[editovat | editovat zdroj]Prionovou teorii formuloval profesor Stanley B. Prusiner v roce 1982. Ten také poprvé použil slovo prion (původně to měl být proin jakožto kombinace slov proteinaceous a infectious, nicméně prion zněl lépe). Prionovou teorii Prusiner formuloval v souvislosti s hledáním původce Creutzfeldtovy–Jakobovy choroby. Jím objevený prion představuje něco úplně nového. Až do roku 1982 se považovalo za absolutně platné, že infekční nemoci může způsobovat pouze infekční organismus, obsahující nukleovou kyselinu nesoucí genetickou informaci. Prion ovšem žádnou nukleovou kyselinu neobsahuje, je to bílkovina, která se „rozmnožuje“ tím, že mění podobné bílkoviny v organismu. V roce 1997 Stanley B. Prusiner dostal za přínos v této oblasti Nobelovu cenu.
Základ prionové teorie
[editovat | editovat zdroj]Nervové buňky savců obsahují tzv. prionové bílkoviny (v angl. literatuře je častá zkratka PrP, případně PrPC pro zdravou buněčnou bílkovinu). Má se za to, že tyto prionové bílkoviny hrají významnou úlohu při odpočinku a spánku.[2] [zdroj?!] Prion (PrPSC) představuje vadnou formu této normální bílkoviny, od které se odlišuje rozdílnou konformací (prostorovým uspořádáním). Důsledkem této změny konformace je mimořádná odolnost vůči různým fyzikálním vlivům, prakticky absolutní odolnost proti štěpným enzymům odklízejícím vadné bílkoviny a schopnost navazovat se na zdravé formy prionových bílkovin a konvertovat je na svoji vadnou formu. Následkem je, že se v buňce hromadí rostoucí chuchvalce propojených vadných molekul prionové bílkoviny, kterých se buňka nedokáže zbavit, posléze je zcela zaplněna a uhyne.
Předchozí část teorie je obecně přijímána.[zdroj?!] Navazující část je sice přijímána většinou odborníků, nicméně ne absolutně. Ta předpokládá možnost přenosu prionových onemocnění potravou nejen mezi jedinci jednoho druhu (což je též obecně přijímáno – v případě nemoci kuru se to má za dostatečně podložené), ale i mezi jedinci různých druhů, zejména pak se zdůrazňuje přenos ovce (scrapie) – kráva (bovinní spongiformní encefalopatie) a kráva (BSE) – člověk (Nová varianta Creutzfeldtovy–Jakobovy choroby). Zde mají někteří vědci výhrady a nepovažují tuto část teorie za dostatečně prokázanou.[zdroj?!]
K přenosům mezi druhy existuje několik předpokládaných obecností:
- šance na přenos mezi druhy je přímo úměrná podobnosti prionových bílkovin obou druhů
- největší šance na přenos skýtá konzumace mozku či jiných vysoce inervovaných tkání
- masožravci jsou obecně odolnější proti přenosu než býložravci.
Priony jsou odolnější než například bakterie a je třeba je zahřát minuty při teplotách nad 120 °C.[3]
Onemocnění připisovaná prionům
[editovat | editovat zdroj]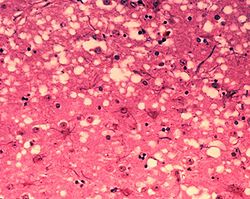
Zvířecí
[editovat | editovat zdroj]- Bovinní spongiformní encefalopatie (BSE) (tzv. nemoc šílených krav)
- Scrapie
- Přenosná encefalopatie norků
- CWD
- Spongiformní encefalopatie koček
Lidská
[editovat | editovat zdroj]- Kuru
- Nová varianta Creutzfeldtovy–Jakobovy choroby
- Gerstmann-Straussler-Scheinkerova choroba
- Fatální familiární insomnie
Léčení
[editovat | editovat zdroj]V nedávné době byl Mathiasem Pfeiferem a několika dalšími německými vědci objeven a ověřen způsob, kterým by se díky RNA interferenci dala prionová onemocnění úspěšně léčit, a to tak, že by se z RNA buněk odstranila část, která je zodpovědná za tvorbu prionových bílkovin, bez kterých se živočich může obejít. Tím by se zabránilo jejich mutaci na nebezpečné priony. S dvoutřetinovou úspěšností vyzkoušeno na laboratorních myších. Experimenty s priony jsou ovšem smrtelně nebezpečné.[4] Předpokládá se využití u zemědělských zvířat, jako jsou ovce a krávy.[5]
Reference
[editovat | editovat zdroj]- ↑ PAZDERA, Josef. Ze zloducha klíčový hráč evoluce. osel.cz [online]. 2012-06-11 [cit. 2022-03-19]. Dostupné online.
- ↑ WULF, Marie-Angela; SENATORE, Assunta; AGUZZI, Adriano. The biological function of the cellular prion protein: an update. S. 34. BMC Biology [online]. 2017-12 [cit. 2022-03-19]. Roč. 15, čís. 1, s. 34. Dostupné online. DOI 10.1186/s12915-017-0375-5. PMID 28464931. (anglicky)
- ↑ Heat resistance of prions and food processing. www.sciencedirect.com [online]. [cit. 2024-09-04]. Dostupné online.
- ↑ MIHULKA, Stanislav. Francie zastavila výzkum prionů poté, co smrtelně onemocněl druhý laborant. 100+1 zahraniční zajímavost [online]. 2021-08-02 [cit. 2022-03-19]. Dostupné online.
- ↑ PETR, Jaroslav. RNA interferencí proti prionům?. osel.cz [online]. 2006-12-02 [cit. 2022-03-19]. Dostupné online.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu prion na Wikimedia Commons
Obrázky, zvuky či videa k tématu prion na Wikimedia Commons - Priony a prionové choroby
