Wikipedie:Lékařské překlady/Multiple sclerosis
| Wikipedie:Lékařské překlady/Multiple sclerosis | |
|---|---|
| Klasifikace | |
| MeSH | D009103 |
Roztroušená skleróza (zkráceně RS), označovaná též jako skleróza multiplex nebo roztroušená encefalomyelitida, je zánětlivé onemocnění, při němž dochází k poškození ochranných obalů nervových buněk v mozku a míše. Jejich poškození pak narušuje komunikační schopnosti různých částí nervové soustavy. To se projevuje širokou škálou příznaků a symptomů,[1][2] například tělesnými projevy, duševním [2] postižením a někdy i psychiatrickými obtížemi.[3] RS může mít různé podoby. Nové příznaky se mohou projevovat jako ojedinělé ataky (tzv. relabující formy) nebo se mohou v průběhu vývoje onemocnění akumulovat (tzv. progresivní formy).[4] V době mezi atakami mohou příznaky úplně odeznít, neurologické potíže ale často přetrvávají zejména s tím, jak se nemoc dále rozvíjí.[4]
Příčina onemocnění není známa, avšak odborníci se domnívají, že jejím spouštěcím mechanismem je buď poškození imunitního systému nebo selhání buněk, které vytvářejí myelin.[5] Jako o příčinách se pak uvažuje o genetických faktorech a faktorech životního prostředí, například infekcích.[2][6] RS je obvykle diagnostikována na základě projevujících se příznaků a symptomů a výsledků podpůrných lékařských testů.
<!—Léčba, prognóza -->
Žádná léčba roztroušené sklerózy není známa. Stávající léčba se tak snaží zlepšit tělesné funkce po atace a zabránit atakám novým.[2] Léky proti roztroušené skleróze jsou sice mírně účinné, avšak mohou mít nežádoucí účinky a pacienti je mohou špatně snášet. Mnozí z pacientů volí také alternativní způsoby léčby, i když nebylo prokázáno, že by byly efektivní. Je obtížné předvídat dlouhodobý výsledek léčby. S dobrými výsledky se častěji setkáváme u žen, pacientů, u nichž onemocnění propukne v raném věku, u pacientů s relabujícím průběhem onemocnění a u těch, kteří z počátku trpí pouze ojedinělými atakami.[7] Očekávaná délka života je o 5 až 10 let kratší než u populace nemocí nezasažené.[1]
V roce 2008 trpělo tímto onemocněním na celém světě 2 až 2,5 miliónu lidí se značnými rozdíly ve výskytu mezi regiony a populacemi.[8] Onemocnění obvykle začíná mezi 20. a 50. rokem věku a vyskytuje se dvakrát častěji u žen než u mužů.[9] Název roztroušená skleróza odkazuje na jizvy (sclerae-—známé spíše jako plaky nebo léze) zejména v bílé hmotě mozku a míchy.[10] Poprvé popsal RS v roce 1868 Jean-Martin Charcot.[10] V současné době je ve vývoji několik nových způsobů léčby a diagnostických metod.
Příznaky a symptomy[editovat | editovat zdroj]

Pacient s RS může trpět téměř jakýmikoli neurologickými příznaky nebo symptomy. Nejčastější bývají autonomní, vizuální, motorické a senzorické problémy.[1] Výskyt konkrétních příznaků závisí na tom, v které části nervové soustavy se nacházejí léze. Může se jednat například o ztrátu citlivosti nebo změnu citlivosti jako brnění, mravenčení nebo palčivou bolest, slabost svalů, velmi výrazné reflexy, svalové křeče nebo potíže při pohybu, problémy s koordinací a rovnováhou (ataxie); dále i o problémy s řečí nebo potíže s polykáním, zrakové potíže (nystagmus, optickou neuritidu nebo dvojité vidění), pocit únavy, akutní nebo chronickou bolest, potíže s močením a stolicí a mnohé další.[1] Časté jsou rovněž obtíže s myšlením a emocionální poruchy jako například deprese nebo výkyvy nálady.[1] Velmi typické jsou pro RS také Uhthoffův fenomén, jak nazýváme zhoršení příznaků v důsledku působení vyšších než obvyklých teplot, a Lhermittův příznak, což je pocit elektrické vlny šířící se po předklonu hlavy po zádech směrem dolů.[1] Hlavním měřítkem míry a závažnosti postižení je rozšířená stupnice stavu postižení (EDSS). Ve výzkumu se stále častěji používají i další měřítka jako například souhrn funkčních testů pro RS zvaný MSFC.[11][12][13]
V 85 % případů se onemocnění začíná projevovat jako klinicky izolovaný syndrom přetrvávající několik dnů. 45 % pacientů mívá motorické nebo senzorické potíže, 20 % trpí optickou neuritidou a u 10 % z nich se projevují příznaky související s poruchou funkce mozkového kmene. Zbývajících 25 % trpí několika z výše uvedených potíží současně.[14] V počáteční fázi se příznaky objevují podle jednoho ze dvou hlavních vzorců. Buď se jedná o příhody náhlého zhoršení stavu, které trvají několik dnů až měsíců (tzv.relapsy, exacerbace, záchvaty nebo ataky), po nichž následuje zlepšení stavu (v 85 % případů), nebo se onemocnění časem postupně zhoršuje bez fází zlepšení (v 10 až 15 % případů).[9] Existuje i kombinace obou těchto vzorců[4], případně může onemocnění probíhat nejprve formou relapsů s následným zlepšením stavu a později se rozvinout do progresivní formy.[9] Relapsy obvykle není možné předvídat, neboť přicházejí bez varovných příznaků.[1] Ke zhoršení onemocnění jenom vzácně dochází častěji než dvakrát za rok.[1] Někdy však může relapsu předcházet běžný spouštěcí mechanismus. Výskyt relapsů je častější na jaře a v létě.[15] Riziko relapsu mohou zvyšovat také virové infekce jako například nachlazení, chřipka nebo gastroenteritida. [1] Spouštěcím mechanismem ataky může být rovněž stres.[16] Těhotenství naopak riziko relapsu snižuje, to se však znovu zvyšuje během prvních měsíců po porodu.[1] Celkově se zdá, že na dlouhodobé postižení nemá těhotenství žádný vliv.[1] U mnoha jevů a stavů, jako je například očkování, kojení,[1] fyzické trauma[17] nebo Uhthoffův fenomén, se naopak neprokázalo, že by četnost relapsů zvyšovaly.[15]
Příčiny[editovat | editovat zdroj]
Příčina RS není známá, odborníci se ale domnívají, že onemocnění je důsledkem jistých kombinací faktorů životního prostředí, například infekčních původců, a genetických faktorů.[1] Existují různé teorie, které se snaží formulovat pravděpodobná vysvětlení na základě kombinace dostupných údajů, avšak žádná z nich nebyla dosud prokázána s konečnou platností. I když je známo několik rizikových faktorů souvisejících s životním prostředím, z nichž některé můžeme částečně ovlivnit, je nezbytný další výzkum, který by potvrdil, zda vyloučení těchto faktorů může vzniku RS zabránit.[18]
Geografie[editovat | editovat zdroj]
RS je častější u populací, které žijí dále od rovníku, avšak existují výjimky.[1][19] Takovými výjimkami jsou nízkorizikové etnické skupiny žijící daleko od rovníku, napříkladSámové, Indiáni, kanadští Hutterité, novozélandští Maorové[20] a kanadští Inuité[9] a rovněž skupiny žijící blízko rovníku, u nichž je riziko poměrně vysoké, například Sardiňané,[9] Palestinci nebo Pársové.[20] Příčina tohoto geografického rozložení není příliš jasná.[9] I když severojižní gradient výskytu slábne,[19] v roce 2010 ještě stále existoval.[9]
RS je častější v regionech se severoevropskou populací[1]. Geografické rozdíly tak mohou jednoduše odrážet globální rozložení této vysoce rizikové populace.[9] Jako jedno z možných vysvětlení bývá uváděno také menší vystavení slunečnímu záření, které vede k omezení tvorby vitaminu D.[21][22] Tuto domněnku potvrzuje i souvislost mezi ročním obdobím narození a RS. Osoby na severní polokouli, které se narodily v listopadu, postihuje onemocnění během života v menší míře než osoby narozené v květnu.[23] V dětství mohou hrát jistou roli také faktory životního prostředí. V několika studiích bylo zjištěno, že u lidí, kteří se přestěhovali do jiného regionu světa před 15. rokem věku, odpovídá riziko onemocnění RS míře obvyklé v novém regionu. Pokud se ale přestěhují až po 15. roku věku, zůstává u nich riziko ve stejné míře jako v jejich rodné zemi.[1][18] Podle některých důkazů je ale možné, že vliv přestěhování trvá i po 15. roce věku.[1]
Genetika[editovat | editovat zdroj]

RS není považována za dědičnou chorobu, avšak bylo prokázáno, že riziko onemocnění zvyšují některé genetické variace .[24] Pravděpodobnost onemocnění je vyšší u příbuzných postižené osoby, přičemž vyšší riziko je u bližších příbuzných.[2] V případě jednovaječných dvojčat bývají obě dvojčata postižena zhruba ve 30 % případů, u nejednovaječných dvojčat to bývá kolem 5 % a u sourozenců 2,5 %. U nevlastních sourozenců bývá toto procento ještě nižší.[1][2][25] Jsou-li postiženi oba rodiče, je riziko u jejich dětí desetkrát vyšší než u běžné populace.[9] RS je také častější v některých etnických skupinách.[26]
Ke konkrétním genům spojovaným s RS patří například lidské leukocytární antigeny (HLA) a rozdíly v jejich systému. HLA je skupina genů na chromozomu 6, která působí jako hlavní histokompatibilitní komplex (MHC).[1] To, že změny v oblasti HLA souvisejí s náchylností k onemocnění, je známo už déle než třicet let.[27]. Stejná oblast se podílí i na rozvoji dalších autoimunitních onemocnění jako například diabetu 1. typu nebo systémového lupus erythematodes.[27] Nejpřesvědčivějším zjištěním je souvislost mezi roztroušenou sklerózou a alelami MHC definovanými jako DR15 a DQ6.[1] U některých lokusů (pozic na chromozomu) bylo zjištěno, že mají naopak ochranný účinek, například HLA-C554 nebo HLA-DRB1*11.[1] Celkově se odhaduje, že změny v systému HLA se podílejí na genetické dispozici z 20 až 60 %.[27] Moderními genetickými metodami (celogenomové asociační studie) se podařilo odhalit dalších minimálně dvanáct genů mimo lokus, které mírně zvyšují pravděpodobnost vzniku RS.[27]
Infekční původci[editovat | editovat zdroj]
Pokud jde o spouštěcí mechanismy RS, uvažuje se o různých druzích mikrobů, u žádného z nich to však nebylo potvrzeno.[2] Přestěhuje-li se člověk v raném věku do jiné oblasti světa, změní se tím u něj i pozdější míra rizika onemocnění RS.[6] Jedním z vysvětlení může být, že s onemocněním souvisí určitá infekce způsobovaná mikrobem, který je v daném regionu běžně rozšířený, v jiném ale vzácný.[6] V úvahu by mohly přicházet dva mechanismy - hygienická hypotéza a hypotéza prevalenční. Hygienická hypotéza vychází z toho, že vystavení určitým infekčním původcům v rané fázi života má ochranný účinek, a onemocnění je tedy reakcí na vystavení těmto původcům až v pozdějším životním období.[1] Podle prevalenční hypotézy je onemocnění způsobováno infekčním původcem častěji v oblastech, kde je RS běžná a kde většina lidí trpí průběžnou infekcí bez příznaků. K demyelinizaci dochází pouze v ojedinělých případech a až po mnoha letech.[6][28] Hygienická hypotéza má více zastánců než hypotéza prevalenční.[6]
O virech jako možné příčině onemocnění svědčí různé důkazy, například přítomnost oligoklonálních proužků v mozku a mozkomíšním moku většiny lidí s RS, souvislost některých virů s lidskou demyelinizující encefalomyelitidou nebo výskyt demyelinizace u zvířat způsobovaný některými virovými infekcemi.[29] Potenciální skupinou virů způsobujících onemocnění jsou také lidské herpes viry. U jedinců, kteří nebyli nikdy infikováni virem Epstein-Barrové, je riziko onemocnění RS nižší, u osob infikovaných v dospívání je naopak riziko onemocnění vyšší než u těch, kdo byli infikováni v mladším věku.[1][6] I když se někteří odborníci domnívají, že tato skutečnost je v rozporu s hygienickou hypotézou, protože ve výchově nenakažených jedinců byl pravděpodobně kladen větší důraz na hygienu,[6] jiní odborníci v tom naopak žádný rozpor nevidí, neboť spouštěcím mechanismem onemocnění je první setkání s virem, který ho způsobuje, až v poměrně pozdní fázi života.[1] S RS mohou souviset i některá další onemocnění, například spalničky, příušnice nebo zarděnky.[1]
Jiné[editovat | editovat zdroj]
Bylo prokázáno, že nezávislým rizikovým faktorem pro vznik RS je kouření.[21] Rizikovým faktorem může být také stres, avšak důkazy na podporu této domněnky jsou slabé.[18] Byla rovněž zkoumána souvislost s riziky v pracovním prostředí a s toxiny, zejména rozpouštědly, avšak dosud nebyly učiněny žádné jasné závěry.[18] Jako příčinné faktory byly zkoumány také vakcíny, ve většině studií se ale žádná souvislost neprokázala.[18] Výzkum se zaměřuje i na některé další možné rizikové faktory jako například stravu a příjem hormonů ve stravě, avšak důkazy o souvislosti s onemocněním jsou „ojedinělé a nepřesvědčivé“.[21] Oproti očekávání byl u osob s MS zaznamenán nižší výskyt dny a také nižší hladina kyseliny močové. To vedlo ke vzniku teorie, že kyselina močová má ochranný účinek, avšak přesný význam tohoto zjištění je zatím neznámý.[30]
Patofyziologie[editovat | editovat zdroj]
Ke třem hlavním charakteristickým rysům RS patří tvorba lézí v centrální nervové soustavě (označovaných také jako plaky), zánět a destrukce myelinové pochvy neuronů. Tyto jevy se navzájem složitě a dodnes ne zcela plně pochopeným způsobem ovlivňují a vyvolávají rozpad nervové tkáně, který pak způsobuje symptomy a příznaky onemocnění.[1] RS je rovněž považována za imunitně zprostředkované onemocnění, které je vyvoláváno interakcí genetických faktorů daného jedince s dosud neidentifikovanými příčinami v jeho životním prostředí.[2] Má se za to, že poškození je alespoň částečně způsobováno vlastním imunitním systémem nemocného, který útočí na nervovou soustavu.[1]
Léze[editovat | editovat zdroj]

Název roztroušená skleróza odkazuje na jizvy (sclerae, častěji plaky nebo léze), které se tvoří v nervové soustavě. Léze nejčastěji postihují bílou hmotu ve zrakovém nervu, mozkovém kmenu, bazálních gangliích a míše, případně dráhy bílé hmoty nacházející se v blízkosti mozkových komor.[1] Funkcí buněk bílé hmoty je přenášet signály mezi oblastmi šedé hmoty, kde se signály zpracovávají, a ostatními částmi organismu. Vzácně postihují také periferní nervovou soustavu.[2]
Konkrétněji je s RS spojován zánik oligodendrocytů. To jsou buňky odpovědné za vytváření a udržování tukové vrstvy, odborně myelinové pochvy, jež pomáhá neuronům přenášet elektrické signály (akční potenciály neboli nervové impulzy).[1] Zánik těchto buněk vede ke ztenčování nebo úplnému zániku myelinové vrstvy. S tím, jak nemoc postupuje, dochází k rozpadu axonů v neuronech. Bez myelinu už neuron nedokáže účinně přenášet elektrické signály.[2] V raném stádiu onemocnění dochází k opravnému procesu, tzv. remyelinizaci, avšak oligodendrocyty nejsou schopny myelinovou pochvu buňky obnovit úplně.[31] Opakující se ataky způsobují, že remyelinizace je stále méně účinná, až se kolem poškozených axonů vytvoří plak podobný jizvě.[31] Tyto jizvy jsou původcem příznaků. Vyšetření magnetickou rezonancí (MR) během ataky často odhalí i více než deset nových plaků.[1] To by mohlo znamenat, že do určitého počtu lézí je mozek schopen opravit postižená místa sám bez patrných následků.[1] Dalším procesem, který se podílí na tvorbě lézí, je abnormální zvýšení počtu astrocytů v důsledku zániku okolních neuronů.[1] Popsáno bylo několik různých vzorců lézí.[32]
Zánět[editovat | editovat zdroj]
Vedle demyelinizace je další známkou onemocnění zánět. V souladu s imunologickým vysvětlením je zánětlivý proces způsobován T lymfocyty. To je druh lymfocytů, který hraje důležitou roli v obranyschopnosti organismu.[2] T-lymfocyty pronikají do mozku v místech, kde je porušena hematoencefalická bariéra. Myelin považují za cizí látku a útočí na něj. Proto se těmto buňkám říká také autoreaktivní lymfocyty.[1]
Útok na myelin spustí zánětlivé procesy, které aktivují další imunitní buňky a uvolní rozpustné faktory jako cytokiny a protilátky. Pokračující rozpad hematoencefalické bariéry pak vyvolává různé další škodlivé účinky jako například otoky, aktivaci makrofágů nebo další aktivaci cytokinů a jiných ničivých proteinů.[2] Zánět může potenciálně omezovat přenos informací mezi neurony přinejmenším třemi různými způsoby.[1] Uvolňované rozpustné faktory mohou přerušit přenos nervových impulzů mezi nedotčenými neurony. Tyto faktory mohou způsobovat nebo umocňovat ztrátu myelinu a je také možné, že způsobují úplný rozpad axonů.[1]
Hematoencefalická bariéra je součástí soustavy vlásečnic, která brání pronikání T-lymfocytů do centrální nervové soustavy. Ta se pak může stát propustnou nejen pro infekci způsobovanou viry nebo bakteriemi, ale i pro tento typ buněk. Když se bariéra sama opraví, což bývá zpravidla po odeznění infekce, může se stát, že T-lymfocyty zůstanou v mozku, protože už bariérou neprojdou.[2]
Diagnóza[editovat | editovat zdroj]

Roztroušená skleróza je zpravidla diagnostikována na základě projevujících se symptomů a příznaků v kombinaci s podpůrnými výsledky zobrazovacích technik a laboratorních testů.[14]Zejména v počátečních stadiích může být obtížné onemocnění potvrdit, neboť se může projevovat podobnými symptomy a příznaky jako jiné zdravotní potíže.[1][33] Nejpoužívanější diagnostickou metodou jsou tzv. McDonaldova kritéria, která se zaměřují na klinický, laboratorní a radiologický průkaz lézí v čase a v různých oblastech. [8]Tato nová metoda už většinou nahradila v minulosti používaná Schumacherova a Poserova kritéria.[34] Uvedená kritéria umožňují neinvazivní diagnózu onemocnění, někteří odborníci ale tvrdí, že jediným spolehlivým průkazem je pitva nebo biopsie, při níž jsou zjištěny léze typické pro RS.[1][35][36]
Pokud pacient prodělal několik samostatných příhod s neurologickými příznaky, které jsou pro onemocnění charakteristické, mohou ke stanovení diagnózy postačovat pouze klinické údaje.[35] U pacientů, kteří vyhledají lékaře po jediné atace, je ale nutné provést další testy ke stanovení diagnózy. Nejpoužívanějšími diagnostickými nástroji jsou neurozobrazovací techniky, analýza mozkomíšního moku a evokované potenciály. Demyelinizované oblasti (léze nebo plaky) mohou být patrné na snímku mozku a míchy pořízeném magnetickou rezonancí. Jako kontrastní látku ke zvýraznění aktivních plaků lze nitrožilně podávat gadolinium. Takto je zároveň možné vylučovací metodou prokázat existenci historických lézí, které nesouvisejí s příznaky v okamžiku vyšetření.[35][37] Testy mozkomíšního moku získaného lumbální punkcí mohou prokázat chronický zánět v centrální nervové soustavě. Mozkomíšní mok se pomocí elektroforézy testuje na přítomnost oligoklonálních proužků imunoglobulinu G. To jsou zánětové markery, které se vyskytují u 75 až 85 % jedinců s RS.[35][38] Nervová soustava postižená RS může také méně aktivně reagovat na stimulaci zrakového nervu a senzorických nervů kvůli demyelinizaci těchto signálních drah. Reakce mozku lze zkoumat na základě evokovaných potenciálů na zrakový a senzorický podnět.[39]
Klinický průběh[editovat | editovat zdroj]
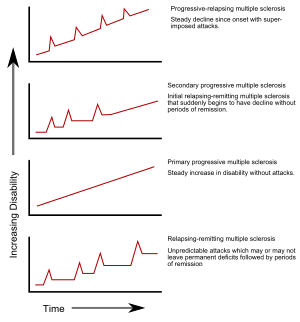
Popsáno bylo již několik podtypů progrese roztroušené sklerózy. Tyto podtypy využívají dřívějšího průběhu onemocnění k prognóze jeho průběhu budoucího. Důležité jsou nejen z tohoto důvodu, ale také kvůli rozhodování ohledně dalších léčebných postupů. V roce 1996 popsala americká Národní společnost pro roztroušenou sklerózu čtyři typy klinického průběhu onemocnění:[4]
- relabující-remitentní,
- sekundárně progresivní,
- primárně progresivní a
- progresivně relabující.
Relabující-remitentní podtyp je charakteristický nepředvídatelnými relapsy následovanými měsíci až roky poměrně klidné (remise) bez dalších nových příznaků onemocnění. Poruchy funkcí, které se projevují během záchvatů, mohou buď odeznít nebo zanechat problémy, přičemž k druhé možnosti dochází u přibližně 40 % atak a je tím pravděpodobnější, čím déle osoba onemocněním trpí.[1][14] Podobný počáteční průběh nemoci byl zaznamenán u 80 % osob s RS.[1] Stav, kdy potíže mezi záchvaty odezní, se někdy označuje jako benigní RS,[40] ačkoli z dlouhodobého hlediska se u nemocných stále určitý stupeň postižení akumuluje.[1] Výraz maligní roztroušená skleróza se naopak používá k popisu roztroušené sklerózy, která způsobí výraznou úroveň postižení v krátkém časovém období.[41] Relabující-remitentní podtyp obvykle začíná klinicky izolovaným syndromem (CIS). V případě CIS trpí nemocný atakami poukazujícími na demyelinizaci, avšak nesplňuje kritéria stanovená pro roztroušenou sklerózu.[1][42]Ke vzniku RS v pozdějším období dojde u osob s CIS v 30 až 70 % případů.[42]

Sekundárně progresivní RS se objevuje u přibližně 65 % osob s počáteční relabující-remitentní RS, které mezi akutními záchvaty prodělávají progresivní neurologický útlum bez zřejmých období remise.[1][4] Mohou se objevit příležitostné relapsy a menší remise.[4] Nejběžnějším časovým úsekem mezi počátkem onemocnění a přechodem z relabující-remitentní na sekundárně progresivní RS je 19 let.[43]
Primárně progresivní podtyp se objevuje u přibližně 10–20 % nemocných, u kterých po projevu počátečních symptomů nedošlo k remisi.[44][14] Tento podtyp je charakteristický progresí potíží a invalidity od samého počátku onemocnění bez jakýchkoliv či pouze minimálních remisí a zlepšení.[4] Obvyklý věk pacienta v době počátku primárně progresivního podtypu RS je vyšší než u relabujícího-remitentního podtypu. Podobně je tomu i tehdy, když relabující-remitentní RS přechází do sekundárně progresivního typu, což je okolo 40 let věku.[1]
Progresivně relabujícím podtypem RS trpí osoby, jejichž nervové funkce se od počátku onemocnění neustále zhoršují, ale které zároveň trpí jasnými mnohačetnými atakami. Tento podtyp je ze všech podtypů nejméně běžný.[4]
V rámci RS byly popsány i neobvyklé typy RS; patří mezi ně Devicova choroba, Balóova koncentrická skleróza, Schilderova difuzní skleróza a Marburgská roztroušená skleróza. Často je diskutováno, zda jsou tyto typy variantami RS nebo již odlišnými onemocněními.[45] Roztroušená skleróza se u dětí projevuje jinak - trvá déle, než se dostane do progresivní fáze .[1] I přesto však dětští pacienti dosahují této fáze v nižším průměrném věku než dospělí.[1]
Léčba[editovat | editovat zdroj]
Ačkoliv na roztroušenou sklerózu neexistuje žádný lék, některé terapie se zdají napomáhat zlepšení stavu. Primárním cílem léčby je opětovný návrat funkcí po atace, předcházení novým atakám a prevence invalidity. Tak jako u jakékoli jiné léčby mají i léky používané k léčbě RS řadu nežádoucích účinků. Někteří pacienti podstupují alternativní způsoby léčby navzdory nedostatku podpůrných důkazů.
Akutní ataky[editovat | editovat zdroj]
Během symptomatických záchvatů jsou běžnou léčbou vysoké dávky nitrožilně podávaných kortikosteroidů, jako je například metylprednisolon; [1] orálně podávané kortikosteroidy se zdají mít podobnou účinnost a bezpečnostní profil.[46] Ačkoli je léčba kortikosteroidy krátkodobě efektivní a zmírňuje symptomy, na dlouhodobé zlepšení stavu pravděpodobně nemá výrazný vliv.[47] Důsledky silných atak, které nezlepší podání kortikosteroidů, je možné léčit plazmaferézou.[1]
Léčebné postupy ovlivňující přirozený průběh nemoci[editovat | editovat zdroj]
Relabující-remitentní roztroušená skleróza[editovat | editovat zdroj]
Pro léčbu relabující-remitentní roztroušené sklerózy (RRMS) bylo regulačními orgány schváleno osm léčebných prostředků, jimiž jsou interferon beta-1a, interferon beta-1b, glatiramer acetát, mitoxantron, natalizumab, fingolimod,[48] teriflunomid[49] a dimethyl-fumarát.[50] Jejich cenová efektivita však byla k roku 2012 nejasná.[51]
U RRMS jsou tyto prostředky z hlediska snížení počtu záchvatů mírně efektivní.[48] Interferony a glatiramer acetát jsou základním způsobem léčby[14] a jsou zhruba rovnocenné – oba snižují počet relapsů o přibližně 30 %.[52] Včasně zahájená dlouhodobá léčba je bezpečná a zlepšuje výhled do budoucna.[53][54] Natalizumab snižuje počet relapsů výrazněji než uvedené prvořadé léčebné látky; přesto je však v důsledku problémů s nežádoucími účinky až druhou volbou určenou pro ty, u kterých jiná léčba nefunguje, [14] nebo pro osoby s vážnou formou onemocnění.[52] Mitoxantron, jehož použití je omezeno vážnými nežádoucími účinky, je až třetí možností pro nemocné, u kterých ostatní druhy léčby nezabírají.[14] Léčba klinicky izolovaného syndromu (CIS) pomocí interferonů snižuje pravděpodobnost jeho progrese ke klinické RS.[1][55] Podle odhadů je účinnost interferonů a glatiramer acetátu u dětí zhruba stejná jako u dospělých.[56] Role některých novějších přípravků, jako je například fingolimod, teriflunomid a dimethyl-fumarát, nebyla k roku 2011 zcela jasná.[57]
Progresivní roztroušená skleróza[editovat | editovat zdroj]
Průběh primárně progresivní RS nezměnil doposud žádný léčebný postup ani přípravek[14] a pro léčbu sekundárně progresivní RS byl k roku 2011 schválen pouze jediný lék, mitoxantron.[58] Předběžné důkazy dokládají, že mitoxantron mírně zpomaluje progresi onemocnění a snižuje počet relapsů v průběhu dvou let.[59][60]
Nežádoucí účinky[editovat | editovat zdroj]

Léčebné postupy ovlivňující přirozený průběh nemoci mají řadu nežádoucích účinků. Jedním z nejběžnějších je podráždění v místě vpichu u glatiramer acetátu a interferonů (až u 90 % případů podkožních injekcí a u 33 % nitrosvalových injekcí).[61] V průběhu času se v okolí místa vpichu může objevit viditelná prohlubenina vzniklá v důsledku místního poškození tukové tkáně, známého jako lipoatrofie.[61] Interferony mohou vyvolat chřipce podobné symptomy;[62] některé osoby užívající glatiramer mohou pocítit post-injekční reakci projevující se návaly horka, svíráním na hrudi, bušením srdce, dušností a pocity úzkosti, které obvykle netrvají déle než třicet minut.[63] Nebezpečnější, ale mnohem vzácnější je poškození jater interferony,[64] systolická dysfunkce (12 %), neplodnost a akutní myeloidní leukémie (0,8 %) při užívání mitoxantronu[59][65] a progresivní multifokální leukoencefalopatie (PML) při užívání natalizumabu (objevuje se u 1 z 600 léčených osob).[14][66]
Fingolimod může vést k vysokému krevnímu tlaku a bradykardii, makulárnímu edému, zvýšené hladině jaterních enzymů nebo snížení hladiny lymfocytů.[67] Předběžné důkazy se vyslovují ve prospěch krátkodobé bezpečnosti teriflunomidu s běžnými nežádoucími účinky, mezi které patří bolesti hlavy, únava, nauzea, vypadávání vlasů a bolesti končetin.[48] V souvislosti s jeho užíváním rovněž existují i záznamy o selhání jater a PML; může být také nebezpečný pro vývoj plodu.[67] Nejběžnějšími nežádoucími účinky dimethyl-fumarátu jsou návaly horka a gastrointestinální problémy.[50][67] Ačkoli dimethyl-fumarát může vést ke snížení počtu bílých krvinek, nebyly během klinických hodnocení hlášeny žádné případy oportunních infekcí.[68][69]
Přidružené symptomy[editovat | editovat zdroj]
Jak léky, tak neurorehabilitace prokazatelně zlepšují některé symptomy, nikoli však průběh onemocnění.[70] Některé ze symptomů, například nestabilita močového měchýře a spasticita, na léčbu léky reagují dobře, zatímco jiné doznávají jen malých změn.[1] Pro zlepšení kvality života je v souvislosti s neurologickými problémy důležitý multidisciplinární přístup; určit „základní tým“ je však obtížné, neboť v různých časových úsecích může být potřebná účast mnoha zdravotnických odborníků.[1] Multidisciplinární rehabilitační programy zvyšují aktivitu a zapojení osob s RS do běžného života, neovlivňují však úroveň postižení.[71] Pro celkovou účinnost individuálních terapeutických disciplín existují pouze omezené důkazy,[72][72][73] bylo však jasně prokázáno, že specifické přístupy, jako je například cvičení[74][75] a psychologické terapie, obzvláště kognitivně behaviorální přístupy, jsou efektivní.[76]
Alternativní způsoby léčby[editovat | editovat zdroj]
Více než 50 % osob trpících RS pravděpodobně využívá doplňkové a alternativní způsoby léčby, ačkoli procentuální podíl závisí na tom, jak je alternativní léčba definována.[77] Potvrzení účinnosti těchto léčebných postupů a prostředků jsou ve většině případů nedostatečná nebo zcela chybí.[77][78] Ačkoli existují předběžné důkazy o tom, že významnou roli může hrát vitamin D, toto tvrzení zatím není pro definitivní závěr dostatečně podloženo.[79] Mezi způsoby léčby bez prokázaného užitku pro osoby s RS patří různé doplňky stravy a úprava životosprávy,[77][80][81] relaxační techniky jako například jóga,[77] bylinné léčivé přípravky (včetně lékařského použití konopí),[77][82] přetlaková kyslíková terapie,[83] kontrolované sebenakažení tenkohlavcem prasečím , reflexologie a akupunktura.[77][84] Alternativní léčebné postupy a prostředky využívají častěji ženy, nemocní, kteří trpí RS již delší dobu, pacienti s vyšším stupněm postižení a ti, kdo jsou méně spokojeni s konvenční zdravotnickou péčí.[77]
Prognóza[editovat | editovat zdroj]

Očekávaný průběh onemocnění v budoucnosti závisí na jeho podtypu, pohlaví a věku nemocného, počátečních symptomech a úrovni postižení pacienta.[7] Lepší průběh onemocnění je obvykle spojován s ženským pohlavím, relabujícím-remitentním podtypem nemoci, zánětem zrakového nervu nebo senzorickými symptomy na počátku nemoci, malým množstvím atak v počátečních letech choroby a zejména nízkým věkem na počátku onemocnění.[7][85]
Průměrná předpokládaná délka života je 30 let od počátku onemocnění, tedy o 5 až 10 let nižší než u zdravých osob.[1] Téměř 40 % osob trpících RS se dožije sedmé dekády věku.[85] Dvě třetiny úmrtí však přímo souvisí s důsledky onemocnění.[1] Sebevražda je běžnější než u zdravé populace, přičemž infekce a další komplikace jsou u osob s vyšším stupněm postižení obzvláště nebezpečné.[1] Ačkoli většina nemocných před smrtí ztratí schopnost chodit, 90 % z nich je schopno samostatné chůze ještě po 10 letech od začátku onemocnění a 75 % po 15 letech.[85][86]
Epidemiologie[editovat | editovat zdroj]
Počet osob s RS dosáhl roku 2010 celosvětově 2-2,5 miliónu (přibližně 30 na 100 000 obyvatel); počet nemocných v různých regionech se však velmi liší.[8][9] Odhaduje se, že v uvedeném roce měla RS za následek 18 000 úmrtí.[87] V Africe je počet osob s RS nižší než 0,5 na 100 000 obyvatel, zatímco v jihovýchodní Asii je to 2,8 na 100 000 obyvatel, v Jižní a Severní Americe 8,3 na 100 000 obyvatel a v Evropě 80 na 100 000 obyvatel.[8] U některých severoevropských populací překračuje počet osob s RS 200 na 100 000 obyvatel.[9] Počet nových případů onemocnění za rok je přibližně 2,5 na 100 000 obyvatel.[8]
Zdá se, že počet případů RS se zvyšuje, to však může být jednoduše vysvětleno lepšími možnostmi diagnózy.[9] Byl proveden nespočet studií populačních a geografických vzorců[28] vedoucích ke vzniku řady teorií o příčině onemocnění.[6][18][21]
RS se obvykle objevuje u dospělých osob mezi 25 a 35 lety věku, vzácně to však může být i v dětství a po 50. roce života.[8][9] Primárně progresivní podtyp je běžnější u padesátníků.[44] Podobně jako u mnoha autoimunitních poruch je onemocnění běžnější u žen, přičemž tento trend může ještě zesilovat.[1][19] K roku 2008 bylo onemocnění globálně přibližně dvakrát běžnější u žen než u mužů;[8] u dětí je tento rys ještě výraznější.[1] U dospělých starších padesáti let postihuje nemoc ženy a muže téměř rovnocenně.[44]
Historie[editovat | editovat zdroj]
Lékařský objev[editovat | editovat zdroj]

Francouzský neurolog Jean-Martin Charcot (1825–1893) byl prvním člověkem, který v roce 1868 charakterizoval roztroušenou sklerózu jako samostatné onemocnění.[88] Po shrnutí předchozích zpráv a po doplnění svých vlastních klinických a patologických pozorování Charcot chorobu nazval sclerose en plaques. Třemi příznaky RS, dnes známými jako Charcotova triáda, jsou nystagmus, intenční třes a skandovaná řeč. Tyto příznaky však nemusí souviset pouze s RS. Charcot si rovněž povšiml kognitivních změn a u svých pacientů identifikoval „znatelné oslabení paměti“ a „pomalé utváření myšlenek“.[10]
Před Charcotem popsali a ilustrovali mnohé z klinických detailů nemoci Robert Carswell (1793–1857), britský profesor patologie, a Jean Cruveilhier (1791–1873), francouzský profesor patologické anatomie, neidentifikovali je však jako samostatné onemocnění.[88] Carswell konkrétně popsal poranění, jež objevil, jako „nápadnou lézi na míše doprovázenou atrofií“.[1] Švýcarský patolog Georg Eduard Rindfleisch (1836–1908) si v roce 1863 pod mikroskopem povšiml, že se zánětem spojované léze se tvoří kolem cév.[89][90] Během 20. století pak vznikly teorie o příčině a patogenezi onemocnění, přičemž účinné léky se začaly objevovat v 90. letech 20. století.[1]
Historické případy[editovat | editovat zdroj]

. Bylo zaznamenáno několik historických případů osob, které žily před a krátce po stanovení onemocnění popsaného Charcotem a které pravděpodobně trpěly RS.
Mladá žena jménem Halldora, žijící na Islandu kolem roku 1200, náhle ztratila zrak a schopnost pohybu, ale po modlitbě k bohům se jí po sedmi dnech zrak a schopnost chůze vrátily. Svatá Lidwina ze Schiedamu (1380–1433), holandská jeptiška, by mohla být jednou z prvních jasně identifikovatelných osob s RS. Od 16 let až do své smrti ve věku 53 let trpěla občasnými bolestmi, slabostí dolních končetin a ztrátou zraku—- symptomy typickými pro RS.[91] Oba případy vedly k předložení hypotézy nazvané hypotéza vikinského genu, která měla být vysvětlením šíření nemoci.[92]
Téměř jistě trpěl RS i Augustus Frederick d'Este (1794–1848), syn prince Augusta Fredericka, vévody sussexského a lady Augusty Murrayové a vnuk anglického krále Jiřího III.. D'Este po sobě zanechal podrobný deník popisující 22 let života s tímto onemocněním. Jeho deník začíná v roce 1822 a končí v roce 1846, ačkoli do roku 1948 zůstal neznámý. Augustovy symptomy se začaly projevovat ve věku 28 let náhlou krátkodobou ztrátou zraku (amaurosis fugax) po pohřbu přítele. V průběhu onemocnění se u něj rozvinula slabost dolních končetin, nemotornost rukou, necitlivost, závrať, narušená funkce močového měchýře a erektilní dysfunkce. V roce 1844 začal používat invalidní vozík. Navzdory své nemoci si ale udržoval optimistický pohled na život.[93][94] Dalším z raně zaznamenaných případů RS je případ britského pisatele deníku W. N. P. Barbelliona, což byl pseudonym Bruce Fredericka Cummingse (1889–1919). Ten si vedl podrobné záznamy o své diagnóze a boji s nemocí.[94] Jeho deník byl publikován v roce 1919 pod názvem Deník zklamaného muže.[95]
Výzkum[editovat | editovat zdroj]
Léky[editovat | editovat zdroj]

V současné době probíhající výzkum se zaměřuje na hledání účinnějších, vhodnějších léků k léčbě relabující-remitentní RS, které by nemocní lépe snášeli, na vývoj léčebných prostředků pro jednotlivé progresivní podtypy, na neuroprotekční strategie a účinnou symptomatickou léčbu.[96]
Během prvních let 21. století bylo schváleno několik orálně podávaných léků, u nichž se očekává, že získají na oblíbenosti a začnou se používat častěji.[97] Další orálně podávané léky jsou momentálně ve vývoji. Jedním z nich je laquinimod, jehož vývoj byl ohlášen v srpnu 2012 a který je po smíšených výsledcích v předchozích klinických studiích ve fázi III třetí klinické studie.[98] Podobně se provádějí studie zacílené na zlepšení účinnosti a snadnost používání již existujících způsobů léčby. Ty zahrnují použití nových přípravků, například PEGylovanou verzi interferonu β-1a, který by, jak vědci doufají, mohl být podáván v méně častých dávkách s podobnými účinky.[99][100] Žádost o schválenípeginterferonu beta-1a se očekává v průběhu roku 2013.[100]
Velkou míru zájmu vzbuzují také monoklonální protilátky. Alemtuzumab, daklizumab a monoklonální protilátky proti CD20 jako například rituximab, okrelizumab a ofatumumab vykazují určité pozitivní výsledky a v současné době jsou předmětem studie zaměřující se na jejich potenciální využití jako léků.[69] Přitom však byly zaznamenány jisté potenciálně nebezpečné nežádoucí účinky, zejména vznik oportunních infekcí.[97] V souvislosti s těmito šetřeními probíhá vývoj testu na protilátky JC viru, což může pomoci stanovit, u kterých osob je riziko rozvinutí progresivní multifokální leukoencefalopatie v případě užívání natalizumabu vyšší.[97] Ačkoli monoklonální protilátky budou pravděpodobně hrát v budoucnu při léčbě onemocnění jistou roli, má se za to, že v důsledku rizika s nimi spojeného nebude tato role příliš významná.[97]
Další výzkumnou strategií je vyhodnotit kombinovanou účinnost dvou či více léků.[101] Hlavním důvodem pro použití více léků u RS je fakt, že použité léky jsou zacíleny na různé mechanismy a jejich použití tudíž není nezbytně výlučné.[101] Synergie, při kterých jeden lék zlepšuje účinek druhého, jsou také možné, i s nimi ale mohou být spojeny nevýhody, například zablokování působení druhého léku nebo výraznější nežádoucí účinky.[101] Na využití kombinované léčby proběhlo několik hodnocení, přesto žádné z nich neposkytlo dostatečně pozitivní výsledky, aby byl tento způsob léčby považován při léčbě RS za užitečný.[101]
Výzkum neuroprotekce a regenerativní léčby, jako je například terapie kmenovými buňkami, je - ačkoli jeho důležitost je vysoká – teprve v raných fázích.[102] Ani na progresivní typy onemocnění dosud není k dispozici žádná účinná léčba. Mnoho nejnovějších léků a léčivých přípravků ve vývoji bude pravděpodobně podrobeno hodnocení jako možné prostředky pro léčbu PPRS a SPRS.[97]
Biomarkery onemocnění[editovat | editovat zdroj]

Zatímco změna diagnostických kritérií se v blízké budoucnosti neočekává, neustále probíhá práce na vývoji biomarkerů, které pomáhají s diagnózou a předvídáním progrese RS.[97]Nově zkoumané diagnostické metody zahrnují anti-myelinové protilátky a studie prováděné s krevním sérem a mozkomíšním mokem, žádná z nich ale nepřinesla spolehlivě pozitivní výsledky.[104]
V současnosti neexistují žádná laboratorní vyšetření, která by dokázala předvídat vývoj nemoci. Mezi několik předložených slibných přístupů patří využití interleukinu-6, oxidu dusnatého a syntázy oxidu dusnatého, osteopontinu a fetuinu-A.[104] Jelikož progrese onemocnění je důsledkem degenerace neuronů, zkoumá se role proteinů vykazujících úbytek nervové tkáně, jako jsou neurofilamenta, tau protein a N-acetylaspartát.[104] Další výzkumy se zaměřují na hledání biomarkerů, které by rozlišily, kdo bude reagovat na daný lék a kdo nikoli.[104]
Zdokonalení neurozobrazovacích technik, například pozitronové emisní tomografie (PET) nebo magnetické rezonance (MRI), přináší příslib lepších možností diagnózy a predikcí budoucího vývoje, ačkoliv vliv těchto zlepšení na každodenní lékařskou praxi může přijít až za několik desetiletí.[97] Co se týče MRI, existuje několik technik, které již prokázaly určitý pozitivní dopad na výzkum a které by mohly být uvedeny do klinické praxe. Jde například o sekvenci DIR (double inversion recovery), magnetizační přenos, zobrazení tenzorů difuze a funkční magnetickou rezonanci.[105] Tyto techniky mají větší specificitu pro MS než techniky stávající, stále ale postrádají určitou standardizaci akvizičních protokolů a tvorbu normativních hodnot.[105] Ve fázi vývoje jsou i další postupy, které využívají kontrastní látky schopné změřit hladinu periferních makrofágů, zánět nebo neuronovou dysfunkci,[105] a techniky měřící ukládání železa, které by mohly sloužit k určení role tohoto prvku u RS nebo mozkové perfuze.[105]Obdobně by nové radioaktivní indikátory pro PET mohly sloužit jako markery změn u řady procesů, například zánětu mozku, kortikální patologie, apoptózy nebo remylienizace.[106]
Chronická cerebrospinální žilní nedostatečnost[editovat | editovat zdroj]
V roce 2008 cévní chirurg Paolo Zamboni poukázal na to, že RS způsobuje zužování cév odvádějících krev z mozku, což označil jako chronickou cerebrospinální žilní nedostatečnost (CCSVI). Když CCSVI zjistil u všech pacientů s RS ve své studii, provedl chirurgický zákrok médii později nazvaný „proces uvolnění“, aby tuto nedostatečnost napravil. U 73 % účastníků studie se stav zlepšil.[107] Tato teorie získala značnou pozornost médií a osob trpících RS, zejména v Kanadě.[108] V souvislosti se Zamboniho výzkumem se objevila vlna znepokojení, jelikož studie nebyla ani zaslepená ani kontrolovaná a jeho domněnky ohledně základní příčiny nebyly podloženy známými údaji.[109] Ani další studie buď nezjistily žádný podobný vztah, nebo potvrdily souvislost mnohem slabší.[110] To vedlo k výrazným výhradám k Zamboniho hypotéze.[111] „Proces uvolnění“ byl kritizován pro následné vážné komplikace a úmrtí i neprokázaný přínos.[109] K roku 2013 tudíž tento postup není k léčbě RS doporučován.[112] Doplňující výzkum zkoumající hypotézu CCSVI probíhá.[113]
Reference[editovat | editovat zdroj]
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be Compston A, Coles A. Multiple sclerosis. Lancet. 2008, s. 1502–17. DOI 10.1016/S0140-6736(08)61620-7. PMID 18970977.
- ↑ a b c d e f g h i j k l m Compston A, Coles A. Multiple sclerosis. Lancet. 2002, s. 1221–31. DOI 10.1016/S0140-6736(02)08220-X. PMID 11955556.
- ↑ Murray ED, Buttner EA, Price BH. Bradley's neurology in clinical practice.. Redakce Daroff R, Fenichel G, Jankovic J, Mazziotta J. 6th ed.. vyd. Philadelphia, PA: Elsevier/Saunders, 2012. ISBN 1-4377-0434-4. Kapitola Depression and Psychosis in Neurological Practice.
- ↑ a b c d e f g h Lublin FD, Reingold SC; National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis. Defining the clinical course of multiple sclerosis: results of an international survey. Neurology. 1996, s. 907–11. DOI 10.1212/WNL.46.4.907. PMID 8780061.
- ↑ NAKAHARA, J, Maeda, M; Aiso, S; Suzuki, N. Current concepts in multiple sclerosis: autoimmunity versus oligodendrogliopathy.. Clinical reviews in allergy & immunology. 2012 Feb, s. 26–34. PMID 22189514.
- ↑ a b c d e f g h Ascherio A, Munger KL. Environmental risk factors for multiple sclerosis. Part I: the role of infection. Ann. Neurol.. 2007, s. 288–99. DOI 10.1002/ana.21117. PMID 17444504.
- ↑ a b c Weinshenker BG. Natural history of multiple sclerosis. Ann. Neurol.. 1994, s. S6–11. DOI 10.1002/ana.410360704. PMID 8017890.
- ↑ a b c d e f g World Health Organization. Atlas: Multiple Sclerosis Resources in the World 2008. Geneva: World Health Organization, 2008. Dostupné online. ISBN 92-4-156375-3. S. 15-16.
- ↑ a b c d e f g h i j k l m Milo R, Kahana E. Multiple sclerosis: geoepidemiology, genetics and the environment. Autoimmun Rev. 2010, s. A387–94. DOI 10.1016/j.autrev.2009.11.010. PMID 19932200.
- ↑ a b c Clanet M. Jean-Martin Charcot. 1825 to 1893. Int MS J. 2008, s. 59–61. Dostupné online. PMID 18782501.
* Charcot, J. Histologie de la sclerose en plaques. Gazette des hopitaux, Paris. 1868, s. 554–5. - ↑ Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology. 1983, s. 1444–52. DOI 10.1212/WNL.33.11.1444. PMID 6685237.
- ↑ Amato MP, Ponziani G. Quantification of impairment in MS: discussion of the scales in use. Mult. Scler.. 1999, s. 216–9. PMID 10467378.
- ↑ Rudick RA, Cutter G, Reingold S. The multiple sclerosis functional composite: a new clinical outcome measure for multiple sclerosis trials. Mult. Scler.. 2002, s. 359–65. PMID 12356200.
- ↑ a b c d e f g h i TSANG, BK, Macdonell, R. Multiple sclerosis- diagnosis, management and prognosis.. Australian family physician. 2011 Dec, s. 948–55. PMID 22146321.
- ↑ a b Tataru N, Vidal C, Decavel P, Berger E, Rumbach L. Limited impact of the summer heat wave in France (2003) on hospital admissions and relapses for multiple sclerosis. Neuroepidemiology. 2006, s. 28–32. DOI 10.1159/000094233. PMID 16804331.
- ↑ Heesen C, Mohr DC, Huitinga I,a kol.. Stress regulation in multiple sclerosis: current issues and concepts. Mult. Scler.. 2007, s. 143–8. DOI 10.1177/1352458506070772. PMID 17439878.
- ↑ Martinelli V. Trauma, stress and multiple sclerosis. Neurol. Sci.. 2000, s. S849–52. Dostupné online. DOI 10.1007/s100720070024. PMID 11205361.
- ↑ a b c d e f Marrie RA. Environmental risk factors in multiple sclerosis aetiology. Lancet Neurol. 2004, s. 709–18. DOI 10.1016/S1474-4422(04)00933-0. PMID 15556803.
- ↑ a b c Alonso A, Hernán MA. Temporal trends in the incidence of multiple sclerosis: a systematic review. Neurology. 2008, s. 129–35. DOI 10.1212/01.wnl.0000316802.35974.34. PMID 18606967.
- ↑ a b Pugliatti M, Sotgiu S, Rosati G. The worldwide prevalence of multiple sclerosis. Clin Neurol Neurosurg. 2002, s. 182–91. PMID 12127652.
- ↑ a b c d Ascherio A, Munger KL. Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors. Ann. Neurol.. 2007, s. 504–13. DOI 10.1002/ana.21141. PMID 17492755.
- ↑ Ascherio A, Munger KL, Simon KC. Vitamin D and multiple sclerosis. Lancet Neurol. 2010, s. 599–612. DOI 10.1016/S1474-4422(10)70086-7. PMID 20494325.
- ↑ Kulie T, Groff A, Redmer J, Hounshell J, Schrager S. Vitamin D: an evidence-based review. J Am Board Fam Med. 2009, s. 698–706. DOI 10.3122/jabfm.2009.06.090037. PMID 19897699.
- ↑ Dyment DA, Ebers GC, Sadovnick AD. Genetics of multiple sclerosis. Lancet Neurol. 2004, s. 104–10. DOI 10.1016/S1474-4422(03)00663-X. PMID 14747002.
- ↑ HASSAN-SMITH, G, Douglas, MR. Epidemiology and diagnosis of multiple sclerosis.. British journal of hospital medicine (London, England : 2005). 2011 Oct, s. M146-51. PMID 22041658.
- ↑ Rosati G. The prevalence of multiple sclerosis in the world: an update. Neurol. Sci.. 2001, s. 117–39. DOI 10.1007/s100720170011. PMID 11603614.
- ↑ a b c d Baranzini SE. Revealing the genetic basis of multiple sclerosis: are we there yet?. Curr. Opin. Genet. Dev.. 2011, s. 317–24. DOI 10.1016/j.gde.2010.12.006. PMID 21247752.
- ↑ a b Kurtzke JF. Epidemiologic evidence for multiple sclerosis as an infection. Clin. Microbiol. Rev.. 1993, s. 382–427. Dostupné online. DOI 10.1128/CMR.6.4.382. PMID 8269393.
- ↑ Gilden DH. Infectious causes of multiple sclerosis. The Lancet Neurology. 2005, s. 195–202. DOI 10.1016/S1474-4422(05)01017-3. PMID 15721830.
- ↑ Spitsin S, Koprowski H. Role of uric acid in multiple sclerosis. Curr. Top. Microbiol. Immunol.. 2008, s. 325–42. PMID 18219824.
- ↑ a b Chari DM. Remyelination in multiple sclerosis. Int. Rev. Neurobiol.. 2007, s. 589–620. DOI 10.1016/S0074-7742(07)79026-8. PMID 17531860.
- ↑ Pittock SJ, Lucchinetti CF. The pathology of MS: new insights and potential clinical applications. Neurologist. 2007, s. 45–56. DOI 10.1097/01.nrl.0000253065.31662.37. PMID 17351524.
- ↑ Trojano M, Paolicelli D. The differential diagnosis of multiple sclerosis: classification and clinical features of relapsing and progressive neurological syndromes. Neurol. Sci.. 2001, s. S98–102. Dostupné online. DOI 10.1007/s100720100044. PMID 11794488.
- ↑ Poser CM, Brinar VV. Diagnostic criteria for multiple sclerosis: an historical review. Clin Neurol Neurosurg. 2004, s. 147–58. DOI 10.1016/j.clineuro.2004.02.004. PMID 15177763.
- ↑ a b c d McDonald WI, Compston A, Edan G, et al.. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. Ann. Neurol.. 2001, s. 121–7. DOI 10.1002/ana.1032. PMID 11456302.
- ↑ Polman CH, Reingold SC, Edan G, et al.. Diagnostic criteria for multiple sclerosis: 2005 revisions to the "McDonald Criteria". Ann. Neurol.. 2005, s. 840–6. DOI 10.1002/ana.20703. PMID 16283615.
- ↑ Rashid W, Miller DH. Recent advances in neuroimaging of multiple sclerosis. Semin Neurol. 2008, s. 46–55. DOI 10.1055/s-2007-1019127. PMID 18256986.
- ↑ Link H, Huang YM. Oligoclonal bands in multiple sclerosis cerebrospinal fluid: an update on methodology and clinical usefulness. J. Neuroimmunol.. 2006, s. 17–28. DOI 10.1016/j.jneuroim.2006.07.006. PMID 16945427.
- ↑ Gronseth GS, Ashman EJ. Practice parameter: the usefulness of evoked potentials in identifying clinically silent lesions in patients with suspected multiple sclerosis (an evidence-based review): Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2000, s. 1720–5. DOI 10.1212/WNL.54.9.1720. PMID 10802774.
- ↑ Pittock SJ, Rodriguez M. Benign multiple sclerosis: a distinct clinical entity with therapeutic implications. Curr. Top. Microbiol. Immunol.. 2008, s. 1–17. DOI 10.1007/978-3-540-73677-6_1. PMID 18219812.
- ↑ FEINSTEIN, A. The clinical neuropsychiatry of multiple sclerosis. 2nd ed.. vyd. Cambridge: Cambridge University Press, 2007. ISBN 052185234X. S. 20.
- ↑ a b Miller D, Barkhof F, Montalban X, Thompson A, Filippi M. Clinically isolated syndromes suggestive of multiple sclerosis, part I: natural history, pathogenesis, diagnosis, and prognosis. Lancet Neurol. 2005, s. 281–8. DOI 10.1016/S1474-4422(05)70071-5. PMID 15847841.
- ↑ Rovaris M, Confavreux C, Furlan R, Kappos L, Comi G, Filippi M. Secondary progressive multiple sclerosis: current knowledge and future challenges. Lancet Neurol. 2006, s. 343–54. DOI 10.1016/S1474-4422(06)70410-0. PMID 16545751.
- ↑ a b c Miller DH, Leary SM. Primary-progressive multiple sclerosis. Lancet Neurol. 2007, s. 903–12. DOI 10.1016/S1474-4422(07)70243-0. PMID 17884680.
- ↑ Stadelmann C, Brück W. Lessons from the neuropathology of atypical forms of multiple sclerosis. Neurol. Sci.. 2004, s. S319–22. DOI 10.1007/s10072-004-0333-1. PMID 15727225.
- ↑ Šablona:Cite cochrane
- ↑ Multiple sclerosis : national clinical guideline for diagnosis and management in primary and secondary care. London: Royal College of Physicians, 2004. Dostupné online. ISBN 1-86016-182-0. PMID 21290636. S. 54–57.
- ↑ a b c HE, D, Xu, Z; Dong, S; Zhang, H; Zhou, H; Wang, L; Zhang, S. Teriflunomide for multiple sclerosis. Redakce Zhou Hongyu. Cochrane database of systematic reviews (Online). 2012 Dec 12, s. CD009882. DOI 10.1002/14651858.CD009882.pub2. PMID 23235682.
- ↑ US FDA: FDA approves new multiple sclerosis treatment Aubagio, tisková zpráva, [cit. 2013-01-21], Dostupné on-line.
- ↑ a b Biogen Idec: Biogen Idec’s TECFIDERA™ (Dimethyl Fumarate) Approved in US as a First-Line Oral Treatment for Multiple Sclerosis, tisková zpráva, [cit. 2013-06-04], Dostupné on-line.
- ↑ MANOUCHEHRINIA, A, Constantinescu, CS. Cost-effectiveness of disease-modifying therapies in multiple sclerosis.. Current neurology and neuroscience reports. 2012 Oct, s. 592–600. PMID 22782520.
- ↑ a b HASSAN-SMITH, G, Douglas, MR. Management and prognosis of multiple sclerosis.. British journal of hospital medicine (London, England : 2005). 2011 Nov, s. M174-6. PMID 22082979.
- ↑ Freedman MS. Long-term follow-up of clinical trials of multiple sclerosis therapies. Neurology. 2011, s. S26–34. DOI 10.1212/WNL.0b013e318205051d. PMID 21205679.
- ↑ Qizilbash N, Mendez I, Sanchez-de la Rosa R. Benefit-risk analysis of glatiramer acetate for relapsing-remitting and clinically isolated syndrome multiple sclerosis. Clin Ther. 2012, s. 159–176.e5. DOI 10.1016/j.clinthera.2011.12.006. PMID 22284996.
- ↑ Bates D. Treatment effects of immunomodulatory therapies at different stages of multiple sclerosis in short-term trials. Neurology. 2011, s. S14–25. DOI 10.1212/WNL.0b013e3182050388. PMID 21205678.
- ↑ Johnston J, So TY. First-line disease-modifying therapies in paediatric multiple sclerosis: a comprehensive overview. Drugs. 2012, s. 1195–211. DOI 10.2165/11634010-000000000-00000. PMID 22642799.
- ↑ Killestein J, Rudick RA, Polman CH. Oral treatment for multiple sclerosis. Lancet Neurol. 2011, s. 1026–34. DOI 10.1016/S1474-4422(11)70228-9. PMID 22014437.
- ↑ Kellerman, Rick D.; Edward N. Hanley Jr MD. Conn's Current Therapy 2012: Expert Consult - Online and Print. Philadelphia: Saunders, 2011. Dostupné online. ISBN 1-4557-0738-4. S. 627.
- ↑ a b MARTINELLI BONESCHI, F, Vacchi, L; Rovaris, M; Capra, R; Comi, G. Mitoxantrone for multiple sclerosis.. Cochrane database of systematic reviews (Online). 2013 May 31, s. CD002127. PMID 23728638.
- ↑ MARRIOTT, JJ, Miyasaki, JM; Gronseth, G; O'Connor, PW; Therapeutics and Technology Assessment Subcommittee of the American Academy of, Neurology. Evidence Report: The efficacy and safety of mitoxantrone (Novantrone) in the treatment of multiple sclerosis: Report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology.. Neurology. 2010 May 4, s. 1463–70. PMID 20439849.
- ↑ a b BALAK, DM, Hengstman, GJ; Çakmak, A; Thio, HB. Cutaneous adverse events associated with disease-modifying treatment in multiple sclerosis: a systematic review.. Multiple sclerosis (Houndmills, Basingstoke, England). 2012 Dec, s. 1705–17. PMID 22371220.
- ↑ Sládková T, Kostolanský F. The role of cytokines in the immune response to influenza A virus infection. Acta Virol.. 2006, s. 151–62. PMID 17131933.
- ↑ Munari L, Lovati R, Boiko A. Therapy with glatiramer acetate for multiple sclerosis. Redakce Munari Luca M.. Cochrane database of systematic reviews (Online). 2004, s. CD004678. DOI 10.1002/14651858.CD004678. PMID 14974077.
- ↑ Tremlett H, Oger J. Hepatic injury, liver monitoring and the beta-interferons for multiple sclerosis. J. Neurol.. 2004, s. 1297–303. DOI 10.1007/s00415-004-0619-5. PMID 15592724.
- ↑ Comi G. Treatment of multiple sclerosis: role of natalizumab. Neurol. Sci.. 2009, s. S155–8. DOI 10.1007/s10072-009-0147-2. PMID 19882365.
- ↑ HUNT, D, Giovannoni, G. Natalizumab-associated progressive multifocal leucoencephalopathy: a practical approach to risk profiling and monitoring.. Practical neurology. 2012 Feb, s. 25–35. PMID 22258169.
- ↑ a b c Killestein J, Rudick RA, Polman CH. Oral treatment for multiple sclerosis. Lancet Neurol. 2011, s. 1026–34. DOI 10.1016/S1474-4422(11)70228-9. PMID 22014437.
- ↑ NDA 204063 - FDA Approved Labeling Text [online]. US Food and Drug Agency, 27 March 2013 [cit. 2013-04-05]. Dostupné online.
NDA Approval [online]. US Food and Drug Agency, 27 March 2013 [cit. 2013-04-05]. Dostupné online. - ↑ a b Saidha S, Eckstein C, Calabresi PA. New and emerging disease modifying therapies for multiple sclerosis. Ann. N. Y. Acad. Sci.. 2012, s. 117–37. DOI 10.1111/j.1749-6632.2011.06272.x. PMID 22224673.
- ↑ Kesselring J, Beer S. Symptomatic therapy and neurorehabilitation in multiple sclerosis. Lancet Neurol. 2005, s. 643–52. DOI 10.1016/S1474-4422(05)70193-9. PMID 16168933.
- ↑ Khan F, Turner-Stokes L, Ng L, Kilpatrick T. Multidisciplinary rehabilitation for adults with multiple sclerosis. Redakce Khan Fary. Cochrane Database Syst Rev. 2007, s. CD006036. DOI 10.1002/14651858.CD006036.pub2. PMID 17443610.
- ↑ a b Steultjens EM, Dekker J, Bouter LM, Leemrijse CJ, van den Ende CH. Evidence of the efficacy of occupational therapy in different conditions: an overview of systematic reviews. Clinical rehabilitation. 2005, s. 247–54. DOI 10.1191/0269215505cr870oa. PMID 15859525.
- ↑ Steultjens EM, Dekker J, Bouter LM, Cardol M, Van de Nes JC, Van den Ende CH. Occupational therapy for multiple sclerosis. Redakce Steultjens Esther EMJ. Cochrane database of systematic reviews (Online). 2003, s. CD003608. DOI 10.1002/14651858.CD003608. PMID 12917976.
- ↑ Gallien P, Nicolas B, Robineau S, Pétrilli S, Houedakor J, Durufle A. Physical training and multiple sclerosis. Ann Readapt Med Phys. 2007, s. 373–6, 369–72. DOI 10.1016/j.annrmp.2007.04.004. PMID 17482708.
- ↑ Rietberg MB, Brooks D, Uitdehaag BMJ, Kwakkel G. Exercise therapy for multiple sclerosis. Redakce Kwakkel Gert. Cochrane Database of Systematic Reviews. 2005, s. CD003980. DOI 10.1002/14651858.CD003980.pub2. PMID 15674920.
- ↑ Thomas PW, Thomas S, Hillier C, Galvin K, Baker R. Psychological interventions for multiple sclerosis. Redakce Thomas Peter W. Cochrane Database of Systematic Reviews. 2006, s. CD004431. DOI 10.1002/14651858.CD004431.pub2. PMID 16437487.
- ↑ a b c d e f g Huntley A. A review of the evidence for efficacy of complementary and alternative medicines in MS. Int MS J. 2006, s. 5–12, 4. PMID 16420779.
- ↑ Olsen SA. A review of complementary and alternative medicine (CAM) by people with multiple sclerosis. Occup Ther Int. 2009, s. 57–70. DOI 10.1002/oti.266. PMID 19222053.
- ↑ JAGANNATH, VA, Fedorowicz, Z; Asokan, GV; Robak, EW; Whamond, L. Vitamin D for the management of multiple sclerosis.. Cochrane database of systematic reviews (Online). 2010 Dec 8, s. CD008422. PMID 21154396.
- ↑ Farinotti M, Simi S, Di Pietrantonj C, et al.. Dietary interventions for multiple sclerosis. Redakce Farinotti Mariangela. Cochrane database of systematic reviews (Online). 2007, s. CD004192. DOI 10.1002/14651858.CD004192.pub2. PMID 17253500.
- ↑ Grigorian A, Araujo L, Naidu NN, Place DJ, Choudhury B, Demetriou M. N-acetylglucosamine inhibits T-helper 1 (Th1)/T-helper 17 (Th17) cell responses and treats experimental autoimmune encephalomyelitis.. J Biol Chem. 2011. DOI 10.1074/jbc.M111.277814. Epub 2011 Sep 29.. PMID 21965673.
- ↑ Chong MS, Wolff K, Wise K, Tanton C, Winstock A, Silber E. Cannabis use in patients with multiple sclerosis. Mult. Scler.. 2006, s. 646–51. DOI 10.1177/1352458506070947. PMID 17086912.
- ↑ Bennett M, Heard R. Hyperbaric oxygen therapy for multiple sclerosis. Redakce Bennett Michael H. Cochrane database of systematic reviews (Online). 2004, s. CD003057. DOI 10.1002/14651858.CD003057.pub2. PMID 14974004.
- ↑ ADAMS, Tim. Gut instinct: the miracle of the parasitic hookworm. The Observer. 23 May 2010. Dostupné online.
- ↑ a b c Phadke JG. Survival pattern and cause of death in patients with multiple sclerosis: results from an epidemiological survey in north east Scotland. J. Neurol. Neurosurg. Psychiatr.. 1987, s. 523–31. DOI 10.1136/jnnp.50.5.523. PMID 3495637.
- ↑ Myhr KM, Riise T, Vedeler C, et al. Disability and prognosis in multiple sclerosis: demographic and clinical variables important for the ability to walk and awarding of disability pension. Mult. Scler.. 2001, s. 59–65. PMID 11321195.
- ↑ LOZANO, R. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010.. Lancet. 2012 Dec 15, s. 2095-128. PMID 23245604.
- ↑ a b Compston A. The 150th anniversary of the first depiction of the lesions of multiple sclerosis. J. Neurol. Neurosurg. Psychiatr.. 1988, s. 1249–52. DOI 10.1136/jnnp.51.10.1249. PMID 3066846.
- ↑ Lassmann H. The pathology of multiple sclerosis and its evolution. Philos. Trans. R. Soc. Lond., B, Biol. Sci.. 1999, s. 1635–40. DOI 10.1098/rstb.1999.0508. PMID 10603616.
- ↑ Lassmann H. Multiple sclerosis pathology: evolution of pathogenetic concepts. Brain Pathology. July 2005, s. 217–22. DOI 10.1111/j.1750-3639.2005.tb00523.x. PMID 16196388.
- ↑ Medaer R. Does the history of multiple sclerosis go back as far as the 14th century?. Acta Neurol. Scand.. 1979, s. 189–92. DOI 10.1111/j.1600-0447.1979.tb08970.x. PMID 390966.
- ↑ Holmøy T. A Norse contribution to the history of neurological diseases. Eur. Neurol.. 2006, s. 57–8. DOI 10.1159/000091431. PMID 16479124.
- ↑ FIRTH, D. The Case of August D`Esté. Cambridge: Cambridge University Press, 1948.
- ↑ a b Pearce JM. Historical descriptions of multiple sclerosis. Eur. Neurol.. 2005, s. 49–53. DOI 10.1159/000087387. PMID 16103678.
- ↑ BARBELLION, Wilhelm Nero Pilate. The Journal of a Disappointed Man. New York: George H. Doran, 1919. ISBN 0-7012-1906-8.
- ↑ Cohen JA. Emerging therapies for relapsing multiple sclerosis. Arch. Neurol.. 2009, s. 821–8. DOI 10.1001/archneurol.2009.104. PMID 19597083.
- ↑ a b c d e f g Miller AE. Multiple sclerosis: where will we be in 2020?. Mt. Sinai J. Med.. 2011, s. 268–79. DOI 10.1002/msj.20242. PMID 21425270.
- ↑ JEFFREY, susan. CONCERTO: A Third Phase 3 Trial for Laquinimod in MS. Medscape Medical News. 09 Aug 2012. Dostupné online [cit. 21 May 2013].
- ↑ Kieseier BC, Calabresi PA. PEGylation of interferon-β-1a: a promising strategy in multiple sclerosis. CNS Drugs. 2012, s. 205–14. DOI 10.2165/11596970-000000000-00000. PMID 22201341.
- ↑ a b Biogen Idec: Biogen Idec Announces Positive Top-Line Results from Phase 3 Study of Peginterferon Beta-1a in Multiple Sclerosis, tisková zpráva, [cit. 2013-05-21], Dostupné on-line.
- ↑ a b c d Milo R, Panitch H. Combination therapy in multiple sclerosis. J. Neuroimmunol.. 2011, s. 23–31. DOI 10.1016/j.jneuroim.2010.10.021. PMID 21111490.
- ↑ Luessi F, Siffrin V, Zipp F. Neurodegeneration in multiple sclerosis: novel treatment strategies. Expert Rev Neurother. 2012, s. 1061–76; quiz 1077. Dostupné online. DOI 10.1586/ern.12.59. PMID 23039386.
- ↑ Mehta V, Pei W, Yang G, et al.. Iron is a sensitive biomarker for inflammation in multiple sclerosis lesions. PLoS ONE. 2013, s. e57573. DOI 10.1371/journal.pone.0057573. PMID 23516409.
- ↑ a b c d Harris VK, Sadiq SA. Disease biomarkers in multiple sclerosis: potential for use in therapeutic decision making. Mol Diagn Ther. 2009, s. 225–44. DOI 10.2165/11313470-000000000-00000. PMID 19712003.
- ↑ a b c d Filippi M, Rocca MA, De Stefano N, et al.. Magnetic resonance techniques in multiple sclerosis: the present and the future. Arch. Neurol.. 2011, s. 1514–20. DOI 10.1001/archneurol.2011.914. PMID 22159052.
- ↑ Kiferle L, Politis M, Muraro PA, Piccini P. Positron emission tomography imaging in multiple sclerosis-current status and future applications. Eur. J. Neurol.. 2011, s. 226–31. DOI 10.1111/j.1468-1331.2010.03154.x. PMID 20636368.
- ↑ Zamboni P, Galeotti R, Menegatti E, et al.. Chronic cerebrospinal venous insufficiency in patients with multiple sclerosis. J. Neurol. Neurosurg. Psychiatr.. April 2009, s. 392–9. Dostupné online. DOI 10.1136/jnnp.2008.157164. PMID 19060024.
- ↑ Pullman D, Zarzeczny A, Picard A. Media, politics and science policy: MS and evidence from the CCSVI Trenches. BMC Med Ethics. 2013, s. 6. DOI 10.1186/1472-6939-14-6. PMID 23402260.
- ↑ a b Qiu J. Venous abnormalities and multiple sclerosis: another breakthrough claim?. Lancet Neurol. 2010, s. 464–5. DOI 10.1016/S1474-4422(10)70098-3. PMID 20398855.
- ↑ Ghezzi A, Comi G, Federico A. Chronic cerebro-spinal venous insufficiency (CCSVI) and multiple sclerosis. Neurol. Sci.. 2011, s. 17–21. DOI 10.1007/s10072-010-0458-3. PMID 21161309.
- ↑ Dorne H, Zaidat OO, Fiorella D, Hirsch J, Prestigiacomo C, Albuquerque F, Tarr RW. Chronic cerebrospinal venous insufficiency and the doubtful promise of an endovascular treatment for multiple sclerosis. J NeuroIntervent Surg. October 2010, s. 309–311. DOI 10.1136/jnis.2010.003947. PMID 21990639.
- ↑ Baracchini C, Atzori M, Gallo P. CCSVI and MS: no meaning, no fact. Neurol. Sci.. 2013, s. 269–79. DOI 10.1007/s10072-012-1101-2. PMID 22569567.
- ↑ VAN ZUUREN, EJ, Fedorowicz, Z; Pucci, E; Jagannath, VA; Robak, EW. Percutaneous transluminal angioplasty for treatment of chronic cerebrospinal venous insufficiency (CCSVI) in multiple sclerosis patients.. Cochrane database of systematic reviews (Online). 2012 Dec 12, s. CD009903. PMID 23235683.
Další četba[editovat | editovat zdroj]
- Langgartner M, Langgartner I, Drlicek M. The patient's journey: multiple sclerosis. BMJ. 2005, s. 885–8. Dostupné online. DOI 10.1136/bmj.330.7496.885. PMID 15831874.
