Madelungova syntéza indolů
Madelungova syntéza indolů je organická reakce sloužící k přípravě a výrobě substituovaných či nesubstituovaných indolů vnitromolekulární cyklizací N-fenylamidů za použití silné zásady při vysokých teplotách. Poprvé ji popsal Walter Madelung v roce 1912, když připravil 2-fenylindol z N-benzoyl-o-toluidinu a dvou ekvivalentů ethoxidu sodného zahříváním za nepřístupu vzduchu. Obvykle se k této reakci používá sodný nebo draselný alkoxid rozpuštěný v hexanu nebo tetrahydrofuranu a reakční teplota bývá 200–400 °C. K provedení syntézy je také nutná hydrolýza. Madelungova cyklizace je velmi významná, jelikož je jedním z mála známých postupů přípravy indolů zásaditě katalyzovanými cyklizacemi N-benzoyl-o-toluidinů.

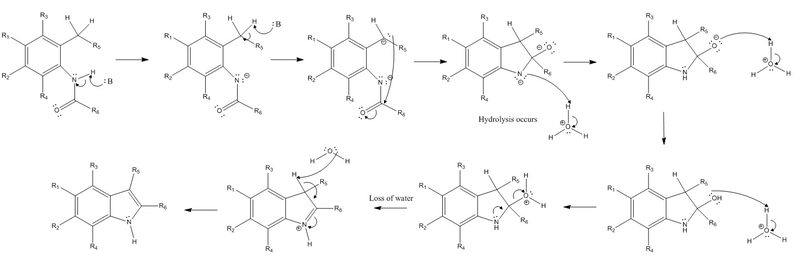
Mechanismus[editovat | editovat zdroj]
Reakce začíná odštěpením vodíkového iontu z amidové skupiny a z benzylové skupiny v poloze ortho vůči amidovému substituentu pomocí silné zásady. Takto vytvořený karboanion následně nukleofilně reaguje s elektrofilním karbonylovým uhlíkem amidu. Tímto se vazba pí v molekule amidu přemění na volný elektronový pár, čímž získá atom kyslíku záporný náboj. Poté již není zásada potřeba a probíhá především hydrolýza. Záporně nabitý dusík je protonován a stává se znovu neutrálním; kyslík je dvakrát protonován, čímž získává kladný náboj a stává se tak dobrou odcházející skupinou. Volný pár elektronů na dusíku vytvoří vazbu pí, což vede k odštěpení kladně nabité odcházející skupiny a vytvoření kladného náboje na dusíku. Posledním krokem je eliminace (konkrétně E2 reakce), při které dojde k odštěpení dalšího, původně benzylového, vodíku a následně se vytvoří bicyklická molekula, jejíž elektrony vytvořily novou vazbu pí v cyklu. Díky tomu se vazba pí vytvořená dusíkem v předchozím kroku přemění zpět na volný elektronový pár, čímž se obnoví neutralita dusíkového atomu.
Úpravy podmínek reakce[editovat | editovat zdroj]
Bylo vyvinuto několik postupů zvyšujících výtěžnost Madelungovy syntézy. Výtěžnost bývá vyšší, pokud je na aromatické jádro navázána skupina dodávající elektrony, a nižší, když je na něj navázána skupina odtahující elektrony.[1] Jestliže je však substituent odtahující elektrony na pozici R5, tak se výtěžnost zvyšuje. Účinnost reakce také výrazně závisí na velikosti substituentu na pozici R6; čím je tento substituent mohutnější, tím je reakce méně účinná. Madelungova syntéza se provádí za poměrně tvrdých podmínek. Byly však objeveny její obměny, při kterých jsou potřebné teploty nižší a reakce má stále dobrou výtěžnost. Například při napojení skupiny dodávající elektrony na aromatické jádro a skupiny odtahující elektrony do polohy R5 se potřebná teplota snižuje na asi 25 °C.[1] Při použití butyllithia nebo diisopropylamidu lithného jako zásady a tetrahydrofuranu jako rozpouštědla lze reakci účinně dokonce při −20 – 25 °C.[2] Tato pozměněná Madelungova syntéza bývá označována jako Madelungova-Houlihanova varianta.[3]
Využití[editovat | editovat zdroj]
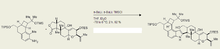
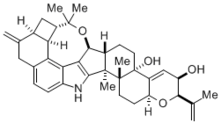
Madelungova syntéza se často používá v průmyslu, například na výrobu indolového alkaloidu (-)-penitremu D, látky vytvářené paličkovicí nachovou a způsobující onemocnění svalů i nervů u hospodářských zvířat.[4] Jelikož může tento toxin způsobovat značné škody v živočišné výrobě, tak je třeba znát možnosti jeho přípravy a rychlého rozkladu.
Madelungova syntéza se také využívá při přípravě 2,6-difenyl-1,5-diaza-1,5-dihydro-s-indacenu z 2,5-dimethyl-1,4-fenylendiaminu.[5]
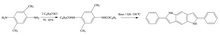
Jako zásada se zde používá ethoxid sodný a reakce se provádí při 320 až 330 °C. Produkt lze použít na výrobu organických světelných diod, které mohou mít mnoho různých využití v průmyslu.
Smithova varianta[editovat | editovat zdroj]
Smithovu variantu Madelungovy syntézy indolů, také označovanou jako Smithova syntéza indolů, objevil v roce 1986 Amos Smith. Spočívá v kondenzaci organolithných sloučenin odvozených od 2-alkyl-N-trimethylsilylanilinu s karboxylovými kyselinami nebo jejich estery za tvorby substituovaných indolů.[6] Lze při ní použít široké spektrum různých anilinů, substituovaných například alkylovými, methoxy a halogenidovými skupinami, které mohou reagovat s neenolizovatelnými estery nebo laktony za tvorby N-lithioketaminových meziproduktů. U těchto meziproduktů probíhají vnitromolekulární Petersonovy olefinace, kterými vznikají indolininy, které následně tautomerizují na 2-substituované indoly. Smithova syntéza indolů patří mezi nejvýznamnější obměny Madelungovy syntézy.
Mechamismus[editovat | editovat zdroj]
Na začátku Smithovy syntézy je pomocí dvou ekvivalentů organolithné sloučeniny deprotonován alkylový substituent i dusík, což vede k vytvoření záporných nábojů. Vzniklý karboanion reaguje s karbonylovým uhlíkem esteru, vazba pí u elektrofilu se tím mění na volný elektronový pár na kyslíku. Následně dojde k obnovení vazby pí a odštěpení skupiny -OR. Poté záporně nabitý dusík nukleofilně reaguje se sousedním karbonylovým uhlíkem, čímž se znovu vytvoří volný elektronový pár. Kyslík, na kterém se vytvoří záporný náboj, poté reaguje s atomem křemíku v trimethylsilylové skupině, čímž vzniká tricyklická sloučenina, kladně nabitý atom křemíku a neutrální atom kyslíku. Součástí této syntézy je vnitromolekulární Petersonova olefinace na heteroatomu, která vede k odštěpení trimethylsilylové skupiny a tvorbě vazby pí v pětičlenném cyklu obsahujícím atom dusíku. Takto vytvořená molekula se následně tautomerizuje na výsledný produkt.
Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
- Bartoliova syntéza indolů
- Leimgruberova–Batchova syntéza indolů
- Fischerova syntéza indolů
- Reissertova syntéza indolů
- Gassmanova syntéza indolů
- Nenitzescuova syntéza indolů
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Madelungova syntéza indolů na Wikimedia Commons
Obrázky, zvuky či videa k tématu Madelungova syntéza indolů na Wikimedia Commons
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Madelung synthesis na anglické Wikipedii.
- ↑ a b Laszlo Kurti; Barbara Czako. Strategic Applications of Named Reactions in Organic Synthesis. Burlington, MA: Elsevier Academic Press, 2005. ISBN 0-12-429785-4. S. 270.
- ↑ William Houlihan; Uike Parrino. Lithiation of N-(2-Alkylphenyl)alkanamides and Related Compounds. A Modified Madelung Indole Synthesis. Journal of Organic Chemistry. 1981-05-07, s. 4511–4515. DOI 10.1021/jo00335a038.
- ↑ Gordon Gribble. Recent developments in indole ring synthesis—methodology and applications. Journal of the Chemical Society, Perkin Transactions 1. 2000-03-23, s. 5. DOI 10.1039/A909834H.
- ↑ Amos Smith; Ishiyama Kanoh; Rainier Minakawa; Moser Cui. Tremorgenic Indole Alkaloids. The Total Synthesis of (-)-Penitrem D. Journal of the American Chemical Society. 2003-07-09, s. 8828–8837. DOI 10.1021/ja034842k. PMID 12837093.
- ↑ Xu Jin; Desseyn Peng; Heremans Janssens. Synthesis, optical and electroluminescent properties of a novel Indacene. Synthetic Metals. 2003-09-02, s. 529–534. DOI 10.1016/S0379-6779(03)00338-2.
- ↑ SMITH, Amos; VISNICK; HASELTINE; SPRENGELER. Organometallic Reagents in Synthesis: A New Protocol for Construction of the Indole Nucleus. Tetrahedron. 1986, s. 2957–2969. DOI 10.1016/S0040-4020(01)90586-1.
