Bartoliova syntéza indolů
Bartoliova syntéza indolů, také nazývaná Bartoliova reakce, je organická reakce ortho-substituovaných nitro- a nitrosoderivátů arenů s Grignardovými činidly obsahujícími ethenylovou (vinylovou) skupinu za vzniku substituovaných indolů.[1][2][3][4]
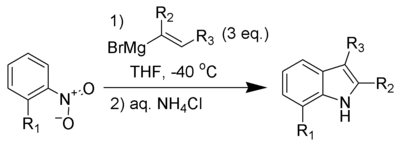
Reakce často neprobíhá, pokud není na substrát navázán substituent v poloze ortho vůči nitroskupině, přičemž při použití objemnějších substituentů se obvykle dosahuje vyšších výtěžností. Sterické efekty vyvolávané substituentem usnadňují 3,3 přesmyk, který je nutný k tvorbě produktu. K úplné přeměně jsou u nitroarenů potřeba tři a u nitrosoarenů dva ekvivalenty Grignardova činidla.
Tato reakce je jedním z nejrychlejších a nejvšestrannějších způsobů přípravy 7-substituovaných indolů.[5][6] Podobné možnosti i regioselektivitu má Leimgruberova–Batchova syntéza indolů, při které je však obtížné vytvořit produkty substituované na karbocyklickém i pyrrolovém kruhu.
Mechanismus
[editovat | editovat zdroj]Mechanismus Bartoliovy reakce[7] je zde popsán na reakci o-nitrotoluenu (1) s propenyl-Grignardovým činidlem (2) za vzniku 3,7-dimethylindolu (13).

Reakce začíná adicí Grignardova činidla 2 na nitroaren 1 za tvorby meziproduktu 3. Ten se následně samovolně rozpadá na nitrosoaren 4 a hořečnatou sůl 5. Reakcí nitrosoarenu s druhým ekvivalentem Grignardova činidla vznikne další meziprodukt 7. Sterické efekty vyvolávané ortho-substituentem způsobí [3,3] sigmatropní přesmyk na látku 8. Cyklizací a tautomerizací se následně vytvoří meziprodukt 10, jenž reaguje s třetím ekvivalentem Grignardova činidla na hořečnatou sůl indolu 12. Z této soli se odštěpí molekula vody a vznikne konečný produkt 13.
K provedení reakce jsou tedy potřeba tři ekvivalenty Grignardova činidla, jelikož první ekvivalent vytvoří karbonylovou sloučeninu 6, druhý deprotonuje meziprodukt 10 na alken 11 a třetí se zapojí do indolového kruhu. Nitroso meziprodukt vytváří indol reakcí se dvěma ekvivalenty Grignardova činidla.
Bartoliovou reakcí lze připravit 4-azaindoly i 6-azaindoly.[8]
Dobbsova varianta
[editovat | editovat zdroj]Adrian Dobbs výrazně rozšířil možnosti Bartoliovy reakce použitím bromu v poloze ortho jako řídící skupiny, která se po provedení reakce odstraní azobisisobutylonitrilem tributylcínem.[9]

Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]- Fischerova syntéza indolů
- Jappova–Klingemannova reakce
- Leimgruberova–Batchova syntéza indolů
- Madelungova syntéza indolů
- Reissertova syntéza indolů
- Gassmanova syntéza indolů
- Nenitzescuova syntéza indolů
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Bartoliova syntéza indolů na Wikimedia Commons
Obrázky, zvuky či videa k tématu Bartoliova syntéza indolů na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Bartoli indole synthesis na anglické Wikipedii.
- ↑ G. Bartoli; G. Palmieri; M. Bosco; R. Dalpozzo. The reaction of vinyl Grignard reagents with 2-substituted nitroarenes: A new approach to the synthesis of 7-substituted indoles. Tetrahedron Letters. 1989, s. 2129–2132. DOI 10.1016/S0040-4039(01)93730-X.
- ↑ G. Bartoli; M. Palmieri; R. Dalpozzo; G. Palmieri; E. Marcantoni. Reactivity of nitro- and nitroso-arenes with vinyl Grignard reagents: synthesis of 2-(trimethylsilyl)indoles. Journal of the Chemical Society, Perkin Transactions 1. 1991, s. 2757–2761. DOI 10.1039/p19910002757.
- ↑ A. P. Dobbs; M. Voyle; N. Whitall. Synthesis of Novel Indole Derivatives: Variations in the Bartoli Reaction. Synlett. 1999, s. 1594–1596. DOI 10.1055/s-1999-2900.
- ↑ R. Dalpozzo; G. Bartoli. Bartoli Indole Synthesis. Current Organic Chemistry. 2005, s. 163–178. Dostupné online. DOI 10.2174/1385272053369204.
- ↑ D. Dobson; A. Todd; J. Gilmore. The Synthesis of 7-Alkoxyindoles. Synthetic Communications. 1991, s. 611–617. Dostupné online. DOI 10.1080/0039791910802082.
- ↑ D. R. Dobson; J. Gilmore; D. A. Long. Synthesis of 7-Formylindole Using the Bartoli Indole Methodology. Synlett. 1992, s. 79–80. Dostupné online. DOI 10.1055/s-1992-21273.
- ↑ M. Bosco; R. Dalpozzo; G. Bartoli; G. Palmieri; M. Petrini. Mechanistic studies on the reaction of nitro- and nitrosoarenes with vinyl Grignard reagents. Journal of the Chemical Society, Perkin Transactions 2. 1991, s. 657–663. DOI 10.1039/P29910000657.
- ↑ Z. Zhang; Z. Yang; N. A. Meanwell; J. F. Kadow; T. Wang. A general method for the preparation of 4- and 6-azaindoles. The Journal of Organic Chemistry. 2002, s. 2345–2347. DOI 10.1021/jo0111614.
- ↑ A. Dobbs. Total Synthesis of Indoles from Tricholoma Species via Bartoli / Heteroaryl Radical Methodologies. Journal of Organic Chemistry. 2001, s. 638–641. DOI 10.1021/jo0057396.
