Ethyl-chlorformiát
Vzhled
| Ethyl-chlorformiát | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | ethyl-chlormethanoát |
| Funkční vzorec | ClCO(O)CH2CH3 |
| Sumární vzorec | C3H5ClO2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 541-41-3 |
| EC-no (EINECS/ELINCS/NLP) | 208-778-5 |
| PubChem | 10928 |
| SMILES | ClC(=O)OCC |
| InChI | InChI=1S/C3H5ClO2/c1-2-6-3(4)5/h2H2,1H3 |
| Vlastnosti | |
| Molární hmotnost | 108,52 g/mol |
| Teplota tání | −80,6 °C (192,6 K)[1] |
| Teplota varu | 95 °C (368 K)[1] |
| Hustota | 1,1403 g/cm3 (20 °C)[1] |
| Index lomu | 1,3947 (20 °C)[1] |
| Rozpustnost ve vodě | rozkládá se[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu a chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu a diethyletheru[1] |
| Tlak páry | 3,0 kPa[1] |
| Povrchové napětí | 27,5 mN/m (15 °C)[1] |
| Termodynamické vlastnosti | |
| Standardní molární spalná entalpie ΔH°sp | −1,28 MJ/mol[1] |
| Entalpie varu ΔHv | 542 J/g[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H301 H302 H314 H318 H330 H400[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P260 P264+265 P270 P271 P273 P280 P284 P301+316 P301+317 P301+330+331 P302+361+354 P303+361+353 P304+340 P305+354+338 P316 P317 P320 P321 P330 P363 P370+378 P391 P403+233 P403+235 P405 P501[1] |
| Teplota vzplanutí | 16 °C (289 K)[1] |
| Teplota vznícení | 500 °C (770 K)[1] |
Některá data mohou pocházet z datové položky. | |
Ethyl-chlorformiát je organická sloučenina se vzorcem ClCO2CH2CH3, ethylester kyseliny chlormravenčí. Používá se v organické syntéze na zavádění ethylkarbamátových chránicích skupin.[2] a na přípravu karboxanhydridů.
Příprava
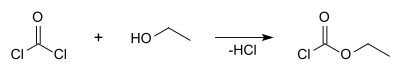
[editovat | editovat zdroj]Ethylchlorformiát lze vytvořit reakcí ethanolu s fosgenem:
Bezpečnost
[editovat | editovat zdroj]Ethylchlorformiát je vysoce toxický, hořlavý, a žíravý. Při styku s očima a/nebo kůží způsobuje těžké popáleniny, nebezpečný je i při vdechnutí a pozření.[1]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Ethyl chloroformate na anglické Wikipedii.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu ethyl-chlorformiát na Wikimedia Commons
Obrázky, zvuky či videa k tématu ethyl-chlorformiát na Wikimedia Commons