Asymetrická indukce
Asymetrická indukce neboli enantioindukce je proces, při kterém dochází u chemické reakce k přednostní tvorbě jednoho enantiomeru nebo diastereomeru, přičemž je tento jev způsoben chiralitou v substrátu, reaktantu, katalyzátoru nebo reakčním prostředí.[1] Asymetrické indukce jsou důležitými prvky asymetrických syntéz.
Asymetrickou indukci zavedĺ Hermann Emil Fischer na základě výzkumu sacharidů.[2] Tato indukce má několik druhů.
Vnitřní asymetrická indukce spočívá ve využití chirálního centra navázaného na reaktivní část molekuly kovalentní vazbou, přičemž tato vazba během reakce nezaniká. V případě předávané asymetrické indukce je chiralita zavedena v odděleném kroku a poté je použita samostatná reakce k jejímu odstranění; přitom se do reakce zapojují chirální pomocníky. Vnější asymetrické indukce se vyznačují zaváděním chirality u přechodného stavu reakce prostřednictvím katalyzátoru obsahujícího chirální ligand.
Karbonylové 1,2 asymetrické indukce[editovat | editovat zdroj]
Existuje několik modelů popisujících chirální indukce na karbonylových uhlících během nukleofilních adicí; tyto modely spojují vlivy sterických a elektronových efektů a často jsou navzájem v rozporu.
Cramovo pravidlo[editovat | editovat zdroj]
Cramovo pravidlo asymetrické indukce vytvořil Donald J. Cram v roce 1952[3] k předpovídání stereochemie reakcí některých acyklických sloučenin. Plné znění pravidla je:
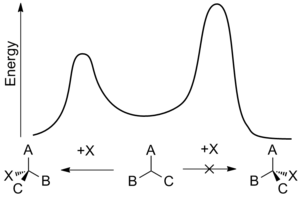
U některých nekatalytických reakcí může převládat jeden diastereomer, vytvořený přístupem navazující se skupiny z nejméně stíněné strany, kde rotační konformace vazby C-C je taková, že dvojná vazba je obklopena dvojicí stericky nejméně stínících skupin navázaných na sousední asymetrické centrum.
Pravidlo říká, že přítomnost asymetrického centra na molekule vyvolává tvorbu asymetrického centra vedle něj, a to s ohledem na sterické stínění.
V roce 1952 vydal Cram knihu, ve které popsal řadu reakcí, u kterých konformace produktů lze vysvětlit pomocí tohoto pravidla a provedl experiment (znázorněný na následujícím obrázku), který jej potvrdil:
Experimenty zahrnovaly dvě reakce. V prvním reagoval 2-fenylpropionaldehyd (1, racemický, zde je znázorněn jen (R)-enantiomer) s Grignardovým činidlem odvozeným od brombenzenu za vzniku 1,2-difenylpropan-1-olu (2), vytvořeného jako směs diastereomerů, kde převažoval threo izomer.
Převažující tvorba threo-izomeru může být vysvětlena výše uvedeným pravidlem, když při reakci aktivní nukleofil atakuje karbonylovou skupinu ze stericky nejméně stíněné strany, protože zde působí methylová skupina a atom vodíku, což jsou dva nejmenší substituenty na molekule, a fenyl na druhé straně je z nich naopak nejmohutnější.
Asymetrická indukce se projevuje také při redukci 1,2-difenylpropan-1-onu 2 hydridem lithno-hlinitým, u které mezi produkty převažuje erythro izomer (2a). Nukleofilem atakujícím nejméně stíněné místo je zde Hydridový anion (H−).
V práci z roku 1952 se také objevily důkazy podobného strukturního uspořádání u Čugajevovy eliminace, kde reagoval threo izomer za vzniku cis-α-methylstilbenu a z erythro izomeru vznikal trans-produkt.
Felkinův model[editovat | editovat zdroj]
Felkinův model, který vytvořil Hugh Felkin v roce 1968, je dalším modelem předpovídajícím stereochemii nukleofilních adicí na karbonylových skupinách.[4] Felkin si všiml, že Cramův model má výrazný nedostatek: přechodný stav má zákrytovou konformaci mezi karbonylovým substituentem a největším substituentem v poloze α vůči tomuto karbonylu. Zjistil, že postupné posilování sterických efektů při záměně substituentu karbonylu z methylové na ethylovou, isopropylovou a isobutylovou vede ke zvyšování stereoselektivity, což Cramův model nedokáže vysvětlit:
Felkinova pravidla jsou tato:
- Přechodné stavy se podobají reaktantům.
- Torzní (Pitzerovo) napětí, zahrnující i částečné vazby u přechodných stavů, má výrazný podíl na celkovém napětí. Konformace přechodného stavu není zákrytová a substituent R je vůči sousedním skupinám v šikmé poloze.
- Nejvýznamnější sterické interakce jsou okolo R a na nukleofilu, ne na karbonylovém kyslíku.
- Atakování nukleofilu probíhá v souladu s velikostí Dunitzova úhlu (107°), vodík se tak oproti karbonylu dostává do zákrytové konformace.
- Polární efekt stabilizuje přechodný stav s nukleofilem nejvíce odděleným od skupiny odtahující elektrony; například halogenketony se nechovají podle Cramova pravidla a nahrazení fenylové skupiny, která odtahuje elektrony, cyklohexylovou významně snižuje stereoselektivitu.
Felkinův–Anhův (Nguyenův) model[editovat | editovat zdroj]
Felkin–Anhův (Nguyenův) model je rozšířením Felkinova modelu zahrnujícím vylepšení, která navrhli Nguyễn Trọng Anh a Odile Eisenstein jako nápravy svou slabých míst Felkinova modelu. První z těchto slabin je silní polární efekt u přechodných stavů nukleofilních adicí, který vede k obrácení stereochemie prostřednictvím SN2 reakcí, aniž by se model snažil tento jev zdůvodnit. Anhovým řešením bylo navržení antiperiplanárního efektu jako důsledku asymetrické indukce, řídícího vlivy substituentů i orbitalů.[5][6] V tomto modelu je orbital σ* nejlepšího akceptoru nukleofilu seřazen rovnoběžně s π a π* orbitaly karbonylu, což stabilizuje přicházející anion.

Druhým nedostatkem Felkinova modelu je předpoklad minimalizace substituentu karbonylové skupiny, který nelze použít u aldehydů.
Využití Bürgiova–Dunitzova úhlu[7][8] umožnilo navrhnout neperpendikulární atak karbonylu nukleofilem, a to v rozmezí 95° až 105° vůči dvojné vazbě kyslík-uhlík, kde je snazší přístup k menšímu substituentu; tímto byla vyřešena předvídatelnost reakcí aldehydů.[5][9][10]
Protifelkinovská selektivita[editovat | editovat zdroj]
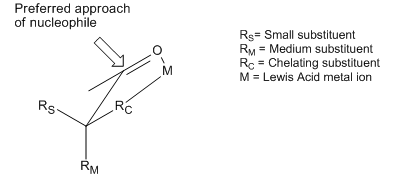
Přestože se Cramův a Felkinův–Anhův model liší konformery a jinými předpoklady, tak jsou oba pokusy o vysvětlení stejného jevu: převládající adice nukleofilu na stericky výhodné místo karbonylové skupiny.Existuje ale i mnoho reakcí se stereoselektivitou opačnou, než jakou tyto modely ve své základní podobě předpovídají. Přestože se v obou případech pokoušejí o vysvětlení opačné selektivity, tak se produkty takto obráceně probíhajících reakcí stále označují jako „protifelkinovské“. Příkladem obrácené selektivity asymetrické indukce mohou být sloučeniny, které mají α-uhlík substituovaný skupinami, které se chovají jako Lewisovy zásady (například O, N, S, P). V takovém případě po přisání Lewisovy kyseliny, jako je Al-iPr2 nebo Zn2+ dochází k bidentátní chelataci, která zadržuje karbonyl a Lewisovu zásadu ve vzájemně zákrytové konformaci a nukleofil tak molekulu atakuje na místě, kde se nachází nejmenší substituent s volným α-uhlíkem.[11] Pokud je chelatující skupina R největší, tak se tímto vytváří „protifelkinovský“ produkt.
Toto stereoselektivní řízení bylo popsáno v prvním článku popisujícím Cramův model, což Crama vedlo k tomu, že tento model vyžaduje nechelatující podmínky.[12] Příklad reakce za chelatujících podmínek, popsané roku 1987, v níž byl poprvé pozorován „Cramův chelátový meziprodukt“,[13] je na následujícím obrázku:
Methyltitaniumchlorid zde vytváří Cramův chelát, poté se od titanu odštěpuje methylová skupina, která atakuje karbonyl, čímž vzniká protifelkinovský diastereomer.
Protifelkinovskou selektivitu mohou také vyvolávat nechelatující substituenty odtahující elektrony. Pokud vytváří substituent na α-uhlíku dostatečně silné odtahování elektronů, tak se nukleofil naaduje do polohy anti- vůči skupině odtahující elektrony, a to i v těch případech, kdy tento substituent největší ze tří skupin na α-uhlíku. Každý z uvedených modelů vysvětluje tento jev jinak. V Cornforthově[14] a původním Felkinově modelu byl navržen polární efekt,[15] který měl způsobovat, že substituent substituent odtahující elektrony a nukleofil musely být vzájemně v poloze anti- , aby nejlépe vyrušily dipólový moment přechodného stavu.
Na obrázku výše je využita Newmanova projekce ke znázornění toho, jak Cornforthův a Felkinův přechodný stav umisťují skupinu odtahující elektrony do polohy anti- oproti přibližujícímu se nukleofilu, a to nezávisle na sterických efektech.
Upravený Felkinův–Anhův model, popsaný výše, používá složitější zapojení polárního efektu, kde je převažující přechodný stav stabilizován interakcemi molekulových orbitalů. Níže je uveden příklad reakce, ve které by tento jev mohl způsobovat protifelkinovskolou selektivitu; znázorněn je také navržený přechodný stav:
Karbonylová 1,3-asymetrická indukce[editovat | editovat zdroj]
Asymetrické indukce může ovlivňovat také stereoelektronové prostředí okolo β-uhlíku. K předvídání stereoselektivity takových reakcí bylo vyvinuto několik modelů.
Chelatační model[editovat | editovat zdroj]
Cramův chelatační model 1,2-indukcí lze rozšířit do podoby, kterou lze předvídat reakce chelatovaných komplexů kovů s β-alkoxyaldehydy. Nukleofil je atakován ze stericky méně stíněné strany a anti- vůči substituentu Rβ, což vytváří jako hlavní produkt anti-adukt.[16]
Ke vzniku takových chelátů musí mít kovové centrum nejméně dvě volná koordinační místa a je výhodné, aby „ochranné“ ligandy vytvořily bidentátní komplex s Lewisovou kyselinou.
Nechelatační modely[editovat | editovat zdroj]
Cramův–Reetzův model[editovat | editovat zdroj]
Stereochemii 1,3-reakcí lze řídit i v případech, kdy reakce probíhají přes acyklické přechodné stavy. V reakcích β-alkoxyaldehydů s allyltrimethylsilanem se s dobrou selektivitou tvoří anti-1,3-diol, což se dá vysvětlit Cramovým polárním modelem. Polární benzyloxy skupina je oproti karbonylu v poloze anti, čímž se omezují dipólové interakce a nukleofil atakuje objemnější ze dvou zbývajících substituentů v poloze anti.[17][18]
Evansův model[editovat | editovat zdroj]
D. A. Evans vyvinul jiný model 1,3-nechelatačních asymetrických indukcí. Navržený přechodný stav obsahuje β-stereocentrum orientované anti- vůči nukleofilu, stejně jako u Felkinova–Anhova modelu. Polární skupina X v β-stereocenteru se dostává do polohy anti- oproti karbonylu, aby byly dipólové interakce a Rβ je anti- vůči aldehydu, což omezuje sterické působení; jako hlavní produkt tak vzniká 1,3-anti-diol.[19]
Karbonylové 1,2- a 1,3-asymetrické indukce[editovat | editovat zdroj]
Pokud substrát obsahuje jak α-, tak i β-stereocentra, tak je třeba současně použít Felkinovo–Anhovo pravidlo (pro 1,2-indukce) a Evansův model (pro 1,3-indukce). Pokud mají tato stereocentra vzájemně anti-uspořádání, tak oba modely předpovídají stejný diastereomer.
Pokud se ale použije syn-substrát, tak u uvedených modelů vycházejí různé produkty. Který z těchto vlivů převládne, záleží na velikosti nukleofilu. Velké nukleofily interagují více s α-stereocentery a ve větší míře tak vzniká Felkinův produkt. Menší nukleofily vykazují převahu 1,3-reakcí.[20]
Reakce acyklických alkenů[editovat | editovat zdroj]
Chirální acyklické alkeny vykazují diastereoselektivitu při reakcích, jako jsou alkylace enolátů a epoxidace. Substituenty na alkenových skupinách mohou upřednostňovat přístup elektrofilů z jedné nebo druhé strany; tato vlastnost je základem Houkova modelu, který vytvořil Kendall Houk, předpovídajícího, že selektivita je výraznější u cis-dvojných vazeb než u vazeb trans.[21]
Ve výše zobrazeném případu cis-alkenu je znázorněna konformace, která má nejslabší sterické efekty mezi RS a methylovou skupinou. Elektrofil se přibližuje častěji od stejné strany středně velké skupiny (RM) než od velké skupiny (RL), a většinovým produktem je tak zobrazený diastereoisomer. Protože je u trans-alkenu sterické působení mezi RS a H slabší, tak je míra selektivity mnohem nižší.



Substrátové řízení u acyklických sloučenin[editovat | editovat zdroj]
Asymetrické indukce na molekulárním základu u acyklických substrátu je název myšlenky, že sterické a elektronové vlastnosti molekuly mohou ovlivňovat chiralitu následujících chemických reakcí na této molekule. Tohoto principu se využívá při organických syntézách, kdy substrát již obsahuje stereocentrum a je třeba vytvořit další.
Trojrozměrná uspořádání molekul mohou mít vliv na to, jak se budou k sobě přibližovat. Jakákoliv omezení tohoto přibližování budou působit na geometrii produktu. U asymetrických indukcí je třeba uvažovat vliv jednoho asymetrického centra na reaktivitu dalších skupin. Čím blíže k sobě se tyto skupiny nachází, tím větší vzájemné ovlivňování lze očekávat. Je možné použít počítačové simulace,[22], ale mnohdy dostačuje využití jednoduchých kvalitativních faktorů.
Asymetrické indukce u alfa-chirálních aldehydů[editovat | editovat zdroj]
Aldehydy mohou vstupovat do nukleofilních reakcí a adicí allylkovů. Stereoselektivitu nukleofilních ataků na alfa-chirálních aldehydech lze popsat Felkinovým–Anhovým modelem nebo jeho polární obdobou a reakce s nechirálními allylkovy probíhají podle Cramova pravidla.
Felkinův–Anhův a polární Felkinlv–Anhův model[editovat | editovat zdroj]
Selektivitu nukleofilních adičních reakcí chirálních aldehydů je možné vysvětlit Felkinovým–Anh modelem[23]. Nukleofil se přibližuje ke karbonylovému uhlíku v Bürgiově-Dunitzově úhlu;[24] při této trajektorii je atak spodní strany nevýhodný, protože zde sousední, objemnější, skupina vytváří silnější sterické působení.
Pokud je X elektronegativní skupina, tak se používá polární Felkinův–Anhův model, jenž vysvětluje pozorovanou stereochemii hyperkonjugační stabilizací způsobnou antiperiplanárními interakcemi mezi protivazebným orbitalem σ* vazby C-X a vznikající vazbou.
Selektivitu adicí organokovových sloučenin na aldehydy lze dosáhnout využitím organohlinitých nukleofilů namísto příslušných Grignardových či organolithných sloučenin.[25]
Cramovo pravidlo[editovat | editovat zdroj]
Adice nechirálních allylkovů na aldehydy vytváří chirální alkoholy, přičemž stereochemie produktu závisí na chiralitě α-uhlíku použitého aldehydu. Používají se allyly boru, cínu a titanu.
Cramovo pravidlo vysvětluje stereoselektivitu pomocí přechodného stavu, ve kterém volný elektronový pár kyslíku interaguje s centrálním atomem a allylová skupina se může navázat na karbonylový uhlík. Sterické působení je v přechodném stavu omezeno konfigurací α-uhlíku, která udržuje největší substituent v poloze trans vůči karbonylu a allylkovová skupina se přibližuje k nejmenší skupině navázané na α-uhlík. Na následujícím obrázku je zobrazena reakce (R)-2-methylbutanalu (1) s allylboritou sloučeninou (2) na dva možné diastereomery, přičemž hlavním produktem je (R, R)-izomer. Cramův model této reakce je znázorněn s karbonylem umístěným trans oproti ethylové (větší) skupině a allylboité činidlo se přibližuje kolem vodíku (nejmenší skupiny). Struktura je zobrazena v Newmanově projekci. Nukleofilní adice probíhá na té straně, kde se nachází vodík (jako nejmenší skupina), proto vzniká převážně (R,R)-izomer.
Použití chirálních pomocníků[editovat | editovat zdroj]
Asymetrické stereoindukce lze dosáhnout použitím chirálních pomocníků. Chirální pomocníky lze vratně navázat na substrát, čímž se před jejich odštěpením dosáhne potřebné selektivity a jeden z enantiomerů mezi produkty převládne. Jako ppříklady chirálních pomocníků lze uvést Evansovy chirální oxazolidinony (pro asymetrické aldolové reakce)[26] pseudoepfedrinamidy a terc-butansulfinamidové iminy.
Substrátové řízení u cyklických sloučenin[editovat | editovat zdroj]
Cyklické molekuly často mívají mnohem tužší konformace než molekuly lineární; i makrocykly, jako je erythromycin, mají mnohdy stálé geometrie. Vzhledem k těmto vlastnostem se u cyklických substrátu obvykle provádějí asymetrické indukce snadněji než u lineárních. Experimenty, které provedl W. Clark Still[27] ukázaly, že organické sloučeniny se středně velkými a velkými kruhy mohou vykazovat výraznou stereoindukci při reakcích jako jsou kinetické alkylace enolátů, adicích dimethylkuprátů a katalytické hydrogenace; často i jediná methylová skupina dokáže ovlivnit diastereomerní složení produktů.
Při několika totálních syntézách bylo k získání požadovaných látek využito makrocyklické stereořízení. V syntéze (−)-cladiella-6,11-dien-3-olu[28] byl trisubstituovaný alken diasetereoselektivně dihydroxylován N-methylmorfolin-N-oxidem. Do přípravy (±)-periplanonu B,[29] byla začleněna faciální selektivní epoxidace enonového meziproduktu terc-butylhydroperoxidem za přítomnosti dvou dalších alkenů. Redukce 10členného kruhu enonového meziproduktu borohydridem sodným při syntéze seskviterpenu eukanabinolidu[30] probíhala v souladu s předpověďmi na základě molekulárního modelování přes konformaci s nejnižší energií. Substrátově řízené reakce mají řadu výhod, protože k získání selektivity nevyžadují používání složitých asymetrických reaktantů.
Reaktantové řízení: adice chirálních allylkovů na nechirální aldehydy[editovat | editovat zdroj]
Reaktantové řízení je souhrn postupů, kterými se v organické syntéze selektivně vytváří jeden z několika možných stereoizomerů, přičemž je stereoselektivita určována strukturou a chiralitou použitých reaktantů. Jestliže jsou nukleofilně adovány chirální allylkovy na nechirální aldehydy, tak je chiralita nově utvořeného alkoholového uhlíku určována chiralitou allykovu; chirální centra na allylkovech většinou pocházejí z použitých asymetrických ligandů. Kovy a polokovy používanými v těchto činidlech nejčastěji bor, cín, titan a křemík.
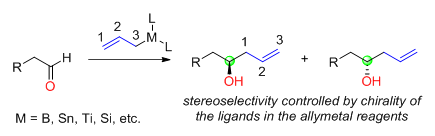
K přípravě chirálních allylkovů pro reakce s aldehydy lze použít mnoho různých chirálních ligandů; jako první jejich využití popsal Herbert C. Brown.[31] Choirální allylborany je možné získat dvoukrokově z přírodního (+)-alfa-pinenu. TADDOLové ligandy, která vyvinul Dieter Seebach, se dají využít k získání allyltitanových sloučenin.[32] Jim Leighton objevil chirální allykřemiité sloučeniny, u kterých lze díky uvolnění kruhového napětí při stereoselektivních allylacích mnoha různých aldehydů dosáhnout enantiomerních přebytků o hodnotách 95 až 98 %.[33]

Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Asymmetric induction na anglické Wikipedii.
- ↑ IUPAC Gold Book [1]
- ↑ Asymmetric Synthesis of Natural Products, Ari Koskinen ISBN 0-471-93848-3
- ↑ Studies in Stereochemistry. X. The Rule of "Steric Control of Asymmetric Induction" in the Syntheses of Acyclic Systems Donald J. Cram, Fathy Ahmed Abd Elhafez Journal of the American Chemical Society; 1952; 74(23); 5828–5835. Abstract
- ↑ Torsional strain involving partial bonds. The stereochemistry of the lithium aluminium hydride reduction of some simple open-chain ketones Marc Chérest, Hugh Felkin and Nicole Prudent Tetrahedron Letters Volume 9, Issue 18, 1968, Pages 2199-2204 DOI:10.1016/S0040-4039(00)89719-1
- ↑ a b Anh, N. T.; Eisenstein, O. Nouv. J. Chim. 1977, 1, 61
- ↑ Anh, N. T.; Eisenstein, O.; Lefour, J-M.; Dau, M-E. Journal of the American Chemical Society 1973, 95, 6146
- ↑ Bürgi, H. B.; Dunitz, J. D.; Shefter, E. Journal of the American Chemical Society 1973, 95, 5065
- ↑ Bürgi, H. B.; Dunitz, J. D.; Lehn, J. M.; Wipff, G. Tetrahedron 1974, 30, 1563
- ↑ Anh, N. T.; Eisenstein, O. Tetrahedron Letters 1976, 155
- ↑ Anh, N. T. Topics in Current Chemistry 1980, 88, 146
- ↑ Mengel A., Reiser O.Chemical Reviews, 1999, 99 (5), 1191–1224
- ↑ Cram DJ, Elhafez FA. Journal of the American Chemical Society; 1952; 74(23); 5828–5835
- ↑ Reetz MT, Hullmann M, Seitz T. Angewandte Chemie International Edition in English 1987 26, 477–480
- ↑ Cornforth JW, Cornforth MRH, Mathew KK. Journal of the Chemical Society 1959, 112–127
- ↑ Cherest M, Felkin H, Prudent N. Tetrahedron Letters 1968, 18, 2199–2204
- ↑ Reetz, M. T.; Jung, A. Journal of the American Chemical Society, 1983, 105, 4833
- ↑ Leitereg, T. J.; Cram, D. J. Journal of the American Chemical Society 1968, 90, 4011
- ↑ Reetz. M. T.; Kesseler, K.; Jung, A. Tetrahedron Letters 1984, 25, 729
- ↑ Evans, D. A.; Duffy, J. L.; Dart, M. J. Tetrahedron Letters 1994, 35, 8537
- ↑ Evans, D. A.; Dart, M. J.; Duffy, J. L.; Yang, M. G. Journal of the American Chemical Society 1996, 118, 4322
- ↑ CLAYDEN; GREEVES; WARREN; WOTHERS. Organic Chemistry. [s.l.]: Oxford University Press, 2001. Dostupné online. ISBN 978-0-19-850346-0. S. 895].
- ↑ Houk, K. N. et al., Science, 1986, 231, 1108-1117
- ↑ Anh, N. T. Topics in Current Chemistry 1980, 88, 145–162
- ↑ Burgi, H. B.; Dunitz, J. D.; Lehn, J. M.; Wipff, G. Tetrahedron. 1974. 12, 1563–1572
- ↑ Spino, C.; Granger, M. C.; Boisvert, L.; Beaulieu, C. Tetrahedron Letters, 2002, 43, 4183–4185
- ↑ Evans, D. A.; Bartroli, J.; Shih, T. L., Journal of the American Chemical Society, 1981, 103, 2127-2129
- ↑ Still, W. C.; Galynker, I. Tetrahedron 1981, 37, 3981-3996
- ↑ KIM, Hyoungsu; LEE, Hyunjoo; KIM, Jayoung; KIM, Sanghee; KIM, Deukjoon. A General Strategy for Synthesis of Both (6Z)- and (6E)-Cladiellin Diterpenes: Total Syntheses of (−)-Cladiella-6,11-dien-3-ol, (+)-Polyanthellin A, (−)-Cladiell-11-ene-3,6,7-triol, and (−)-Deacetoxyalcyonin Acetate. Journal of the American Chemical Society. 2006-12-01, s. 15851–15855. ISSN 0002-7863. DOI 10.1021/ja065782w. PMID 17147397.
- ↑ STILL, W. Clark. (.+-.)-Periplanone-B. Total synthesis and structure of the sex excitant pheromone of the American cockroach. Journal of the American Chemical Society. 1979-04-01, s. 2493–2495. ISSN 0002-7863. DOI 10.1021/ja00503a048.
- ↑ STILL, W. Clark; MURATA, Shizuaki; REVIAL, Gilbert; YOSHIHARA, Kazuo. Synthesis of the cytotoxic germacranolide eucannabinolide. Journal of the American Chemical Society. 1983-02-01, s. 625–627. ISSN 0002-7863. DOI 10.1021/ja00341a055.
- ↑ Brown, H. C.; Jadhav, P. K. Journal of the American Chemical Society 1983, 105, 2092
- ↑ Duthaler, R. O.; Hafner, A. Chemical Reviews 1992, 92, 807
- ↑ Kinnaird, J. W. A.; Ng, P. Y.; Kubota, K.; Wang, X.; Leighton, J. L. Journal of the American Chemical Society 2002, 124, 7920.