2,6-lutidin
| 2,6-lutidin | |
|---|---|
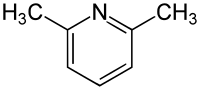 Strukturní vzorec | |
| Obecné | |
| Systematický název | 2,6-dimethylpyridin |
| Ostatní názvy | lutidin |
| Sumární vzorec | C7H9N |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 108-48-5 |
| EC-no (EINECS/ELINCS/NLP) | 203-587-3 |
| PubChem | 7937 |
| SMILES | CC1=CC=CC(C)=N1 |
| InChI | 1S/C7H9N/c1-6-4-3-5-7(2)8-6/h3-5H,1-2H3 |
| Vlastnosti | |
| Molární hmotnost | 107,15 g/mol |
| Teplota tání | −6 °C (267 K)[1] |
| Teplota varu | 144 °C (417 K)[1] |
| Hustota | 0,9252 g/cm3 (20 °C)[1] |
| Index lomu | 1,4953 (20 °C)[1] |
| Disociační konstanta pKa | 6,60 (konjugovaná kyselina)[1] |
| Rozpustnost ve vodě | 30 g/100 ml (34 °C)[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu a acetonu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru a tucích |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H226 H302 H315 H319[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P264 P270 P280 P301+312 P302+352 P303+361+353 P305+351+338 P321 P330 P332+313 P337+313 P362 P370+378 P403+235 P501[1] |
Některá data mohou pocházet z datové položky. | |
2,6-lutidin je organická sloučenina, dimethylovaný derivát pyridinu.
Výskyt, příprava a výroba[editovat | editovat zdroj]
2,6-lutidin byl objeven v zásaditých frakcích z uhelného dehtu a Dippelova oleje.[2]
V laboratoři jej lze připravit kondenzací ethyl-acetacetátu, formaldehydu a amoniaku za tvorby bis(karboxyester)u 2,6-dimethyl-1,4-dihydropyridinu, který se hydrolyzuje a vzniklý produkt se nakonec dekarboxyluje.[3] Průmyslově se vyrábí reakcí formaldehydu, acetaldehydu a amoniaku.[4]
Použití[editovat | editovat zdroj]
2,6-lutidin byl díky svému aromatu připomínajícímu ořechy, je-li přítomen ve velmi nízkých koncentracích, schválen jako potravinářská přídatná látka.
Vlivem sterických efektů vyvolávaných methylovými skupinami je 2,6-lutidin jen slabým nukleofilem. Protonací z něj vzniká lutidiniový kation, [(CH3)2C5H3NH]+, jehož soli se občas používají jako slabé kyseliny, protože konjugovaná zásada (2,6-lutidin) špatně tvoří komplexy. Díky tomu mívá využití v organické syntéze jako slabá zásada.[5]
Rozklad[editovat | editovat zdroj]
Biodegradace pyridinů probíhá několika způsoby.[6] I když je pyridin velmi dobým zdrojem uhlíku, dusíku a energie u některých mikroorganismů, tak methylové skupiny jeho rozklad výrazně zpomalují. V půdě je 2,6-lutidin mnohem více odolný vůči mikrobiálnímu rozkladu než jakýkoliv pikolin (souhrnné označení pro izomery monomethylpyridinu) nebo 2,4-lutidin.[7] Úplný rozklad trvá déle než 30 dnů.[8]
Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku 2,6-Lutidine na anglické Wikipedii.
- ↑ a b c d e f g h i j k l 2,6-Dimethylpyridine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Merck Index, 11th Edition, 5485
- ↑ Alvin Singer; S. M. McElvain. 2,6-Dimethylpyridine. Organic Syntheses. 1934, s. 30. DOI 10.15227/orgsyn.014.0030.
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. Příprava vydání Wiley-VCH. 1. vyd. [s.l.]: Wiley Dostupné online. ISBN 978-3-527-30385-4, ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a22_399. (anglicky) DOI: 10.1002/14356007.
- ↑ Daniel R. Prudhomme; Minnie Park; Zhiwei Wang; Jason R. Buck; Carmelo J. Rizzo. Synthesis of 2'-Deoxyribonucleosides: Β-3',5'-Di-o-benzoylthymidine. Organic Syntheses. 2000, s. 162. DOI 10.15227/orgsyn.077.0162.
- ↑ Bodo Philipp; Malte Hoff; Florence Germa; Bernhard Schink; Dieter Beimborn; Volker Mersch-Sundermann. Biochemical Interpretation of Quantitative Structure-Activity Relationships (QSAR) for Biodegradation of N-Heterocycles: A Complementary Approach to Predict Biodegradability. Environmental Science & Technology. 2007, s. 1390–1398. Dostupné online. DOI 10.1021/es061505d. PMID 17593747.
- ↑ G. K. Sims; L. E. Sommers. Degradation of pyridine derivatives in soil. Journal of Environmental Quality. 1985, s. 580–584. DOI 10.2134/jeq1985.00472425001400040022x.
- ↑ G. K. Sims; L. E. Sommers. Biodegradation of Pyridine Derivatives in Soil Suspensions. Environmental Toxicology and Chemistry. 1986, s. 503–509. DOI 10.1002/etc.5620050601.


