Lawessonovo činidlo
| Lawessonovo činidlo | |
|---|---|
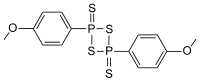 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 2,4-bis(4-methoxyfenyl)-1,3,2,4-dithiadifosfetan-2,4-disulfid |
| Sumární vzorec | C14H14O2P2S4 |
| Vzhled | bílý až světle žlutý nebo hnědý prášek[1] |
| Identifikace | |
| Registrační číslo CAS | 19172-47-5 |
| EC-no (EINECS/ELINCS/NLP) | 242-855-4 |
| PubChem | 87949 |
| SMILES | COC1=CC=C(C=C1)P2(=S)SP(=S)(S2)C3=CC=C(C=C3)OC |
| InChI | 1S/C14H14O2P2S4/c1-15-11-3-7-13(8-4-11)17(19)21-18(20,22-17)14-9-5-12(16-2)6-10-14/h3-10H,1-2H3 |
| Vlastnosti | |
| Molární hmotnost | 404,47 g/mol |
| Teplota tání | 229 °C (502 K)[1] |
| Rozpustnost ve vodě | nerozpustný |
| Bezpečnost | |
| [1] | |
| H-věty | H261 H302 H312 H332[1] |
| P-věty | P231+232 P261 P264 P270 P271 P280 P301+317 P302+352 P304+340 P317 P330 P362+364 P370+378 P402+404 P501[1] |
Některá data mohou pocházet z datové položky. | |
Lawessonovo činidlo je chemická sloučenina používaná v organické syntéze jako thiační činidlo. Jeho využívání zavedl Sven-Olov Lawesson, který ovšem nebyl jeho objevitelem. Poprvé byla tato látka připravena v roce 1956 při průzkumu reakcí arenů se sulfidem fosforečným (P4S10).[2]
Příprava[editovat | editovat zdroj]
Lawessonovo činidlo lze zakoupit, případně získat v laboratoři zahříváním směsi anisolu a sulfidu fosforečného do čirého zabarvení, kdy se již neuvolňuje sulfan,[3] a následnou rekrystalizací z toluenu nebo xylenu.
Vzorky této látky se vyznačují zápachem, způsobeným tvorbou sulfanu částečnou hydrolýzou. Zápach lze odstranit chlornanem sodným.
Mechanismus účinku[editovat | editovat zdroj]
Lawessonovo činidlo obsahuje čtyřčlenný kruh s dvojicemi atomů síry a fosforu. Tento kruh se disociuje na dva reaktivní dithiofosfiové ylidy (R-PS2). Většinu reakcí Lawessonova činidla zprostředkovává tento meziprodukt.
Čím je karbonylová sloučenina bohatší na elektrony, tím rychleji se bude její karbonylová skupina přeměňovat na příslušný thiokarbonyl.
Použití[editovat | editovat zdroj]
Chemické vlastnosti Lawessonova činidla a jemu podobných látek byly několikrát přezkoumány.[4][5][6][7]
Hlavním využitím Lawessonova činidla jsou thionace karbonylových sloučenin, tedy přeměna karbonylů (aldehydů a ketonů) na thiokarbonyly (thialy a thioketony).[8] Lawessonovo činidlo může také thionovat enony, estery,[9] laktony,[10]amidy, laktamy[11] a chinony.
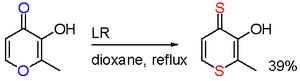
V jedné studii vedla reakce maltolu s Lawessonovým činidlem k selektivnímu nahrazení kyslíku na dvou místech.[12]
Spojením chloristanu stříbrného a Lawessonova činidla lze vytvořit oxofilní Lewisovu kyselinu, schopnou katalyzovat Dielsovy–Alderovy reakce dienů s α,β-nenasycenými aldehydy.
Některé alkoholy je možné přeměnit na thioly pomocí Lawessonova činidla.[13]
Lawessonovo činidlo reaguje se sulfoxidy za vzniku thioetherů.[6]
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Lawesson's reagent na anglické Wikipedii.
- ↑ a b c d e https://pubchem.ncbi.nlm.nih.gov/compound/87949
- ↑ H. Z. Lecher; R. A. Greenwood; K. C. Whitehouse; T. H. Chao. The Phosphonation of Aromatic Compounds with Phosphorus Pentasulfide. Journal of the American Chemical Society. 1956, s. 5018. DOI 10.1021/ja01600a058.
- ↑ THOMSEN, I.; CLAUSEN, K.; SCHEIBYE, S.; LAWESSON, S.-O. Thiation with 2,4-Bis(4-methoxyphenyl)-1,3,2,4-Dithiadiphosphetane 2,4-disulfide: N-Methylthiopyrrolidone. Org. Synth.. 1984, s. 158. DOI 10.15227/orgsyn.062.0158.
- ↑ R. A. Cherkasov; G. A. Kutyrev; A. N. Pudovik. Tetrahedron report number 186 Organothiophosphorus reagents in organic synthesis. Tetrahedron. 1985, s. 2567. DOI 10.1016/S0040-4020(01)96363-X.
- ↑ M. S. Foreman; J. D. Woollins. Organo-P–S and P–Se heterocycles. Journal of the Chemical Society, Dalton Transactions. 2000, s. 1533–1543. DOI 10.1039/b000620n.
- ↑ a b Martin Jesberger; Thomas P. Davis; Leonie Barner. Applications of Lawesson's Reagent in Organic and Organometallic Syntheses. Synthesis. 2003, s. 1929–1958. Dostupné online. DOI 10.1055/s-2003-41447.
- ↑ M. P. Cava; M. I. Levinson. Thionation reactions of Lawesson's reagents. Tetrahedron. 1985, s. 5061–5087. DOI 10.1016/S0040-4020(01)96753-5.
- ↑ B. S. Pedersen; S. Scheibye; N. H. Nilsson; S.-O. Lawesson. Studies on organophosphorus compounds XX. syntheses of thioketones. Bulletin des Sociétés Chimiques Belges. 1978, s. 223–228. DOI 10.1002/bscb.19780870310.
- ↑ B. A. Jones; J. S. Bradshaw. Synthesis and reduction of thiocarboxylic O-esters. Chemical Reviews. 1984, s. 17. DOI 10.1021/cr00059a002.
- ↑ S. Scheibye; J. Kristensen; S.-O. Lawesson. Studies on organophosphorus compounds XXVII. Synthesis of thiono-, thiolo- and dithiolactones. Tetrahedron. 1979, s. 1339–1343. DOI 10.1016/0040-4020(79)85027-9.
- ↑ R. Shabana; S. Scheibye; K. Clausen; S. O. Olesen; S.-O. Lawesson. Studies on organophosphorus compounds XXXI. Synthesis of thiolactams and thioimides. Nouveau Journal de Chimie. 1980, s. 47.
- ↑ D. Brayton; F. E. Jacobsen; S. M. Cohen; P. J. Farmer. A novel heterocyclic atom exchange reaction with Lawesson's reagent: a one-pot synthesis of dithiomaltol. Chemical Communications. 2006, s. 206–208. DOI 10.1039/b511966a. PMID 16372107.
- ↑ Takehiko Nishio. A novel transformation of alcohols to thiols. Journal of the Chemical Society, Chemical Communications. 1989, s. 205–206. DOI 10.1039/C39890000205.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Lawessonovo činidlo na Wikimedia Commons
Obrázky, zvuky či videa k tématu Lawessonovo činidlo na Wikimedia Commons - Lawesson's Reagent [online]. Organic Chemistry Portal [cit. 2007-10-16]. Dostupné online.