Oxidace katalyzovaná oxoamoniem
Oxidace katalyzované oxoamoniem jsou organické reakce, při kterých se organické sloučeniny oxidují s využitím N-oxoamonných solí. Lze při nich použít také katalytická množství nitroxidů se stechiometrickým množstvím koncových oxidantů.[1] Použitými nitroxidy bývají 2,2,6,6-tetramethylpiperidin-1-oxyl (TEMPO) či jeho deriváty.
(1)

Mechanismus a stereochemie
[editovat | editovat zdroj]Jednoelektronovou oxidací nitroxidu vznikne silně elektrofilní oxoamonná sůl, která je aktivním oxidačním činidlem.[2] Nitroxid může sloužit jako katalyzátor ve spojení s levnějšími stechiometrickými oxidačními činidly, jako je například chlornan sodný[3] nebo bis(acetoxy)jodbenzen (BAIB).[4]
Za neutrálního nebo mírně kyselého pH se oxidace uskutečňuje na vodíkové vazbě mezi hydroxylovou skupinou a oxoamoniovým dusíkem, po čemž následuje přenos protonu a odštěpení hydridu.[5] Mechanismus oxidace za slabě zásaditých podmínek (například v pyridinu) je podobný, zásada pouze neutralizuje hydroxyamonné ionty a takto vytvořený meziprodukt se synproporcionuje s oxoamonnou solí na nitroxidové radikály a pyridiniovou sůl (viz rovnici (3) níže). Protože se při reakci spotřebovává zásada a aktivní oxidant, tak jsou v zásaditém prostředí potřeba dva ekvivalenty každé z těchto látek. V roce 2015 byl popsán jednotný mechanismus pro neutrální a mírně zásaditá prostředí.[6]
(2)

Za silně zásaditých podmínek deprotonovaný substrát reaguje s N-oxoamonnou solí. K ataku může přitom dojít na alkoxidové skupině substrátu nebo na dusíku či kyslíku, i když se na základě pozorování oxidací N-alkoxyaminů (probíhajících přes meziprodukt 1) předpokládá, že převažuje první z těchto možností.[7] Vedle oxidace probíhá též synproporcionace redukovaného produktu (často je tak nutný nadbytek oxidačního činidla.
(3)

Při oxidacích katalyzovaných nitroxidy jsou aktivními oxidačními činidly N-oxoamonné sloučeniny. Mechanismus oxidace nitroxidového radikálu závisí na použitém koncovém oxidantu. Dvouelektronová oxidační činidla, jako například NaOCl, mohou přeměňovat nitroxidy přímo na oxoamonné sloučeniny.
(4)

Jednoelektronová oxidační činidla, například měďnaté soli, oxidují složitějším mechanismem, zahrnujícím dikyslík.[8] Měďnaté sloučeniny oxidují čtyři ekvivalenty nitroxidu na oxoamonium, přičemž dva z nich (znázorněné modře) reagují s alkoholem za vzniku karbonylové sloučeniny. Další dva ekvivalenty (červeně) se synproporcionují a obnovují nitroxidové radikály (růžově). Nakonec dikyslík zpětně oxiduje čtyři ekvivalenty měďného meziproduktu na měďnatou sloučeninu. Jedna molekula dikyslíku tak zoxiduje dvě molekuly alkoholu za uvolnění dvou molekul vody.
(5)

Stereoselektivní varianty
[editovat | editovat zdroj]Enantioselektivní oxidace se obvykle provádějí pomocí kinetického rozlišení chirálních alkoholů nebo desymetrizačními reakcemi. Lze jich dosáhnout použitím chrálních nitroxidových katalyzátorů; příkladem může být kinetické rozlišení racemického 1-fenylethanolu.[9] Oxidační desymetrizace se provádějí s oxoamonnými oxidanty a jsou vzácnější.[10]
(6)

Rozsah
[editovat | editovat zdroj]Oxidace s využitím oxoamonných solí mohou být prováděny stechiometricky i katalyticky a v kyselých i zásaditých prostředích. I když lze s TEMPO oxidovat velký počet různých alkoholů, tak někdy souběžně probíhají oxidace skupin bohatších na elektrony. Selektivita oxidací polyolů se může lišit v závislosti na podmínkách reakce.
Stechiometrické oxidace
[editovat | editovat zdroj]Za mírně kyselých nebo neutrálních podmínek oxoamonné soli, jako je Bobbittova sůl, oxidují allylové, benzylové,[11] propargylové[12] a jiné alfatické alkoholy. Sekundární alkoholy reagují rychleji než primární, selektivita je ale nízká. Oxoamonné soli je možné obnovovat.[12]
(7)

Aminy, benzylethery a alkeny se oxidují rychleji než neaktivované alkoholy; selektivní stechiometrické oxidace neaktivovaných alkoholů tak nejsou možné, pokud jsou přítomny tyto skupiny.[13] Alkoholy s β-dusíkovými nebo β-kyslíkovými substituenty reagují v kyselých prostředích špatně.[12] Allyl- a benzylalkoholy za těchto podmínek lze oxidovat selektivně.[13]
(8)

V zásaditém prostředí jsou potřeba dva ekvivalenty oxidantu, protože se objevují vedlejší reakce v podobě synproporcionací redukovaných nitroxidů a nezreagovaných oxoamoných solí (viz výše uvedenou rovnici (3)). Zásadou je nejčastěji pyridin. Tyto podmínky jsou při stechiometrických oxidacích za použití nitroxidů nejčastější.
(9)

I terciární allylalkoholy lze pomocí oxoamonných solí oxidovat stechiometricky; produkty jsou enony a jedná se o obdobu Bablerovy-Daubenovy reakce.[14]
Katalytické oxidace
[editovat | editovat zdroj]Katalytické oxidace katalyzované oxoamonnými solemi mohou být uskutečněny s chlornanem sodným. Hodnota pH se musí udržovat pod 10 pomocí pufru. Aktivním oxidačním činidlem je bromnanový anion, z tohoto důvodu se do reakční směsi přidává bromid draselný.[3] U produktů obsahujících karbonylové skupiny nebyla pozorována žádná epimerizace α-stereogenních center.
(10)

Použití chloritanů jako koncových oxidačních činidel ve spojení s chlornany a TEMPO vede k tvorbě karboxylových kyselin bez vytváření chlorovaných vedlejších produktů.[15] Reakce je dvoukroková a většinou se provádí oba kroky ve stejné nádobě: nejprve se provede částečná oxidace pomocí TEMPO a chlornanu a následně se přidá chloritan a reakce se dokončí. Tímto způsobem se oxidují pouze primární alkoholy. Ve spojení se Sharplessovou dihydroxylací lze tímto způsobem získat enantiomerně čisté α-hydroxykyseliny.[16]
(11)

Obě výše uvedené metody jsou omezeny nemožností použití substrátů obsahujících aminové a alkenové skupiny, protože u obou dochází k nežádoucím oxidacím; tento nedostatek lze vyřešit bis(acetoxy)jodbenzenem(BAIB) jako koncovým oxidantem. BAIB nemůže oxidovat nitroxidové radikály přímo a původní tvorba oxoamonných iontů je pravděpodobně způsobena kysele katalyzovanou disproporcionací. BAIB může následně zoxidovat vzniklý hydroxylamin na oxoamonnou sůl. Přestože reakce probíhá v kyselém prostředí (vedlejším produktem je kyselina octová, která se mnohdy i přidává za účelem usnadnění disproporcionace), tak se objevuje významná selektivita ve prospěch oxidace primárního alkoholu.[4] Skupiny citlivé na zásady, jako jsou epoxidy, lze za těchto podmínek použít.[17]
(12)
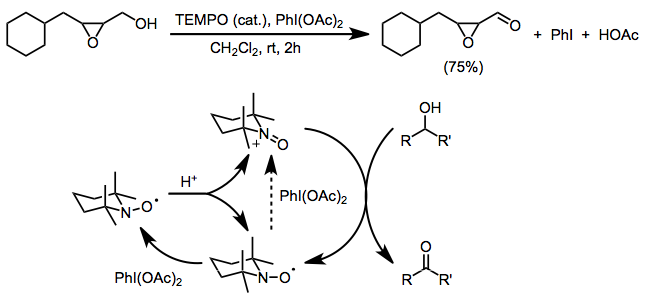
K dvouelektronovým oxidačním činidlům používaným s TEMPO patří také kyselina m-chlorperoxybenzoová (převládá oxidace sekundárních alkoholových skupin, i když se mohou objevit vedlejší reakce),[18] N-chlorsukcinimid,[19] and Oxon.[20]
Měďné sloučeniny, jako volné soli i jako komplexy s bidentátními ligandy, oxidují TEMPO na příslušnou oxoamonnou sůl. Koncovým oxidantem je zde vzduch.[21] Není jasné, jestli vzduch oxiduje měďný meziprodukt na měďnatý, nebo je oxidace alkoholu částečně řízená mědí a vzduch oxiduje vytvořený hydroxylamin zpět na oxoamonnou sůl. První varianta se objevuje ve Wackerově procesu, zatímco druhá dokáže vysvětlit, proč komplexy mědi (a několika jiných kovů) oxidují alkoholy společně s TEMPO.
(13)

Podobné postupy
[editovat | editovat zdroj]Aktivovaný oxid manganičitý, jenž oxiduje allyl- a benzylalkoholy, je levnější než TEMPO a provedení reakce se snadné.[22] Chromová činidla, jako chlorochroman pyridinia, mohou také převádět alkoholy na karbonylové sloučeniny; i když stechiometrická tvorba chromového odpadu není žádoucí.[23] Oxidace, do kterých je zapojen dimethylsulfoxid (DMSO), jako je Swernova a Moffattova oxidace, nevyžadují toxické sloučeniny a lze jimi přeměnit široké spektrum substrátů.[24] Oxoamoniové oxidace jsou oproti DMSO vhodnější u diolů a acetylenových alkoholů. Dessův–Martinův perjodinan je vysoce selektivní a lze jej použít za mírných podmínek, ovšem obtížně se připravuje a je méně bezpečný.[25]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Oxoammonium-catalyzed oxidation na anglické Wikipedii.
- ↑ Bobbitt, J. M.; Bruckner, C.; Merbouh, N. Organic Reactions 2009, 74, 103. DOI:10.1002/0471264180.or074.02
- ↑ Merbouh, N.; Bobbitt, J. M.; Brückner, C. The Journal of Organic Chemistry 2004, 69, 5116.
- ↑ a b Sheldon, R. A.; Arends, I. W. C. E.; ten Brink, G. J.; Dijksman, A. Accounts of Chemical Research. 2002, 35, 774. DOI:10.1021/ar010075n
- ↑ a b De Mico, A.; Margarita, R.; Parlanti, L.; Vescovi, A.; Piancatelli, G. The Journal of Organic Chemistry 1997, 62, 6974.
- ↑ Bailey, W. F.; Bobbitt, J. M.; Wiberg, K. B. The Journal of Organic Chemistry 2007, 72, 4504.
- ↑ Hamlin, T. A.; Kelly, C. B.; Ovian, J. M.; Wiles, R. J.; Tilley, L. J.; Leadbeater, N. E. The Journal of Organic Chemistry 2015, 80, 8150.
- ↑ Semmelhack, M. F.; Schmid, C. R.; Cortés, D. A. Tetrahedron Letters 1986, 27, 1119.
- ↑ Semmelhack, M. F.; Schmid, C. R.; Cortés, D. A.; Chou, C. S. Journal of the American Chemical Society 1984, 106, 3374.
- ↑ Rychnovsky, S. D.; McLernon, T. L.; Rajapakse, H. The Journal of Organic Chemistry 1996, 61, 1194.
- ↑ Tanaka, H.; Kawakami, Y.; Goto, K.; Kuroboshi, M. Tetrahedron Letters 2001, 42, 445.
- ↑ Miyazawa, T.; Endo, T.; Shiihashi, S.; Okawara, M. The Journal of Organic Chemistry 1985, 50, 1332.
- ↑ a b c Bobbitt, J. M. The Journal of Organic Chemistry 1998, 63, 9367.
- ↑ a b Bobbitt, J. M.; Merbouh, N. Organic Syntheses 2005, 82, 80
- ↑ Masatoshi Shibuya; Masaki Tomizawa; Yoshiharu Iwabuchi. Oxidative Rearrangement of Tertiary Allylic Alcohols Employing Oxoammonium Salts. The Journal of Organic Chemistry. 2008, s. 4750–4752. Dostupné online. ISSN 0022-326. DOI 10.1021/jo800634r. PMID 185008383.
- ↑ Song, Z. J.; Zhao, M.; Desmond, R.; Devine, P.; Tschaen, D. M.; Tillyer, R.; Frey, L.; Heid, R.; Xu, F.; Foster, B.; Li, J.; Reamer, R.; Volante, R.; Grabowski, E. J. J.; Dolling, U. H.; Reider, P. J.; Okada, S.; Kato, Y.; Mano, E. The Journal of Organic Chemistry 1999, 64, 9658.
- ↑ Sharpless, K. B.; Amberg, W.; Bennani, Y. L.; Crispino, G. A.; Hartung, J.; Jeong, K. S.; Kwong, H. L.; Morikawa, K.; Wang, Z. M.; Xu, D.; Zhang, X. L. The Journal of Organic Chemistry 1992, 57, 2768.
- ↑ De Mico, A.; Margarita, R.; Parlanti, L.; Vescovi, A.; Piancatelli, G. The Journal of Organic Chemistry 1997, 62, 6974.
- ↑ Ganem, B. The Journal of Organic Chemistry 1975, 40, 1998.
- ↑ Einhorn, J.; Einhorn, C.; Ratajczak, F.; Pierre, J.-L. The Journal of Organic Chemistry 1996, 61, 7452.
- ↑ Bolm, C.; Magnus, A. S.; Hildebrand, J. P. Organic Letters 2000, 2, 1173.
- ↑ Sheldon, R. A.; Arends, I. W. C. E. Advanced Synthesis & Catalysis 2004, 346, 1051.
- ↑ Taylor, R. J. K.; Reid, M.; Foot, J.; Raw, S. A. Accounts of Chemical Research 2005, 38, 851.
- ↑ Luzzio, F. A. Organic Reactions 1998, 53, 1.
- ↑ Tidwell, T. T. Organic Reactions 1990, 39, 297.
- ↑ Dess, D. B.; Martin, J. C. Journal of the American Chemical Society 1991, 113, 7277.
