Bablerova oxidace
Bablerova nebo Bablerova-Daubenova oxidace je organická chemická reakce spočívající v oxidaci terciárních allylových alkoholů na enony pomocí chlorochromanu pyridinia (PCC):[1]
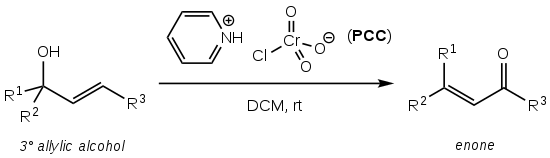
Objevil ji James Babler v roce 1976[1][2] a William Dauben rozšířil v roce 1977 její použití na cyklické sloučeniny, čímž zvýšil její syntetickou využitelnost:[1][3]

Výtěžnost reakce bývá vysoká (obvykle nad 75 %), její provedení je snadné a nemusí probíhat za nepřístupu vzduchu nebo zahřívání.[1] Nedostatkem je vysoká toxicita chlorchromanu pyridinia.
Jako rozpouštědlo se nejčastěji používá dichlormethan nebo chloroform (CHCl3).[1][2]
Tato reakce se stala krokem několika totálních syntéz, například morfinu.[1][4]
Mechanismus
[editovat | editovat zdroj]
Při Balerově oxidaci se nukleofilním atakem chlorochromanu na allylalkohol vytváří ester kyseliny chromové (1). Tento ester poté projde [3,3]-sigmatropním přesmykem za vzniku izomerního esteru (2). Oxidací tohoto meziproduktu se vytvoří α,β-nenasycený aldehyd nebo keton (3).[1]
Jiná činidla
[editovat | editovat zdroj]Toxicita a karcinogenita PCC a skutečnost, že chromové sloučeniny znečišťují povrchové vody, vedly ke snaze nahradit jej jinými činidly. Úspěchy byly dosaženy například u N-oxoamonných solí odvozených od 2,2,6,6-tetramethylpiperidinu:[1][5]
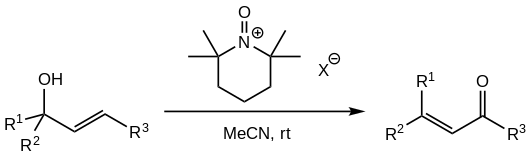
Používají se oxoamonné soli nekoordinujících aniontů, jako jsou tetrafluorboritany, chloristany, hexafluorfosforečnany a hexafluorantimoničnany.[5] Oxidační činidlo se přidává v přebytku, obvykle 1,5 ekvivalentu.
Další možností je použití katalytického množství PCC a přebytku jiného oxidantu, kdy se chromová sloučenina zpětně oxiduje a vzniká katalytický cyklus. Nejčastějšími stechiometrickými činidly jsou di-terc-butylperoxid, kyselina jodoxybenzoová a jodistany.[1]
Oxidace sekundárních alkoholů
[editovat | editovat zdroj]Bablerovy-Daubenovy oxidace sekundárních allylalkoholů jsou obtížněji řiditelné než u terciárních, protože se vedle požadovaného produktu (a) tvoří také vedlejší produkty (b) a (c):[1]
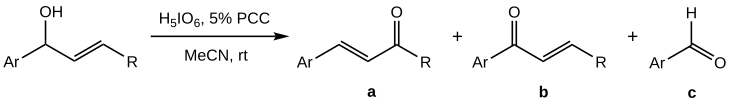
Výtěžnost reakce vzhledem k a je nejvyšší, pokud se PCC používá jako kooxidant; největších výtěžků (50 až 70 % a) bylo dosaženo při použití kyseliny jodisté jako hlavního oxidačního činidla a 5 molárních % PCC.[1]; rozpouštědlem byl přitom acetonitril namísto dichlormethanu.
Oproti terciárním alkoholům byly oxidace sekundárních úspěšné pouze u substrátů s aromatickými substituenty. Tato skutečnost, se silně kyselým prostředím v důsledku použití stechiometrického množství kyseliny jodisté, naznačuje že se původně vytvořený ester izomerizuje přes karbokation a nedochází k sigmatropní reakci, jako u terciárních alkoholů.[1]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Babler oxidation na anglické Wikipedii.
- ↑ a b c d e f g h i j k l Patrick M. Killoran; Steven B. Rossington; James A. Wilkinson; John A. Hadfield. Expanding the scope of the Babler–Dauben oxidation: 1,3-oxidative transposition of secondary allylic alcohols. Tetrahedron Letters. 2016-08-31, s. 3954–3957. Dostupné online. ISSN 0040-4039. DOI 10.1016/j.tetlet.2016.07.076.
- ↑ a b James H. Babler; Michael J. Coghlan. A Facile Method for the Bishomologation of Ketones to α,β-Unsaturated Aldehydes: Application to the Synthesis of the Cyclohexanoid Components of the Boll Weevil Sex Attractant. Synthetic Communications. 1976, s. 469–474. Dostupné online. ISSN 0039-7911. DOI 10.1080/00397917608082626.
- ↑ William G. Dauben; Drake M. Michno. Direct oxidation of tertiary allylic alcohols. A simple and effective method for alkylative carbonyl transposition. The Journal of Organic Chemistry. 1977-03-01, s. 682–685. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo00424a023.
- ↑ Hiroshi Nagata; Norio Miyazawa; Kunio Ogasawara. A concise route to (−)-morphine. Chemical Communications. 2001, s. 1094–1095. Dostupné online. ISSN 1364-548X. DOI 10.1039/B101668G.
- ↑ a b Masatoshi Shibuya; Masaki Tomizawa; Yoshiharu Iwabuchi. Oxidative Rearrangement of Tertiary Allylic Alcohols Employing Oxoammonium Salts. The Journal of Organic Chemistry. 2008-06-01, s. 4750–4752. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo800634r. PMID 18500838.
