Kyselina jodoxybenzoová
| Kyselina jodoxybenzoová | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1-hydroxy-1λ5,2-benziodoxol-1,3-dion |
| Ostatní názvy | kyselina 2-jodoxybenzoová, 1-hydroxy-1λ3,2-benziodoxol-3(1H)-on-1-oxid, IBX |
| Sumární vzorec | C7H5IO4 |
| Identifikace | |
| Registrační číslo CAS | 61717-82-6 |
| EC-no (EINECS/ELINCS/NLP) | 629-407-7 |
| PubChem | 339496 |
| ChEBI | 52701 |
| SMILES | O=C1OI(=O)(O)c2ccccc12 |
| InChI | 1S/C7H5IO4/c9-7-5-3-1-2-4-6(5)8(10,11)12-7/h1-4H,(H,10,11) |
| Vlastnosti | |
| Molární hmotnost | 280,02 g/mol |
| Teplota rozkladu | 233 °C (506 K) |
| Bezpečnost | |
| [1] | |
| H-věty | H314 H315 H319 H335[1] |
| P-věty | P260 P261 P264 P265 P271 P280 P301+330+331 P302+352 P304+340 P305+351+338 P321 P363 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Kyselina jodoxybenzoová (zkráceně IBX) je organická sloučenina používaná v organické syntéze jako oxidační činidlo. Používá se na oxidace alkoholů na aldehydy. IBX se připravuje z kyseliny 2-jodbenzoové, bromičnanu draselného a kyseliny sírové.[2] Bromičnan draselný lze nahradit lépe dostupným hydrogenperoxosíranem.[3]
Nevýhodou této sloučeniny je její špatná rozpustnost; IBX je ve většině běžných organických rozpouštědel nerozpustná. V minulosti byla IBX považována za citlivou na náraz, ovšem zjistilo se, že tato citlivost vzorků IBX byla pravděpodobně způsobena zbytky bromičnanu draselného z její přípravy.[3][4]
Komerčně prodávané vzorky IBX jsou stabilizovány karboxylovými kyselinami. například benzoovou nebo isoftalovou.
Mechanismus oxidací[editovat | editovat zdroj]
Reakční mechanismus oxidace alkoholu na aldehyd, jak bylo zjištěno metodami výpočetní chemie začíná výměnou ligandů,[5] kdy se odštěpí hydroxylová skupina z alkoholu, poté proběhne eliminace. Úvodní krok je nutný, protože dvojná vazba mezi jodem a kyslíkem je mimo rovinu alkoxy skupiny a soustředěná eliminace tak neprobíhá. Dochází v něm k přesmyku, kdy se atom kyslíku přemístí do správné polohy a eliminací se poté utvoří pětičlenný cyklický meziprodukt; tato část určuje rychlost reakce. Tímto mechanismem lze vysvětlit, proč oxidace probíhá rychleji u alkoholů s většími molekulami než u menších. Jeho hnací silou jsou sterické efekty vyvolané ortho-vodíkem a protony z alkoxyskupiny, u větších alkoxyskupin je sterické odpuzování větší. Podle stejných výpočtů reaguje přibližně 100krát rychleji derivát IBX s ortho-vodíkem nahrazeným methylovou skupinou.

IBX se vyskytuje jako směs dvou tautomerů, kde jeden z nich má podobu karboxylové kyseliny. Kyselost IBX, jež byla změřena ve vodném roztoku (pKa 2,4) a dimethylsulfoxidu (pKa 6,65),[6] má na reakce významný vliv, což se projevuje například u kysele katalyzovaných izomerizací zahrnujících oxidace.
Rozsah[editovat | editovat zdroj]
Kyselina jodoxybenzoová je také dostupná jako navázaná na silikagel nebo polystyren. V mnoha případech se nahrazuje Dessovým–Martinovým perjodinanem, lépe rozpustným v obvyklých organických rozpouštědlech. Jako příklad reakce může sloužit oxidace pomocí této kyseliny zahrnutá do totální syntézy eikosanoidů:[7]
J. D. More a N. S. Finney[8] a S. Van Arman[9] ukázali, že pro řadu oxidací za použití IBX jsou, i přes nízkou rozpouštěcí schopnost, vhodná mnohá běžná rozpouštědla; produkt se pak i mnohdy snadněji přečišťuje.

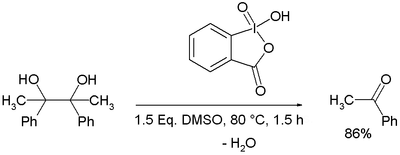
Oxidace alkoholu na aldehyd kyselinou jodoxybenzoovou (IBX), 94% výtěžnost
V roce 2001 K. C. Nicolaou se svými spolupracovníky vydal několik článků popisujících, kromě jiných přeměn, použití IBX k oxidaci primárních benzylových uhlíků na aromatické aldehydy a sekundárních na ketony.[10]
Oxidační štěpení[editovat | editovat zdroj]
IBX oxiduje vicinální dioly na diketony aniž by docházelo ke štěpením vazeb uhlík–uhlík,[11] oxidační štěpení glykolů na dva aldehydy lze ovšem provést při změněných podmínkách (vyšších teplotách nebo použití kyseliny trifluoroctové jako rozpouštědla).[12]
Mechanismus tohoto glykolového štěpení začíná tvorbou aduktu 10-I-4 IBX a DMSO za vzniku 12-I-5 meziproduktu, 3, v němž DMSO vytváří odstupující skupinu pro alkohol 4, čímž vznikne meziprodukt 5. Působením jednoho ekvivalentu vody se utvoří 12-I-5 spirobicyklický perjodinan 6, který se fragmentuje na 7. Za přítomnosti hydroxylových alfa protonů se objevuje vedlejší reakce v podobě oxidace na acyloin.
α-hydroxylace[editovat | editovat zdroj]
S. F. Kirsch se spolupracovníky provedl hydroxylace ketonů kyselinou jodoxybenzoovou do poloh α za mírných podmínek.[13]
Tento postup lze použít i na β-ketoestery.[14]
Oxidace β-hydroxyketonů na β-diketony[editovat | editovat zdroj]
S. L. Bartlett a C. M. Beaudry zjistili, že IBX je užitečná pro převody β-hydroxyketonů na β-diketony. IBX poskytuje lepší výtěžnosti než Swernův i Dessův–Martinův postup.[15]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku 2-Iodoxybenzoic acid na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/339496
- ↑ BOECKMAN, R. K.; SHAO, P.; MULLINS, J. J. Dess–Martin periodinane: 1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one. Org. Synth.. 2000, s. 141. Dostupné online.; Coll. Vol.. S. 696.
- ↑ a b M. Frigerio; M. Santagostino; S. Sputore. A User-Friendly Entry to 2-Iodoxybenzoic Acid (IBX). Journal of Organic Chemistry. 1999, s. 4537–4538. DOI 10.1021/jo9824596.
- ↑ D. B. Dess; J. C. Martin. A Useful 12-I-5 Triacetoxyperiodinane (the Dess–Martin Periodinane) for the Selective Oxidation of Primary or Secondary Alcohols and a Variety of Related 12-I-5 Species. Journal of the American Chemical Society. 1991, s. 7277–7287. DOI 10.1021/ja00019a027.
- ↑ J. T. Su; W. A. Goddard. Enhancing 2-Iodoxybenzoic Acid Reactivity by Exploiting a Hypervalent Twist. Journal of the American Chemical Society. 2005, s. 1414–14147. Dostupné online. DOI 10.1021/ja054446x. PMID 16218584.
- ↑ M. J. Gallen; R. Goumont; T. Clark; F. Terrier; C. M. Williams. o-Iodoxybenzoic Acid (IBX): pKa and Proton-Affinity Analysis. Angewandte Chemie International Edition. 2006, s. 2929–2934. DOI 10.1002/anie.200504156. PMID 16566050.
- ↑ D. K. Mohapatra; G. S. Yellol. Asymmetric Total Synthesis of Eicosanoid. Arkivoc. 2005, s. 144–155. DOI 10.3998/ark.5550190.0006.316.
- ↑ J. D. More; N. S. Finney. A Simple and Advantageous Protocol for the Oxidation of Alcohols with o-Iodoxybenzoic Acid (IBX). Organic Letters. 2002, s. 3001–3003. DOI 10.1021/ol026427n. PMID 12182609.
- ↑ S. Van Arman. 2-Methyl-2-propanol as solvent for o-iodoxybenzoic acid (IBX) oxidation of 1˚ alcohols to aldehydes. Tetrahedron Letters. 2009, s. 4693–4695. DOI 10.1016/j.tetlet.2009.06.045.
- ↑ K. C. Nicolaou; T. Montagnon; P. S. Baran; Y.-L. Zhong. Iodine(V) Reagents in Organic Synthesis. Part 4. o-Iodoxybenzoic Acid as a Chemospecific Tool for Single Electron Transfer-Based Oxidation Processes. Journal of the American Chemical Society. 2002-03-01, s. 2245–2258. ISSN 0002-7863. DOI 10.1021/ja012127+. PMID 11878978.
- ↑ M. Frigerio; M. Santagostino. A Mild Oxidizing Reagent for Alcohols and 1,2-Diols: o-Iodoxybenzoic Acid (IBX) in DMSO. Tetrahedron Letters. 1994, s. 8019–8022. DOI 10.1016/0040-4039(94)80038-3.
- ↑ J. N. Moorthy; N. Singhal; K. Senapati. Oxidative Cleavage of Vicinal Diols: IBX can do what Dess–Martin Periodinane (DMP) can. Organic & Biomolecular Chemistry. 2007, s. 767–771. DOI 10.1039/b618135j. PMID 17315062.
- ↑ S. F. Kirsch. IBX-Mediated α-Hydroxylation of α-Alkynyl Carbonyl Systems. A Convenient Method for the Synthesis of Tertiary Alcohols. Journal of Organic Chemistry. 2005, s. 10210-10212. DOI 10.1021/jo051898j. PMID 16292876.
- ↑ S. F. Kirsch; A. Duschek. Novel Oxygenations with IBX. Chemistry: A European Journal. 2009, s. 10713-10717. DOI 10.1002/chem.200901867. PMID 19760735.
- ↑ S. L. Bartlett; C. M. Beaudry. High Yielding Oxidation of β-Hydroxyketones to β-Diketones Using o-Iodoxybenzoic Acid.Chybí název periodika! 2011, s. 9852–9855. DOI 10.1021/jo201810c. PMID 22023037.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Kyselina jodoxybenzoová na Wikimedia Commons
Obrázky, zvuky či videa k tématu Kyselina jodoxybenzoová na Wikimedia Commons