Octan palladnatý
| Octan palladnatý | |
|---|---|
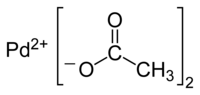 Strukturní vzorec | |
 Model struktury trimerní formy | |
 Model struktury polymerní formy | |
| Obecné | |
| Systematický název | ethanoát palladnatý |
| Triviální název | octan palladnatý |
| Anglický název | Palladium(II) acetate |
| Funkční vzorec | (CH3COO)2Pd |
| Sumární vzorec | C4H6O4Pd |
| Vzhled | hnědožlutá pevná látka (trimer) světle růžový prášek (polymer) |
| Identifikace | |
| Registrační číslo CAS | 3375-31-3 |
| PubChem | 167845 |
| SMILES | [Pd+2].[O-]C(=O)C.[O-]C(=O)C |
| InChI | InChI=1S/2C2H4O2.Pd/c2*1-2(3)4;/h2*1H3,(H,3,4);/q;;+2/p-2 |
| Číslo RTECS | AJ1900000 |
| Vlastnosti | |
| Molární hmotnost | 224,50 g/mol |
| Teplota rozkladu | 205 °C (478 K) |
| Rozpustnost ve vodě | slabě rozpustný |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Octan palladnatý je organická sloučenina, palladnatá sůl kyseliny octové. Je považován za reaktivnější než odpovídající sloučenina platiny. Je rozpustný v mnoha organických rozpouštědlech a často se používá jako katalyzátor organických reakcí a jako prekurzor dalších palladnatých katalyzátorů.
Struktura
[editovat | editovat zdroj]I když má tato sloučenina poměr atomů palladia a octanových ligandů 1:2, jak odpovídá jejich oxidačním číslům, skutečná molekulární struktura závisí na způsobu přípravy.
Tak jak byl připraven Wilkinsonem a pomocníky roku 1965 a v roce 1970 studován Skapským a Smartem pomocí jednokrystalové rentgenové difrakce, jde o hnědožlutou pevnou látku krystalizující v jednoklonných vrstvách. Bylo zjištěno, že jeho struktura je trimerní, složená z rovnostranných trojúhelníků, kde je každý atom Pd navázán na dvě acetátové skupiny. Každý atom kovu zaujímá přibližně čtvercovou rovinnou koordinaci.[2][3]
Octan palladnatý připravený lehce odlišným způsobem byl izolován jako světle růžový prášek, u něhož byla rentgenovou difrakcí zjištěna struktura v podobě dlouhých řetězců atomů palladia, z nichž je každý propojen se sousední dvojicí acetátových můstků, kde je koordinační geometrie kolem každého atomu palladia čistě čtvercově rovinná.[4]
Příprava
[editovat | editovat zdroj]Octan palladnatý může být připraven v trimerní formě průtokem horké koncentrované kyseliny octové a kyseliny dusičné skrz houbovité palladium. Přebytečné množství houbovitého palladia nebo vyšší tok plynného dusíku zabraňuje kontaminaci produkty obsahujícími dusitanový ligand místo jednoho z acetátů (Pd3(OAc)5NO2).[5][6]
- Pd + 4 HNO3 → Pd(NO3)2 + 2 NO2 + 2 H2O
- Pd(NO3)2 + 2 CH3COOH → Pd(O2CCH3)2 + 2 HNO3
Tato nitrovarianta má odlišnou rozpustnost a jinou katalytickou aktivitu u mnoha reakcí. Zabránění nebo omezení její tvorby je důležité prospolehlivé používání octanu palladnatého.[7]
Podobně se připravuje propionát palladnatý; ostatní karboxyláty se získávají reakcí octanu palladnatého s odpovídající karboxylovou kyselinou.[2] Rovněž octan palladnatý je možné připravit reakcí jiného palladnatého karboxylátu s kyselinou octovou. Tato výměna ligandů začínající přečištěným karboxylátem je alternativním způsobem získávání octanu palladnatého bez kontaminatních nitrosloučenin.[7]
Reakce
[editovat | editovat zdroj]Při zahřívání s alkoholy, nebo delším varu v jiných rozpouštědlech, se tato látka rozkládá na kyselinu octovou a kovové palladium.[2]
Použití
[editovat | editovat zdroj]Katalýza
[editovat | editovat zdroj]Octan palladnatý je katalyzátorem mnoha organických reakcí u řady druhů sloučenin, jako jsou alkeny, dieny a alkyl-, aryl- a vinylhalogenidy, při nichž se tvoří reaktivní addukty. Π-allyl koordinace a koordinace alkenů na octan palladnatý zahrnuje donaci typu sigma z π-orbitalu alkenu nebo π-allylu za současného zpětného π-navázání na prázdný π* orbital alkenu či π-allylu. Čím větší je sigma donace na kov, tím větší je zpětné navázání. Čím větší je zpětné navázání, tím větší je snížení řádu vazby.[8] Redukce alkenů nebo π-allylů octanem palladnatým obrací reaktivitu organického ligandu tím, že umožní spíše reakce s nukleofily než s elektrofily.[9]
Příklady reakcí katalyzovaných octanem palladnatým jsou:
- Vinylace, například Heckova reakce
- Přesmyk acyklických dienů, například Copeův přesmyk
- Karbonylační reakce jako je tvorba esterů z aryljodidů adicí oxidu uhelnatého a alkoholu nebo fenolu[10]
- Redukční aminace aldehydů nebo ketonů za použití mravenčanu draselného[11]
- Wackerův proces: oxidace ethenu ve vodě za vzniku acetaldehydu (prekurzoru polyvinylacetátu, běžné složky lepidel)
- Buchwaldova-Hartwigova aminace arylhalogenidů/pseudohalogenidů s alkyl- nebo arylaminy[12]
Tato látka převádí arylbromidy na aryltrimethylsilany, důležité funkční skupiny v řadě organických sloučenin jako je fungicid „Latitude“:
- RC6H4Br + Si2(CH3)6 → RC6H4Si(CH3)3 + Si(CH3)3Br
Octan palladnatý je kompatibilní s elektronovými vlastnostmi arylbromidů a tato metoda na rozdíl od mnoha jiných způsobů syntézy nevyžaduje vybavení pro vysoké tlaky.[13]
Prekurzor ostatních sloučenin palladia
[editovat | editovat zdroj]Octan palladnatý se používá k tvorbě dalších palladnatých sloučenin; například fenylpalladiumacetát, používaný k izomerizaci allylalkoholů, se získává následující reakcí:
- Hg(C6H5)(CH3COO) + Pd(CH3COO)2 → Pd(C6H5)(O2CCH3) + Hg(O2CCH3)2
Octan palladnatý také reaguje s acetylacetonem (ligand „acac“) za vzniku acetylacetonátu palladnatého (Pd(acac)2), monomerní molekuly, která je prekurzorem kovového palladia.
Světlem či teplem se octan palladnatý redukuje za vzniku tenkých vrstev palladia a může vytvářet nanovlákna a koloidy.[5]
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu octan palladnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu octan palladnatý na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Palladium(II) acetate na anglické Wikipedii.
- ↑ a b Palladium(II) acetate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b c T. A. Stephenson; S. M. Morehouse; A. R. Powell; J. P. Heffer and G. Wilkinson. 667. Carboxylates of palladium, platinum, and rhodium, and their adducts. Journal of the Chemical Society (Resumed). 1965, s. 3632. DOI 10.1039/jr9650003632.
- ↑ Skapski, A C.; M. L. SMART. The Crystal Structure of Trimeric Palladium(II) Acetate. J. Chem. Soc. D. 1970, s. 658b–659. DOI 10.1039/C2970000658b.
- ↑ Kirik, S.D.; MULAGALEEV, S.F.; BLOKHIN, A.I. [Pd(CH 3 COO) 2 ] n from X-ray powder diffraction data. Acta Crystallogr. C. 2004, s. m449-m450. DOI 10.1107/S0108270104016129.
- ↑ a b Bakhmutov, V. I.,; BERRY, J. F.; COTTON, F. A.; IBRAGIMOV, S.; MURILLO, C. A. Non-Trivial Behavior of Palladium(II) Acetate. Dalton Transactions. 2005, s. 1989–1992. DOI 10.1039/b502122g. PMID 15909048.
- ↑ High Purity Homogeneous Catalyst [online]. Engelhard, September 2005 [cit. 2006-02-24]. Dostupné v archivu pořízeném dne 17 March 2006.
- ↑ a b RITTER, Stephen K. Chemists introduce a user's guide for palladium acetate. Chemical & Engineering News. May 2, 2016, s. 20-21.
- ↑ Toreki, R. "Allyl Ligands." The Organometallic HyperTextBook. 20 Nov. 2003. Chemglass. 01 Apr. 2006<http://www.ilpi.com/organomet/allyl.html>.
- ↑ Suggs, J W. "Palladium: Organometallic Chemistry." Encyclopedia of Inorganic Chemistry. Ed. R B. King. 8 vols. Chichester: Wiley, 1994.
- ↑ NIKITIN, Kirill V.; ANDRYUKHOVA, N.P.; BUMAGIN, N.A.; BELETSKAYA, I.P. Synthesis of Aryl Esters by Pd-catalysed Carbonylation of Aryl Iodides. Mendeleev Communications. 1991, s. 129–131. DOI 10.1070/MC1991v001n04ABEH000080.
- ↑ Basu, B., Satadru J., Mosharef H. B., and Pralay D. A Simple Protocol for the Direct Reductive Amination of Aldehydes and Ketones Using Potassium Formate and Catalytic Palladium Acetate. ChemInform. 2003, s. 555–557. DOI 10.1002/chin.200330069.
- ↑ Buchwald-Hartwig Cross Coupling Reaction [online]. Organic Chemistry Portal. Dostupné online.
- ↑ Gooben, L J. "Research Area "New Pd-Catalyzed Cross-Coupling Reactions"" 28 Feb. 2006<http://www.mpi-muelheim.mpg.de/kofo/bericht2002/pdf/2.1.8_gossen.pdf Archivováno 12. 7. 2007 na Wayback Machine.>



