N-Methylimidazol
| N-methylimidazol | |
|---|---|
 Strukturní vzorec | |
 Tyčinkový model molekuly | |
 Kalotový model molekuly | |
| Obecné | |
| Systematický název | 1-Methyl-1H-imidazol |
| Ostatní názvy | NMI |
| Sumární vzorec | C4H6N2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 616-47-7 |
| EC-no (EINECS/ELINCS/NLP) | 210-484-7 |
| PubChem | 1390 |
| SMILES | c1cc(cc(c1)N)N |
| InChI | 1/C6H8N2/c7-5-2-1-3-6(8)4-5/h1-4H,7-8H2 |
| Vlastnosti | |
| Molární hmotnost | 82,104 g/mol |
| Teplota tání | −6,0 °C (267,2 K)[1] |
| Teplota varu | 195,5 °C (468,6 K)[1] |
| Hustota | 1,03 g/cm3 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H302 H312 H314[1] |
| P-věty | P260 P264 P270 P280 P301+312 P301+330+331 P302+352 P303+361+353 P304+340 P305+351+338 P310 P312 P321 P322 P330 P363 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
1-Methylimidazol, také nazývaný N-methylimidazol, je aromatická heterocyklická sloučenina se vzorcem CH3C3H3N2. Jedná se o bezbarvou kapalinu používanou jako rozpouštědlo, zásada a jako prekurzor některých iontových kapalin. N-methylimidazolové skupiny jsou součástmi řady nukleosidů i histidinu a histaminu.
Zásaditost[editovat | editovat zdroj]
Vzhledem k methylové skupině navázané na dusík tento derivát imidazolu nemůže tvořit tautomery. Je poněkud silnější zásadou než imidazol, pKa konjugovaných kyselin činí 7,0 a 7,4.[2] Methylace také výrazně snižuje teplotu tání, díky čemuž lze 1-methylimidazol použít jako rozpouštědlo.
Výroba[editovat | editovat zdroj]
1-Methylimidazol se vyrábí dvěma postupy. Prvním z nich je kysele katalyzovaná methylace imidazolu methanolem. Druhý způsob spočívá v Radziszewského reakci glyoxalu, formaldehydu a směsi amoniaku s methylaminem.[3][4]
- (CHO)2 + CH2O + CH3NH2 + NH3 → H2C2N(NCH3)CH + 3 H2O
V laboratoři jej lze připravit methylací imidazolu následovanou deprotonací;[5] lze také nejprve provést deprotonaci imidazolu za vzniku sodné soli a až poté methylaci.[6][7]
- H2C2N(NH)CH + CH3I → [H2C2(NH)(NCH3)CH]I
- [H2C2(NH)(NCH3)CH]I + NaOH → H2C2N(NCH3)CH + H2O + NaI
Použití[editovat | editovat zdroj]
V laboratořích se 1-methylimidazol a jeho deriváty používají jako napodobeniny biomolekul obsahujících imidazolové skupiny.
1-Methylimidazol je též prekurzorem při syntéze methylimidazolových monomerů používaných na výrobu pyrrol-imidazolových polyamidů. Tyto polymery se mohou selektivně vázat na určité sekvence DNA způsobem závislým na konkrétní sekvenci.[8]
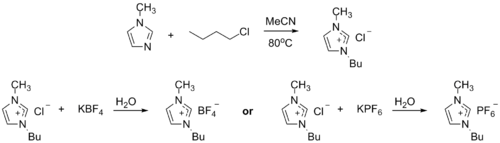
Prekurzor iontových kapalin[editovat | editovat zdroj]
1-Methylimidazol může být alkylován na dialkylimidazoliové soli. V závislosti na použitém alkylačním činidlu a protianiontu se mohou tvořit různé iontové kapaliny, například 1-butyl-3-methylimidazoliumhexafluorofosfát ("BMIMPF6"):[9][10]
1-methylimidazole lze použít k odstranění kyselin při výrobě diethoxyfenylfosfinu. V tomto procesu reaguje 1-methylimidazol s HCl za vzniku 1-methylimidazoliumhydrochloridu, který se za podmínek reakce samovolně odděluje jako samostatná kapalná fáze.[9][11]
- 2 MeC3N2H3 + C6H5PCl2 + 2 C2H5OH → 2 [MeC3N2H4]Cl + C6H5P(OC2H5)2
Donorové vlastnosti[editovat | editovat zdroj]
1-methylimidazolový (NMIz) ligand vytváří oktaedrické ionty M(NMIz)62+ (M = Fe, Co, Ni a čtvercový ion Cu(NMIz)42+).[12]
1-methylimidazol reaguje za vzniku aduktů s Lewisovými kyselinami, jako jsou molybdenperfluorobutyrát a [Rh(CO)2Cl]2. Vlastnosti 1-methylimidazolu jako donoru byly analyzovány pomocí ECW modelu, přičemž EB= 1,16 a CB= 4,92.
Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu N-Methylimidazol na Wikimedia Commons
Obrázky, zvuky či videa k tématu N-Methylimidazol na Wikimedia Commons
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku 1-Methylimidazole na anglické Wikipedii.
- ↑ a b c d e f 1-Methylimidazole. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Albert, A., Heterocyclic Chemistry, 2nd ed.; 1968 Athlone Press, ISBN 0-485-11092-X
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. Příprava vydání Wiley-VCH. 1. vyd. [s.l.]: Wiley Dostupné online. ISBN 978-3-527-30385-4, ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a13_661. (anglicky) DOI: 10.1002/14356007.
- ↑ Bronislaw Radziszewski. Ueber die Constitution des Lophins und verwandter Verbindungen. Berichte der deutschen chemischen Gesellschaft. 1882, s. 1493–1496. Dostupné online. DOI 10.1002/cber.18820150207.
- ↑ Gilchrist, T. L., Heterocyclic Chemistry, 2nd ed.; 1992 Longman Scientific & Technical, ISBN 0-582-06420-1
- ↑ Grimmett, M. R., Imidazole and Benzimidazole Synthesis; 1997 Academic Press, ISBN 0-12-303190-7
- ↑ Gupta, R. R., Kumar, M., Gupta, V., Heterocyclic Chemistry II: Five Membered Heterocycles; 1999 Springer, ISBN 3-540-65252-3
- ↑ Eldon E. Baird; Peter B. Dervan. Solid Phase Synthesis of Polyamides Containing Imidazole and Pyrrole Amino Acids. Journal of the American Chemical Society. 1996, s. 6141–6146. Dostupné online. DOI 10.1021/ja960720z.
- ↑ a b G. Wytze Meindersma; Matthias Maase; André B. De Haan. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2007. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.l14_l01. Kapitola Ionic Liquids.
- ↑ DUPONT, J.; CONSORTI, C.; SUAREZ, P.; DE SOUZA, R. Preparation of 1-Butyl-3-methyl imidazolium-based Room Temperature Ionic Liquids. Org. Synth.. 2004. Dostupné online.; Coll. Vol.. S. 184.
- ↑ Tom Welton. Solvents and sustainable chemistry. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 2015-11-11, s. 20150502. DOI 10.1098/rspa.2015.0502. PMID 26730217.
- ↑ R. Reedijk. Pyrazoles and imidazoles as ligands. II. Coordination compounds of N-methyl imidazole with metal perchlorates and tetrafluoroborates. Inorganica Chimica Acta. 1969, s. 517–522. DOI 10.1016/S0020-1693(00)92544-1.