Hantzschova syntéza pyridinů
Hantzschova syntéza pyridinů je vícesložková reakce aldehydu (například formaldehydu), 2 ekvivalentů esteru β-ketokyseliny (jako je ethylacetacetát a donoru dusíku (například octanu amonného nebo amoniaku).[1][2]
Při reakci se nejprve vytvoří dihydropyridin, který je poté možné oxidovat na pyridin;[3] řídící silou druhého kroku je aromatizace.
Dikarboxylát 1,4-dihydropyridinu bývá také označován jako Hantzschův ester; jeho deriváty jsou významnou skupinou blokátorů vápníkového kanálu[2] a využívají se v léčivech, jako jsou nifedipin, amlodipin a nimodipin.
Hantzschova syntéza může probíhat ve vodě za přímé aromatizace chloridem železitým, oxidem manganičitým nebo manganistanem draselným.[4]

Hantzschova syntéza může být usnadněna působením mikrovlnného záření.[5]
Mechanismus
[editovat | editovat zdroj]Bylo navrženo pět mechanismů Hantzchovy syntézy 1,4-dihydropyridinu a proběhly studie reakcí předem vytvořených meziproduktů za účelem určení nejpravděpodobnějších mechanismů a úpravy konkrétních syntéz.[6]
Studie mechanismu pomocí 13C a 15N nukleární magnetické rezonance naznačují tvorbu chalkonu 6 a enaminu 3 a následující průběh:[7]
Pozdější výzkum, využívající hmotnostní spektrometrii, podpořil reakční dráhu A a ukázal, že reakce může probíhat dalšími dvěma způsoby, které oba vedou ke sloučenině 7.[6] Kterým z těchto způsobu reakce proběhne, pravděpodobně ovlivňují reaktanty; pokud je methylová skupina u 1 nahrazena skupinou odtahující elektrony, tak reakce probíhá přes diketon.[8]
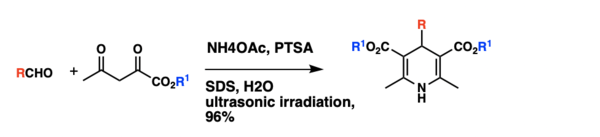
Optimalizace reakčních podmínek
[editovat | editovat zdroj]Původní provedení Hantzschovy syntézy 1,4-dihydropyridinů, spočívající v jednonádobové kondenzaci aldehydů s ethylacetacetátem a amoniakem, má několik nevýhod, jako jsou tvrdé reakční podmínky, dlouhé reakční doby a nízké výtěžnosti. Syntézu lze provést ve vodných roztocích obsahujících micely, za katalýzy kyselinou p-toluensulfonovou a působení ultrazvuku. Kondenzace benzaldehydu, ethylacetacetátu a octanu amonného vedla za těchto podmínek a přítomnosti dodecylsíranu sodného (0,1 mol/l) k 96% výtěžnosti. Zkoumány byly i možnosti provedení reakce v několika dalších rozpouštědlech, přičemž působení ultrazvuku ve vodných micelách dávalo vyšší výtěžnosti než v jiných prostředích, například methanolu, ethanolu, nebo tetrahydrofuranu. Za optimalizovaných podmínek byla syntetizována řada různých 1,4-dihydropyridinů, přičemž výtěžnosti přesahovaly 90 %.[9]
Aromatizace
[editovat | editovat zdroj]Pyridiny lze nejsnadněji získat oxidacemi 1,4-dihydropyridinů.[10] Jako oxidační činidla se nejčastěji používají oxid chromový, manganistan draselný a kyselina dusičná.[11] Aromatizace jsou ale často doprovázeny nízkými výtěžky, potřebou silně oxidujícího prostředí, tvorbou vedlejších produktů, nebo potřebou nadbytku oxidantu.[11][12] Byly tak vyvíjeny metody aromatizace proveditelné za mírnějších podmínek, které by poskytovaly vyšší výtěžky; patří sem mimo jiné použití jodu v refluxovaném methanolu,[11] oxidu chromičitého,[12] chloritanu sodného,[13] nebo, za nepřítomnosti kovů, fotochemické reakce využívající jak ultrafialové, tak i viditelné záření.[14]
Léčiva na vysoký krevní tlak založená na 1,4-dihydropyridinech jsou v játrech metabolizována oxidací cytochromem P450 na odpovídající pyridiny.[11] Výzkumu aromatizací 1,4-dihydropyridinů je věnována pozornost, protože se tím dosahuje lepšího porozumění biologickým systémům a také se nacházejí další způsoby přípravy pyridinů.[13]
Knoevenagelova–Friesova varianta
[editovat | editovat zdroj]Knoevenagelova–Friesova varianta umožňuje přípravu nesymetrických pyridinů.[15]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Hantzsch pyridine synthesis na anglické Wikipedii.
- ↑ A. Hantzsch. Condensationprodukte aus Aldehydammoniak und Ketonartigen Verbindungen. Chemische Berichte. 1881, s. 1637–1638. Dostupné online. DOI 10.1002/cber.18810140214.
- ↑ a b Jie Jack Li. Name Reactions. [s.l.]: [s.n.], 2006-07-19. ISBN 3-540-30030-9.
- ↑ Jie Jack Li. Name reactions in heterocyclic chemistry. [s.l.]: [s.n.], 2004-10-11. Dostupné online. ISBN 0-471-30215-5. S. 304.
- ↑ J. J. Xia; G. W. Wang. One-Pot Synthesis and Aromatization of 1,4-Dihydropyridines in Refluxing Water. Synthesis. 2005, s. 2379–2383. DOI 10.1055/s-2005-870022.
- ↑ J. J. van den Eynde; A. Mayence. Synthesis and Aromatization of Hantzsch 1,4-Dihydropyridines under Microwave Irradiation. An Overview. Molecules. 2003, s. 381–391. Dostupné online. DOI 10.3390/80400381.
- ↑ a b Vanessa G. Santos. The Multicomponent Hantzsch Reaction: Comprehensive Mass Spectrometry Monitoring Using Charge-Tagged Reagants. Chemistry – A European Journal. 2014, s. 12808–12816. DOI 10.1002/chem.201303065. PMID 25179028.
- ↑ Alan R. Katrinsky; Daryl L. Ostercamp; Taher I. Yousaf. The mechanism of the hantzsch pyridine synthesis: A study by 15N and 13C NMR spectroscopy. Tetrahedron. 1986, s. 5729–5738. Dostupné online. DOI 10.1016/S0040-4020(01)88178-3.
- ↑ Anil Saini. Hantzsch reaction: Recent advances in Hantzsch 1,4-dihydropyridines. Journal of Scientific and Industrial Research. 2008, s. 95–111. Dostupné online.
- ↑ Atul Kumar. ChemInform Abstract: Efficient Synthesis of Hantzsch Esters and Polyhydroquinoline Derivatives in Aqueous Micelles.Chybí název periodika! 2008-08-05. DOI 10.1002/chin.200832145.
- ↑ Sabir H. Mashraqui. Bismuth Nitrate Pentahydrate: A Convenient Reagent for the Oxidation of Hantzsch 1,4-Dihydropyridines. Synthesis. 1998, s. 713–714. DOI 10.1055/s-1998-4516.
- ↑ a b c d Jhillu S. Yadav. Aromatization of Hantzsch 1,4-Dihydropyridines with I2-MeOH. Synthesis. 2000, s. 1532–1534. DOI 10.1055/s-2000-7613.
- ↑ a b Kwang-Youn Ko. Aromatization of Hantzsch 1,4-Dihydropyridines with Magtrieve. Tetrahedron Letters. 1999, s. 3207–3208. DOI 10.1016/S0040-4039(99)00467-0.
- ↑ a b Xiali Liao. Oxidative aromatization of Hantzsch 1,4-dihydropyridines by sodium chlorite. Tetrahedron Letters. 2010, s. 3859–3861. DOI 10.1016/j.tetlet.2010.05.091.
- ↑ Xiaojing Wei. Metal-Free-Mediated Oxidation Aromatization of 1,4-Dihydropyridines to Pyridines Using Visible Light and Air. Chinese Journal of Chemistry. 2014, s. 1245–1250. DOI 10.1002/cjoc.201400521.
- ↑ E. Knoevenagel; A. Fries. Synthesen in der Pyridinreihe. Ueber eine Erweiterung der Hantzsch'schen Dihydropyridinsynthese. Berichte der Deutschen Chemischen Gesellschaft. 1898, s. 761–767. Dostupné online. DOI 10.1002/cber.189803101157.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Hantzschova syntéza pyridinů na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hantzschova syntéza pyridinů na Wikimedia Commons