Aromatizace
Aromatizace jsou chemické reakce, při kterých vznikají aromatické systémy u původně nearomatických výchozích látek. Nejčastěji jde o dehydrogenace cyklických sloučenin, jako je přeměna cyklohexanu na benzen. K aromatizacím patří také některé reakce vytvářející heterocykly.[1]

Přeměna methylcyklohexanu na toluen katalyzovaná platinou, reakce využívaná při výrobě benzinu z ropy
V průmyslu[editovat | editovat zdroj]
Aromatizační reakce mají velký význam při zpracovávání ropy; jednou z nejvýznamnějších je dehydrogenace cykloalkanů. Tento proces, katalyzovaný platinou, například převádí methylcyklohexan na toluen.[2] Při dehydrocyklizacích vznikají aromatické sloučeniny z acyklických;[3] obdobným dějem je například dehydroizomerizace methylcyklopentanu na benzen:
Biochemické procesy[editovat | editovat zdroj]
Aromatázy jsou enzymy schopné aromatizovat cyklické řetězce ve steroidech. Takto jsou například převáděny testosteron na estradiol a androstendion na estron.[4] Při těchto aromatizacích dochází k oxidacím methylových skupin na C-19 za odštěpení kyseliny mravenčí a získání aromaticity. Takovéto přeměny hrají roli v karcinogenezi nádorů prsu a vaječníků a v gynekomastii u mužů.[5] Inhibitory aromatáz, jako jsou exemestan (vytvářející s aromatázami trvale deaktivující vazby)[6] a anastrozol a letrozol (které enzymy inhibují kompetitivně)[7] se ukázaly jako účinnější než léčiva potlačující tvorbu estrogenů, například tamoxifen, pravděpodobně tomu tak je proto, že brání tvorbě estradiolu.[5]
Mechanismy[editovat | editovat zdroj]
Oxidační dehydrogenace[editovat | editovat zdroj]
U cyklohexanu, cyklohexenu, cyklohexa-1,3- a cyklohexa-1,4-dienu je nejjednodušším způsobem aromatizace dehydrogenace; s rostoucí mírou nenasycení se snižuje aktivační bariéra a nejnáchylnější k aromatizacím jsou tak cyklohexadieny. Dehydrogenace patří mezi redoxní reakce. Dehydrogenační aromatizace jsou opačnými reakcemi k hydrogenacím arenů. Nejvíce se využívají dehydrogenace cyklohexanů a podobných sloučenin, katalyzované platinou.[1]
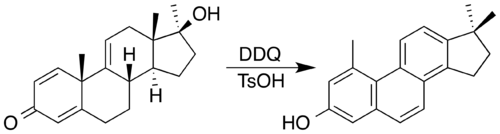
Častým oxidačním činidlem je zde 2,3-dichlor-5,6-dikyano-1,4-benzochinon; tuto látku lze ve spojení s kyselinami jako katalyzátory použít na přípravu steroidů obsahujících fenanthrenová jádra oxidací a dvojnásobným methylovým přesmykem.[8] Oxidant se zde redukuje na derivát hydrochinonu:
Při aromatizacích se často používá síra (pak je odstupující skupinou sulfan) nebo selen (poté je odstupující skupinou selan).[9]
Aromatizace mohou spouštět rozpustné komplexy přechodných kovů. α-Felandren (2-methyl-5-isopropylcyklohexa-1,3-dien) se za přítomnosti chloridu ruthenitého oxiduje na p-cymen.[10]
Oxidační dehydrogenace dihydropyridinu vytváří pyridin a také patří mezi aromatizační reakce.[11]
Dehydratace[editovat | editovat zdroj]

Nearomatické kruhy lze aromatizovat několika způsoby. Semmlerova–Wolffova reakce spočívá v dehydrataci oximu cyklohexen-2-onu na anilin v kyselém prostředí.[12]
Tautomerizace[editovat | editovat zdroj]

Izomerizacemi cyklohexadienonů vznikají aromatické tautomery fenoly.[13][14]
Naftalen-1,4-diol se při 200 °C z jedné třetiny přeměňuje na svou ketoformu, 1,4-dioxotetralin.[15]
Odštěpování hydridových iontů a protonů[editovat | editovat zdroj]
Při aromatizacích se obvykle mění poměr počtu atomů uhlíku a vodíku (C:H). U cyklopentadienu odštěpením protonu vznikne aromatická konjugovaná kyselina, cyklopentadienylový anion, který se dá izolovat v podobě cyklopentadienidu sodného:[16]
- 2 Na + 2 C5H6 → 2 NaC5H5 + H2
Aromatizování může být uskutečněno i odštěpením hydridových iontů. Tropyliový kation, C7H +
7 , vzniká aromatizací cykloheptatrienu za přítomnosti akceptoru hydridových iontů:
- {C7H8 + Br2 → C7H +
7 + Br− + HBr

Aromatizace acyklických sloučenin[editovat | editovat zdroj]
Aromatizace acyklických sloučenin jsou v laboratořích méně obvyklé, ale jedná se o významnou součást u zpracování ropy.
Alkyny bývají poměrně snadno aromatizovatelné, protože již jsou částečně dehydrogenované. V Bergmanově cyklizaci se mění endiyny na dehydrobenzenové diradikály, ze kterých se odděluje vodík a dochází k aromatizování.[17]
Endiynová skupina může být součástí již existujícího kruhu, v takovém případě lze získat bicyklický produkt za mírných podmínek, čemuž pomáhá kruhové napětí u reaktantu; například cyklodeka-3-en-1,5-diyn vytváří při 37 °C reakcí s cyklohexa-1,3-dienem benzen a tetralin, přičemž se vytváří dva nové aromatické kruhy:
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Aromatization na anglické Wikipedii.
- ↑ a b SMITH, Michael, October 17-. March's advanced organic chemistry : reactions, mechanisms, and structure.. 6th ed.. vyd. Hoboken, N.J.: Wiley-Interscience xx, 2357 pages s. Dostupné online. ISBN 0-471-72091-7, ISBN 978-0-471-72091-1. OCLC 69020965
- ↑ J. H. Gary; G. E. Handwerk. Petroleum Refining Technology and Economics. [s.l.]: Marcel Dekker, 1984. Dostupné online. ISBN 0-8247-7150-8.
- ↑ Y. Ono. Transformation of Lower Alkanes into Aromatic Hydrocarbons over ZSM-5 Zeolites. Catalysis Reviews - Science and Engineering. 1992, s. 179–226. DOI 10.1080/01614949208020306.
- ↑ E. D. Lephart. A Review of Brain Aromatase Cytochrome P450. Brain Research Reviews. 1996, s. 1–26. DOI 10.1016/0165-0173(96)00002-1. PMID 8871783.
- ↑ a b C. Avendaño; J. C. Menéndez. Medicinal Chemistry of Anticancer Drugs. [s.l.]: Elsevier, 2008. ISBN 9780080559629. DOI 10.1016/B978-0-444-52824-7.00003-2. Kapitola Aromatase Inhibitors, s. 65–73.
- ↑ W. Jasek. Austria-Codex. [s.l.]: Österreichischer Apothekerverlag, 2007. ISBN 9783852001814. S. 656–660.
- ↑ V. Dinnendahl; U. Fricke. Arzneistoff-Profile. Eschborn: Govi Pharmazeutischer Verlag, 2007. ISBN 9783774198463.
- ↑ W. Brown; A. B. Turner. Applications of High-Potential Quinones. Part VII. The Synthesis of Steroidal Phenanthrenes by Double Methyl Migration. Journal of the Chemical Society C: Organic. 1971, s. 2566–2572. DOI 10.1039/J39710002566. PMID 5167256.
- ↑ F. Bergmann; J. Szmuszkowicz; G. Fawaz. The Condensation of 1,1-Diarylethylenes with Maleic Anhydride. Journal of the American Chemical Society. 1947, s. 1773–1777. DOI 10.1021/ja01199a055. PMID 20251415.
- ↑ M. A. Bennett; T. N. Huang; T. W. Matheson; A. K. Smith. (η6-Hexamethylbenzene)ruthenium Complexes. Inorganic Syntheses. 1982, s. 74–78. ISBN 9780470132524. DOI 10.1002/9780470132524.ch16.
- ↑ S. Shimizu; N. Watanabe; T. Kataoka; T. Shoji; N. Abe; S. Morishita; H. Ichimura. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: Wiley-VCH, 2005. ISBN 3527306730. DOI 10.1002/14356007.a22_399. Kapitola Pyridine and Pyridine Derivatives.
- ↑ E. C. Horning; V. L. Stromberg; H. A. Lloyd. Beckmann Rearrangements. An Investigation of Special Cases. Journal of the American Chemical Society. 1952, s. 5153–5155. DOI 10.1021/ja01140a048.
- ↑ J. Clayden; N. Greeves; S. Warren; P. Wothers. Organic Chemistry. [s.l.]: Oxford University Press, 2001. Dostupné online. ISBN 9780198503460. S. 531.
- ↑ M. Capponi; I. G. Gut; B. Hellrung; G. Persy; J. Wirz. Ketonization Equilibria of Phenol in Aqueous Solution. Canadian Journal of Chemistry. 1999, s. 605–613. DOI 10.1139/cjc-77-5-6-605.
- ↑ E. P. Kündig; A. E. Garcia; T. Lomberget; G. Bernardinelli. Rediscovery, Isolation, and Asymmetric Reduction of 1,2,3,4-Tetrahydronaphthalene-1,4-dione and Studies of its [Cr(CO)3] Complex. Angewandte Chemie International Edition. 2005, s. 98–101. DOI 10.1002/anie.200502588. PMID 16304647.
- ↑ F. A. Cotton; G. Wilkinson. Advanced Inorganic Chemistry. [s.l.]: John Wiley and Sons, 1999. Dostupné online. ISBN 9780471199571.
- ↑ R. K. Mohamed; P. W. Peterson; I. V. Alabugin. Concerted Reactions that Produce Diradicals and Zwitterions: Electronic, Steric, Conformational and Kinetic Control of Cycloaromatization Processes.Chybí název periodika! Chemical Reviews, 2013. DOI 10.1021/cr4000682. PMID 23600723.