Dehydratační reakce
Dehydratační reakce, zkráceně dehydratace, je chemická reakce, při které se z reagující molekuly nebo iontu odštěpí molekula vody, jde o opak hydratační reakce, kdy se naopak připojuje molekula vody. K provádění takových reakcí se nejběžněji používají kyselina sírová a oxid hlinitý, často se reagující látka zahřívá.
Příklady
[editovat | editovat zdroj]Příkladem dehydratační reakce je Fischerova–Speierova esterifikace, při které reaguje karboxylová kyselina s alkoholem za přítomnosti dehydratačního činidla:
- RCO2H + R′OH ⇌ RCO2R′ + H2O
Dva monosacharidy, například glukóza a fruktóza, se mohou spojit do jedné molekuly, disacharidu (zde se jedná o sacharózu), za odštěpení molekuly vody.
Podobná je kondenzační reakce, kdy se voda odštěpuje z dvou různých reaktantů.
Opačnou reakcí je hydrolýza, kdy molekula vody u disacharidu vytvoří dvě hydroxylové skupiny a vzniknou zpět monosacharidy.
V organické syntéze se využívá řada dehydratačních reakcí, například při dehydrataci alkoholů a sacharidů.
| Reakce | Obecná rovnice | Příklady |
|---|---|---|
| Přeměna dvou alkoholů na ether (substituce) | 2 R–OH → R–O–R + H2O | |
| Přeměna kyseliny a alkoholu na ester (Fischerova–Speierova esterifikace) | R−COOH + R'−OH → R−COO−R' + H2O | |
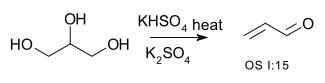
| Přeměna alkoholu na alken (eliminace) | R–CH2−CHOH–R → R–CH=CH–R + H2O | například glycerol na akrolein:[1]
nebo dehydratace 2-methyl-cyklohexan-1-olu na (převážně) 1-methylcyklohexen[2] za použití Martinova sulfuranu[3]:
|
| Přeměna dvou karboxylových kyselin na anhydrid | 2 RCOOH → (RCO)2O + H2O | |
| Přeměna amidu na nitril | RCONH2 → R–CN + H2O | |
| Dienolový–benzenový přesmyk | 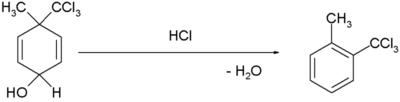 [5][6] [5][6]
|
Dalšími synteticky využívanými dehydratačními reakcemi jsou tvorba triglyceridů z mastných kyselin a glycerolu a vznik glykosidové vazby při vzniku disacharidů z monosacharidů, například maltózy z dvou molekul glukózy.
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Dehydratační reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dehydratační reakce na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Dehydration reaction na anglické Wikipedii.
- ↑ H. ADKINS; W. H. HARTUNG. Acrolein. Org. Synth.. 1926, s. 1. Dostupné online. DOI 10.15227/orgsyn.006.0001.; Coll. Vol.. S. 15.
- ↑ J. Brent Friesen; Philip Cruickshank. Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment. Journal of Chemical Education. 2011, s. 1141–1147. Bibcode 2011JChEd..88.1141F.
- ↑ Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2001. Kapitola Diphenylbis(1,1,1,3,3,3-hexafluoro-2-phenyl-2-propoxy)sulfurane.
- ↑ Heinz Zimmermann; Roland Walz. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2008. ISBN 978-3527306732. Kapitola Ethylene.
- ↑ H. Plieninger; Gunda Keilich. Die Dienol-Benzol-Umlagerung. Angewandte Chemie. 1956, s. 618.
- ↑ Margaret Jevnik Gentles; Jane B. Moss; Hershel L. Herzog; E. B. Hershberg. The Dienol-Benzene Rearrangement. Some Chemistry of 1,4-Androstadiene-3,17-dione. Journal of the American Chemical Society. 1958, s. 3702–3705.