Cyklopropanon
| Cyklopropanon | |
|---|---|
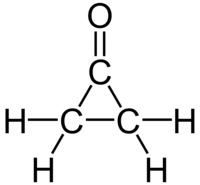 Strukturní vzorec | |
| Obecné | |
| Systematický název | cyklopropanon |
| Sumární vzorec | C3H4O |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 5009-27-8 |
| PubChem | 138404 |
| SMILES | C1CC1=O |
| InChI | InChI=1S/C3H4O/c4-3-1-2-3/h1-2H2 |
| Vlastnosti | |
| Molární hmotnost | 56,063 g/mol |
| Teplota tání | −90 °C (183 K) |
| Hustota | 0,867 g/cm3 |
Některá data mohou pocházet z datové položky. | |
Cyklopropanon je organická sloučenina se vzorcem (CH2)2CO, keton odvozený od cyklopropanu. Jedná se o nestálou látku, citlivou i na slabé nukleofily
Příprava
[editovat | editovat zdroj]Cyklopropanon je možné získat reakcí ethenonu s diazomethanem[1][2] v nereaktivním rozpouštědle, jako je dichlormethan.[3]
Takto vytvořený cyklopropanon je při −78 °C stálý. Za přítomnosti protických molekul, například karboxylových kyselin, primárních a sekundárních aminů, nebo alkoholů, vytváří cyklopropanon adukty, které často lze izolovat za pokojové teploty:[4][5]
- (CH2)2CO + X-H → (CH2)2C(X)(OH)
- (X-H = R2N-H, HO-H, RO-H)
Struktura
[editovat | editovat zdroj]Molekula cyklopropanonu je rovinná. Vazba H2C-CH2 má neobvykle velkou délku 157,5 pm; délka vazeb C-C v cyklopropanu činí 151 pm. Vazba C=O má délku 119 pm, kratší než odpovídající vazba v acetonu (12 pm).[1]
Absorpční pás valenční vibrace νC=O se nachází na 1815 cm−1, což je přibližně o 70 cm−1 vyšší vlnočet, než je u ketonů obvyklé.
Deriváty
[editovat | editovat zdroj]Cyklopropanony jsou meziprodukty Favorského přesmyků, kde z cyklických ketonů vznikají karboxylové kyseliny se zmenšenými kruhy.
Cyklopropanony reagují v cykloadicích jako jako 1,3-dipóly.[1] Meziprodukty těchto reakcí jsou pravděpodobně oxyallyly nebo jejich valenční tautomery (vzniklé štěpením vazeb C2-C3).
Přes tyto meziprodukty probíhají i další reakce cyklopropanonů, například racemizace enantiomerně čistého (+)-trans-2,3-di-terc-butylcyklopropanonu při zahřátí na 80 °C.[6]
Oxyallylový meziprodukt byl také navržen u fotochemické přeměny 3,5-dihydro-4H-pyrazol-4-onu na indan za odštěpení dusíku:[7]
V této reakci oxyallylový meziprodukt A, jenž je v rovnováze s cyklopropanonem B, atakuje fenylový karbokation za vzniku nestálého cyklohexa-1,3-dienu C a následné rearomatizace. Rozdíl energie mezi A a B bývá 21 až 29 kJ/mol.
Koprin
[editovat | editovat zdroj]Derivát cyklopropanonu 1-aminocyklopropanol vzniká přirozeně hydrolýzou koprinu, toxinu obsaženého v některých houbách. 1-aminocyklopropanol inhibuje enzym acetaldehyddehydrogenázu.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Cyclopropanone na anglické Wikipedii.
- ↑ a b c Harry H. Wasserman; Donald R. Berdahl; Ta-Jung Lu. PATAI'S Chemistry of Functional Groups: Cyclopropyl Group. [s.l.]: [s.n.], 1987. ISBN 9780470023440. DOI 10.1002/0470023449.ch23. Kapitola The Chemistry of Cyclopropanones, s. 1455–1532.
- ↑ Nicholas J. Turro. Cyclopropanones. Accounts of Chemical Research. 1969, s. 25–32. DOI 10.1021/ar50013a004.
- ↑ Norbert De Kimpe. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.] DOI 10.1002/047084289X.rc302. Kapitola Cyclopropanone.
- ↑ J. Salaün; J. Marguerite. Cyclopropanone Ethyl Hemiacetal from Ethyl 3-Chloropropanoate. Organic Syntheses. 1985, s. 147. DOI 10.15227/orgsyn.063.0147.
- ↑ J. Salaün. Cyclopropanone Hemiacetals. Chemical Reviews. 1983, s. 619–632. DOI 10.1021/cr00058a002.
- ↑ Frederick D. Greene; David B. Sclove; Jose F. Pazos; Ronald L. Camp. Thermal reactions of a cyclopropanone. Racemization and decarbonylation of trans-2,3-di-tert-butylcyclopropanone. Journal of the American Chemical Society. 1970, s. 7488. DOI 10.1021/ja00728a051.
- ↑ Andrey G. Moiseev; Manabu Abe; Evgeny O. Danilov; Douglas C. Neckers. First Direct Detection of 2,3-Dimethyl-2,3-diphenylcyclopropanone. The Journal of Organic Chemistry. 2007, s. 2777–2784. DOI 10.1021/jo062259r. PMID 17362038.
- ↑ Jeffrey S. Wiseman; Robert H. Abeles. Mechanism of inhibition of aldehyde dehydrogenase by cyclopropanone hydrate and the mushroom toxin coprine. Biochemistry. 2002, s. 427-435. DOI 10.1021/bi00570a006. PMID 369602.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu cyklopropanon na Wikimedia Commons
Obrázky, zvuky či videa k tématu cyklopropanon na Wikimedia Commons



