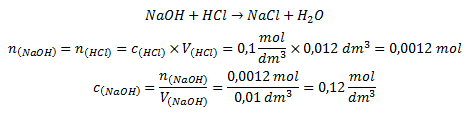Titrace


Titrace (volumetrie, odměrná analýza) je běžná laboratorní metoda kvantitativní chemické analýzy. Je to metoda, pomocí které se stanovuje neznámé množství látky v roztoku. Je založena na chemické reakci mezi známým odměrným roztokem a neznámým analyzovaným roztokem, kdy vzniká chemická sloučenina, která je indikovaná indikátorem.
Postup titrace[editovat | editovat zdroj]
Odměrný roztok o přesně známé koncentraci se nalije do byrety (dlouhé, úzké a kalibrované nádoby většinou s obsahem 50 ml a kohoutem na dolním konci). Z byrety se po otočení kohoutu přikapává odměrný roztok do směsi známého objemu analyzované látky a vhodného indikátoru. Postupným přikapáváním nastane bod ekvivalence, kdy veškerá analyzovaná látka zareagovala s odměrným roztokem a indikátor změnil svoji barvu. V této chvíli na základě znalosti koncentrace a objemu spotřebovaného odměrného roztoku, který odkapal z byrety, se výpočtem zjistí přesné množství analyzované látky. Titrace se obvykle provádí čtyřikrát, z toho první měření je jen orientační.
Metody titrace[editovat | editovat zdroj]
Metoda neutralizační (acidobazická)
Metoda srážecí

- Argentometrie
- Merkurimetrie
Metoda oxidimetrická (redoxní titrace)
- Manganometrie
- Bromatometrie
- Chromatometrie
- Jodometrie
Metoda reduktometrická (redoxní titrace)
- Titanometrie
- Chromometrie
Metoda komplexometrická (komplexotvorná)
Princip titrace[editovat | editovat zdroj]
Princip titrace se zakládá na stanovení neznámé koncentrace známého objemu analyzovaného roztoku, do kterého se přidává činidlo o známé koncentraci - nazývané titrační standard nebo zkráceně titr. Ve chvíli, kdy přidáme takové množství činidla, že látky spolu právě a beze zbytku zareagují, nastane bod ekvivalence. Aby se jednoznačně a přesně zjistilo, kdy nastal bod ekvivalence, přidává se do titrovaného roztoku indikátor. Změřením objemu spotřebovaného objemu činidla lze pak určit koncentraci neznámého analyzovaného vzorku.
Titrační standard[editovat | editovat zdroj]
Titrační standard (činidlo, odměrné činidlo, odměrný roztok) je vzorek látky o známé koncentraci, pomocí jehož spotřeby při titraci se určuje koncentrace měřené látky.
Požadavky na titrační standard jsou:
- musí se jednat o stálou látku, aby se v průběhu času neměnila koncentrace
- měl by mít velkou molární hmotnost
- musí se jednat o chemické individuum bez příměsí.
Požadavky na reakci mezi titračním standardem a analyzovanou látkou:
- známá reakce (definovaná stechiometrie)
- probíhá kvantitativně
- probíhá rychle
- umožňuje zachytit dosažení bodu ekvivalence
Indikátor[editovat | editovat zdroj]

Indikátor je látka, která se přidává k analyzované látce a která reaguje s první přebytečnou kapkou přidávaného činidla. Tato chemická reakce musí být viditelná. Nejčastěji dojde ke změně barvy, zákalu nebo pH.
Při acidobazických reakcích se často jako indikátory používají fenolftalein nebo methyloranž. Při komplexotvorných reakcích se jako indikátor často používá murexid.
Bod ekvivalence[editovat | editovat zdroj]
Bod ekvivalence nastává ve chvíli, kdy je k analyzované látce přidáno právě takové množství činidla, že spolu beze zbytku zareagují a další kapka přidávaného činidla viditelně zareaguje s indikátorem. Pro acidobazické titrace je charakteristická titrační křivka (závislost pH na přidaném objemu titračního činidla), která v bodě ekvivalence prudce změní hodnotu. Pro vícesytné kyseliny je takových „skoků“ více, každý odpovídá danému počtu vazeb.
Další metody určení bodu ekvivalence jsou instrumentální, např. spektroskopie, potenciometrie nebo konduktometrie.
Příklad[editovat | editovat zdroj]
Zadání
Titrační standard: roztok HCl
V(HCl) = 12 ml = 0,012 dm3 (objem spotřebovaný při titraci)
c(HCl) = 0,1 mol/dm3 (tzv. standardní koncentrace)
Analyzovaná látka: roztok NaOH
V(NaOH) = 10 ml = 0,01 dm3 (objem analyzovaného roztoku)
c(NaOH) = ? mol/dm3 (hledaná koncentrace)
Výpočet
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu titrace na Wikimedia Commons
Obrázky, zvuky či videa k tématu titrace na Wikimedia Commons
https://is.muni.cz/el/med/podzim2014/BVCP0121p/um/1-03_volumetrie__gravimetrie.pdf
https://isibalo.com/chemie/analyticka-chemie/volumetrie
https://www.ped.muni.cz/wchem/sm/hc/labtech/pages/titrace.html