Petasisova reakce
Petasisova reakce (také nazývaná Petasisova-Mannichova reakce boronových kyselin, zkráceně PBM) je vícesložková reakce aminu, karbonylové sloučeniny a vinyl- nebo arylboronové kyseliny za vzniku substituovaných aminů.

Objevil ji v roce 1993 Nicos Petasis jako metodu syntézy geometricky čistého fungicidu naftifinu.[1][2][3] Při Petasisově reakci slouží vinylová skupina boronové kyseliny jako nukleofil. Ve srovnání s ostatními způsoby přípravy allylaminů Petasisova reakce umožňuje použití většího počtu různých aminů a boronových kyselin jako výchozích látek, navíc nevyžaduje bezvodé nebo inertní prostředí. Je vhodná na přípravu α-aminokyselin, využívá se v kombinatorní chemii a při vývoji léčiv.[4][5][6][7]
Mechanismus[editovat | editovat zdroj]
Mechanismus Petasisovy reakce není zcela jasný, neví se, který meziprodukt slouží jako elektrofil. Petasis předpokládal, že při reakci se vytváří komplexní rovnováha mezi třemi výchozími látkami a řadou různých meziproduktů, přičemž konečný produkt vzniká nevratnou tvorbou vazby C-C, která určuje rychlost reakce. Kondenzací aminu 1 s karbonylovou sloučeninou 2 se vytváří poloaminal 4, který je v rovnováze s iminiovým iontem 3 a aminalem 5. Boronová kyselina 6 reaguje s poloaminalem na meziprodukt 7 a aminalem na 8, čímž se znovu vytvoří elektrofilní iminiový ion 3, v tomto případě společně s nukleofilním boronátem. Nejsou žádné důkazy, že by boronová kyselina reagovala přímo s iminiem: Kromě nutnosti použití kyseliny k tvorbě dostatečného množství iminiových solí bylo také zjištěno, že vinylboronové kyseliny nereagují dobře s předem vytvořenými iminiovými solemi (jako je Eschenmoserova sůl). Následuje nevratná tvorba vazby C-C bond migrací mezi 3 a 3', čímž za odštěpení boronové kyseliny vznikne konečný produkt 9. Ke konečnému produktu vedou všechny meziprodukty, protože reakce 3 a 3' je nevratná, čímž se rovnováha celého systému posouvá směrem k produktu.[8]

Ke zkoumání mechanismu Petasisovy reakce byly provedeny studie založené na teorii funkcionálu hustoty. Pomocí reakce kyseliny glyoxalové, dimethylaminu a kyseliny fenylboronové bylo zjištěno, že migrace substituentu boronové kyseliny (zde fenylu) „átového komplexu“ A je doprovázena energetickou bariérou okolo 40 kJ/mol a vznikem pětičlenného přechodného stavu B.[9]
T. K. Hansen se spolupracovníky potvrdil tvorbu kvartérních boronových solí během reakce, zjistil, že za nepřítomnosti aminu dochází po přidání kyseliny glyoxalové do roztoku kyseliny fenylboronové k přesunu 11B, což je pravděpodobně způsobeno vznikem na elektrony bohatých boronátů.[10]

Provedení[editovat | editovat zdroj]
Petasisova reakce probíhá za mírných podmínek, bez použití silných kyselin či zásad nebo kovů. Amin se smíchá s karbonylovým substrátem, za použití dioxanu nebo toluenu jako rozpouštědla, a reakce se nechá běžet 10 minut při 90 °C. Následně se k reakční směsi přidá boronová kyselina a po dalších 30 minutách při 90 °C nebo několika hodinách za 25 °C se vytvoří konečný produkt. Při syntéze α-aminokyselin se α-ketokyselina, jako je například kyselina glyoxalová nebo pyrohroznová, v ethanolu, toluenu nebo dichlormethanu smíchá s aminem a vinylboronovou kyselinou při 25 až 50 °C a reakce trvá 12 až 48 h, přičemž se vytvoří příslušná β,γ-nenasycená sloučenina.[1]

Jednou z nejpřitažlivějších vlastností Petasisovy reakce je použití boronových kyselin jako zdrojů nukleofilů. Na rozdíl od většiny vinylových sloučenin jsou vinylboronové kyseliny stabilní vůči vzduchu a vodě a mohou být odstraněny jednoduchou extrakcí. Mnoho derivátů boronových kyselin je snadných na přípravu a díky objevu Suzukiovy reakce je mnoho z nich komerčně dostupných. Boronové kyseliny lze získat hydroborací koncových alkynů katecholboranem.[1]

Byly popsány i jiné způsoby syntézy organoboronových kyselin.[11][12]
Rozsah a využití[editovat | editovat zdroj]
Do Petasisovy reakce lze zapojit mnoho různých funkčních skupin, jako jsou například alkoholy, karboxylové kyseliny a aminy. K substrátům použitelným za daných reakčních podmínek patří vinylboronátové a arylboronátové estery a draselné organotrifluorboritany.[13][14][15]
Místo sekundárních aminů lze také použít řadu podobných sloučenin, jako jsou aromatické aminy, hydraziny, hydroxylaminy, sulfonamidy a indoly.[16][17][18][19]
Syntéza allylaminů[editovat | editovat zdroj]
Petasis navrhl, že vinylboronové kyseliny mohou reagovat s adukty sekundárních aminů a paraformaldehydu za vzniku terciárních allylaminů. Geometrie dvojné vazby boronové kyseliny zůstává u produktu plně zachována. Následující reakce má výtěžnost 96 %:[1]
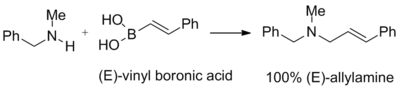
Tato reakce byla použita k přípravě povrchového antimykotika naftifinu, v jednom kroku s 82% výtěžností. Jinými sloučeninami s podobnou strukturou jsou terbinafin a NB598.[1]

Syntéza aminokyselin[editovat | editovat zdroj]
β,γ-nenasycené N-substituované aminokyseliny lze připravit kondenzacemi boronových kyselin, boronátů nebo boronových esterů s aminy a glyoxalovými kyselinami. Výtěžnosti obvykle bývají mezi 60 a 80 a lze použít velké množství různých polárních i nepolárních rozpouštědel (nejčastější jsou dichlormethan (DCM) a methanol (MeOH). Aminokyseliny bez N-substituentů lze připravit za použití tritylaminu nebo bis-(4-methoxyfenyl)methylaminu a odstraněním chránicí skupiny za přítomnosti kyseliny.[2] Použití vysoce polárních protických rozpouštědel, jako je hexafluorisopropylalkohol (HFIP) může vést ke kratší reakční době i vyšším výtěžkům. Reakce methanolu může být též urychlena pomocí mikrovlnného záření.[20]
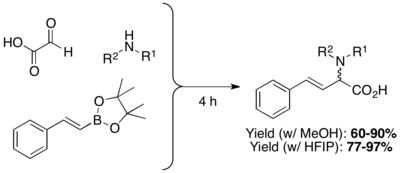
Mimo vinylboronových kyselin lze také použít arylboronové kyseliny a heterocyklické deriváty. Substráty zde mohou být například thienylové, pyridylové, furylové, benzofuranylové, 1-naftylové a arylové sloučeniny obsahující substituenty dodávající i odtahující elektrony.[13]

Antiagregans klopidogrel je možné připravit v racemické podobě v dvoukrokovém postupu zahrnujícím Petasisovu reakci. Kysele katalyzovaná esterifikace následovaná vícesložkovou párovací reakcí vede ke vzniku klopidogrelu s celkovou výtěžností 44 %.[21]

Petasisova reakce je vysoce stereoselektivní, jestliže je jako substrát použit chirální amin či aldehyd. Při smíchání některých chirálních aminů, například (S)-2-fenylglycinolu, s α-ketokyselinami a vinylboronovými kyselinami za pokojové teploty vzniká jediný diastereomer allylaminu. Enantiomerní čistoty lze dosáhnout hydrogenací takovéhoto produktu. Při reakci s (S)-2-fenylglycinolem se tvoří (R)-2-fenylglycinol s 76% výtěžností.[1]

Neobvyklé syntézy karboxylových kyselin[editovat | editovat zdroj]
Mimo aminokyseliny lze Petasisovy borono-Mannichovy reakce použít také na přípravu karboxylových kyselin, i když jde o neobvyklý postup. Bylo popsáno využití N-substituovaných indolů jako ekvivalentů aminů. Mechanismus začíná nukleofilním atakem na pozici 3 N-substituovaného indolu na elektrofilní aldehyd, po němž následuje tvorba „átového komplexu“ 1 reakcí boronové kyseliny s karboxylovou kyselinou. Meziprodukt je poté dehydratován a poté dochází k přesunu boronáto-alkylové skupiny za vzniku karboxylové kyseliny. Výtěžnosti se pohybují mezi 40 a 70 %. Je možné použít řadu různých boronových kyselin, použití vinylboronových však popsáno nebylo. Indoly nesubstituované na dusíkových atomech reagují za běžných reakčních podmínek pomalu, což podporuje níže uvedený mechanismus.[19]

Jako náhrady aminových nukleofilů lze v Petasisových reakcích využít též terciární aromatické aminy. Mechanismus je podobný jako u N-substituovaných indolů. Reakce probíhá za tvrdých podmínek (24hodinového refluxu v 1,4-dioxanu), ale výtěžnost karboxylové kyseliny je poměrně dobrá (41 až 54 %), přičemž při použití α-ketokyselin místo kyseliny glyoxalové se nesnižuje.
Podobnou funkci jako terciární aromatické aminy mohou mít rovněž 1,3,5-trioxygenované deriváty benzenu.

Syntéza derivátů iminodikarboxylových kyselin[editovat | editovat zdroj]
Jako dusíkaté nukleofily mohou být aminokyseliny použity na přípravu derivátů iminodikarboxylových kyselin. Při těchto reakcích se obvykle dosahuje vysoké diastereoselektivity a nově vytvořená stereocentra mívají většinou stejné konfigurace jako použité aminokyseliny. Reakce dobře probíhá v polárních rozpouštědlech, jako jsou voda a ethanol. Jako dusíkaté nukleofily lze použít rovněž peptidy, které nemají navázané chránicí skupiny na koncové dusíky. Petasis se svými spolupracovníky připravil inhibitor acetylcholinesterázy enalaprilat.[8]

Syntéza peptidomimetických heterocyklů[editovat | editovat zdroj]
Pomocí diaminů lze PBM reakcemi vytvořit heterocykly o řadě různých struktur, například piperazinony, benzopiperazinony and benzodiazepinony. Do syntézy jsou často zapojeny laktamizační reakce, často v silně kyselém prostředí.[8]
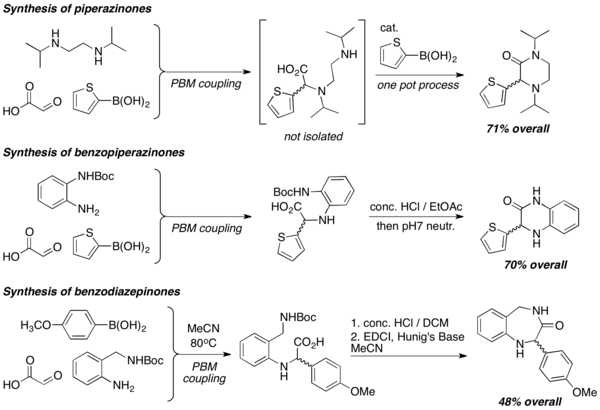
Syntéza aminoalkoholů[editovat | editovat zdroj]
Když se jako substrát při syntéze β-aminoalkoholů použije α-hydroxyaldehyd, vzniká jediný diastereomer. Reakce vytváří výhradně anti-produkty, což bylo potvrzeno 1H NMR spektroskopie. Produkt nepodléhá racemizaci a při zapojení enantiomerně čistých α-hydroxyaldehydů nelze očekávat významný enantiomerní přebytek. Boronová kyselina pravděpodobně nejprve reaguje s chirálním hydroxylem, čímž vznikne nukleofilní alkenylboronát, následně dojde k vnitromolekulární migraci alkenylové skupiny na elektrofilní iminiový uhlík, která způsobí nevratnou tvorbu vazby C-C. Při použití enantiomerně čistých glyceraldehydů vzniká příslušný 3-amino-1,2-diol s 70% výtěžností a více než 99% enantiomerním přebytkem.[3]
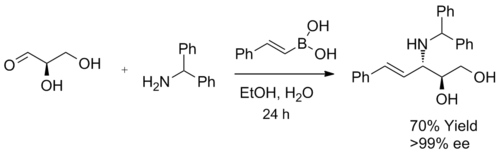
Diastereoselektivita se utváří reakcí stabilnější (a reaktivnější) konformace átového komplexu, u něhož je menší 1,3-allylové napětí.[22][23][24]

Pomocí dihydroxyacetonu, používaného jako neobvyklý ekvivalent aldehydu, byla Petasisovou reakcí získána základní struktura imunosupresiva FTY720 se 40% výtěžkem. Výsledný produkt se tvoří jednokrokovým odstraněním benzylové skupiny a hydrogenací dvojné vazby C-C.[25]
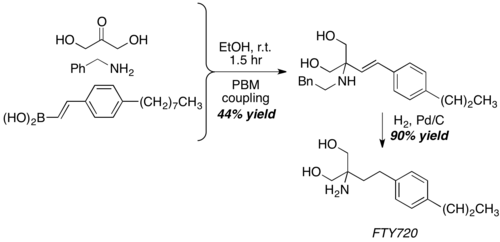
Syntéza aminopolyolů a aminosacharidů[editovat | editovat zdroj]
Petasis popsal využití nechráněných sacharidů jako karbonylových složek PBM reakcí. Používají se jako ekvivalenty α-hydroxyaldehydů, které již mají vytvořenou chiralitu. Použít se dá velký počet různých sacharidů i dusíkatých nukleofilů (například aminokyselin). Aminopolyolové produkty lze poté zapojit do dalších reakcí a získat z nich aminosacharidy. Petasis použil tuto variantu na přípravu manosaminu z D-arabinózy.[8]
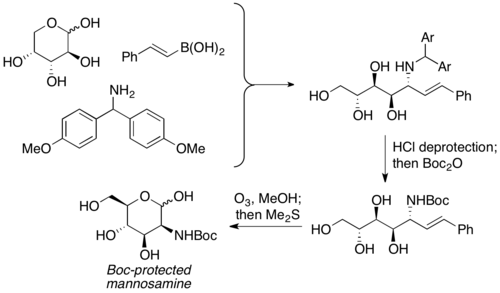
Využití v enantioselektivní syntéze[editovat | editovat zdroj]
Chirální aminové nukleofily[editovat | editovat zdroj]
Jsou-li v Petasisových reakcích použity chirální aminy, tak je stereochemie produktů závislá na chiralitě aminu a dobré diastereoselektivity se dosahuje i bez zapojení objemných chirálních skupin. Chirální benzylaminy,[26] 2-substituované pyrrolidiny[27] a 5-substituované 2-morfolinony[28][29] vytvářejí dobré diastereomerní přebytky za různých podmínek.

Chirální N-acyliminiové ionty[editovat | editovat zdroj]
Chirální N-acyliminiové reaktanty se obvykle připravují in situ dehydratací cyklických poloaminalů. Mají chirální hydroxylové skupiny v blízkosti iminiových uhlíků; s boronovými kyselinami tyto chirální hydroxyly reagují za vzniku chirálních boronátů s vysokou elektronovou hustotu, poté následuje stranově selektivní mezimolekulární boronáto-vinylový/arylový přenos na iminiový uhlík. Reakce se vyznačuje vysokou diastereoselektivitou, hlavním mechanismem je cis-boronátový arylový/vinylový přenos. Hydroxypyrrolidiny[30] a hydroxy-γ- a δ-laktamy[31] reagují velmi diastereoselektivně, ovšem vyžadují použití vinyl- nebo arylboronových kyselin bohatých na elektrony.

R. A. Batey využil vysokou diastereoselektivitu této reakce k přípravě (±)-6-deoxykastanosperminu v sedmi krocích, s využitím vinylboronového esteru, za celkové výtěžnosti 32 %. Acyklický prekurzor deoxykastanosperminu (A) byl získán kondenzací vinylboronového esteru 1 s hydroxypyrrolidinem chráněným karboxybenzylovou skupinou (Cbz) v PBM reakci, po níž následovala dihydroxylace a ochrana terc-butyldimethylsilylem (TBS). Poté proběhla vnitromolekulární cyklizace přes tvorbu iminu a redukci, po odstranění TBS se vytvořil (±)-6-deoxykastanospermin.[32]

Katalýza thiomočovinou[editovat | editovat zdroj]
Y. Takemoto se svými spolupracovníky popsal enantioselektivní reakci Petasisova typu vedoucí k přeměně chinolinů na odpovídající chirální 1,2-dihydrochinoliny pomocí alkenylboronových kyselin a katalyzátorů tvořených chirálními deriváty thiomočoviny. Výtěžnosti se pohybují od 59 do 78 % a enantioselektivity mezi 82 a 96 %.[33]

Takemoto také pozoroval, že je nezbytné přidání chlormravenčanů jako elektrofilních aktivátorů, bez kterých by reakce neproběhla; katalyzátorem musí být 1,2-aminoalkohol, aby byla dosažena stereoselektivita. Tato zjištění byla vysvětlena tím, že chlormravenčany reagují s chinolinovými atomy dusíku, čímž se tvoří N-acylované chinoliniové meziprodukty B, které jsou dále aktivované elektrofilními chirálními močovinami. 1,2-aminoalkoholy vytváří cheláty s alkenylboronovými kyselinami; tato chelatace řídí stereochemii produktu.[33]

Chirální bifenoly[editovat | editovat zdroj]
Schaus a Lou provedli následující reakci, ve které reagují chirální α-aminokyseliny ve směsích alkenyldiethylboronátů, sekundárních aminů, glyoxalátů a chirálních bifenolů v toluenu:[34]

V této reakci je možné použít velké množství různých funkčních skupin, a to na alkenylboronátech i na sekundárních aminech: elektronová hustota na substrátu nemá vliv na výtěžnost a enantioselektivitu a stericky zatížené substráty (jako jsou dialkylované alkenylboronáty a aminy obsahující α-stereocentra) snižují enantioselektivitu jen málo. Rychlost reakce je v každém případě jiná.[34]
Za popsaných podmínek boronové kyseliny neposkytují žádnou enantioselektivitu a používají se molekulová síta. I když autoři nezdůvodňují jejich použití, tak se předpokládá, že zachytávají vodu a brání rozkladu alkenyldiethylboronátů na příslušné boronové kyseliny. Katalyzátor lze obnovit a znovu použít beze změny výtěžnosti či enantioselektivity.[34]
Později byly propojeny oba postupy (chirální thiomočovinové katalyzátory a chirální bifenoly) s jediným katalyzátorem, tento katalytický systém byl jako první schopen provést enantioselektivní Petasisovu reakci salicylaldehydů, cyklických sekundárních aminů a aryl- nebo alkenylboronových kyselin:[35]
Petasisova reakce byla také použita k rychlému získání multifunkčního základu pro divergentní syntézu. Reaktanty byly laktol kyseliny L-mléčné, aceton, methylester l-fenylalaninu a boronová kyselina. Reakce probíhala v ethanolu za pokojové teploty, vytvořil se anti-1,2-aminoalkohol s diastereomerním přebytkem 9 %.[36]
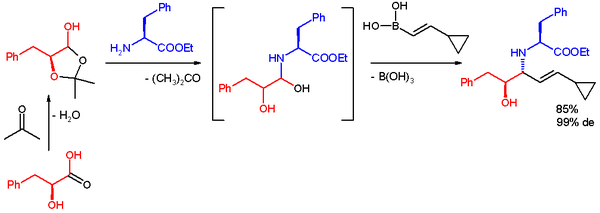
Nepodařilo se tímto postupem připravit syn-1,2-aminoalkohol. V jiné práci byla popsána příprava syn-aminoalkoholu níže zobrazenou reakcí, využívající chirální dibrombifenolový katalyzátor:[37]

I když tato reakce vytváří syn-produkt v převaze oproti anti-produktu (v poměru 1,5:1 až 7,5:1), tak je množství využitelných substrátů malé a diastereoselektivita závisí na stereogenních centrech použitých aminů.[37]
Využití v totálních syntézách[editovat | editovat zdroj]
J.-M. Beau připravil dihydropyranové jádro kongenerů zanamiviru spojením PBM reakce a posloupnosti cyklizačních reakcí řízené železitými ionty. Chirální α-hydroxyaldehyd 2, diallylamin a dimethylketalem chráněná boronová kyselina 1 vytvořily acyklický aminoalkohol 3, z něhož poté cyklizací vznikl bicyklický dihydropyran 4. Po selektivním otevírání oxazolinové části cyklu tohoto meziproduktu následovala reakce s vodou nebo trimethylsilylazidem za tvorby produktů se strukturami podobnými zanamiviru.[38]

Skupina vedená C.-H. Wongem připravila kyselinu N-acetylneuraminovou PBM reakcí následovanou [3+2] cykloadicí nitronu. Vinylboronová kyselina reagovala s L-arabinózou 1 a bis(4-methoxyfenyl)methanaminem 2 za vzniku allylaminu 3. Poté následovala dipolární cykloadice, zásaditě katalyzované štěpení vazby N-O a hydrolýza.[39]
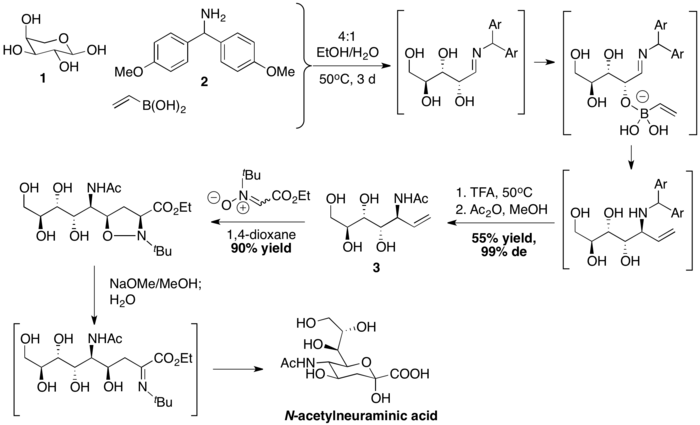
Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Petasisova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Petasisova reakce na Wikimedia Commons
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Petasis reaction na anglické Wikipedii.
- ↑ a b c d e f Petasis, N. A.; AKRITOPOULOU, I. The boronic acid mannich reaction: A new method for the synthesis of geometrically pure allylamines. Tetrahedron Letters. 1993, s. 583–586. DOI 10.1016/S0040-4039(00)61625-8.
- ↑ a b Petasis, N. A.; ZAVIALOV, I. A. A New and Practical Synthesis of -Amino Acids from Alkenyl Boronic Acids. Journal of the American Chemical Society. 1997, s. 445–446. DOI 10.1021/ja963178n.
- ↑ a b Petasis, N. A.; ZAVIALOV, I. A. Highly Stereocontrolled One-Step Synthesis of anti-β-Amino Alcohols from Organoboronic Acids, Amines, and α-Hydroxy Aldehydes. Journal of the American Chemical Society. 1998, s. 11798–11799. DOI 10.1021/ja981075u.
- ↑ N. R. Candeias; F. Montalbano; P. M. S. D. Cal; P. M. P. Gois. Boronic Acids and Esters in the Petasis-Borono Mannich Multicomponent Reaction. Chemical Reviews. 2010, s. 6169–6193. DOI 10.1021/cr100108k. PMID 20677749.
- ↑ R. A. Batey. Boronic Acids: Preparation and Applications in Organic Synthesis and Medicine. [s.l.]: Wiley-VCH, 2005. Dostupné online. ISBN 9783527606542. DOI 10.1002/3527606548.ch7. Kapitola Nucleophilic Addition Reactions of Aryl and Alkenylboronic Acids and Their Derivatives to Imines and Iminium Ions, s. 279–304.
- ↑ T. R. Ramadhar; R. A. Batey. Boronic Acids: Preparation and Applications in Organic Synthesis, Medicine and Materials, Second Edition. [s.l.]: Wiley-VCH, 2011. ISBN 9783527639328. DOI 10.1002/9783527639328.ch9. Kapitola Recent Advances in Nucleophilic Addition Reactions of Organoboronic Acids and Their Derivatives to Unsaturated CN Functionalities, s. 427–477.
- ↑ Peng Wu; Michael Givskov; Thomas E. Nielsen. Reactivity and Synthetic Applications of Multicomponent Petasis Reactions. Chemical Reviews. 2019-08-27, s. 11245–11290. DOI 10.1021/acs.chemrev.9b00214. PMID 31454230.
- ↑ a b c d N. A. Petasis. Multicomponent Reactions. [s.l.]: Wiley-VCH, 2005. Dostupné online. ISBN 9783527605118. DOI 10.1002/3527605118.ch7. Kapitola Multicomponent Reactions with Organoboron Compounds, s. 199–223.
- ↑ N. R. Candeias; P. M. S. D. Cal; V. Andre; M. T. Duarte; L. F. Veiros; P. M. P. Gois. Water as the reaction medium for multicomponent reactions based on boronic acids. Tetrahedron. 2010, s. 2736–2745. DOI 10.1016/j.tet.2010.01.084.
- ↑ N. Schlienger; M. R. Bryce; T. K. Hansen. The Boronic Mannich Reaction in a Solid-Phase Approach. Tetrahedron. 2000, s. 10023–10030. DOI 10.1016/s0040-4020(00)00957-1.
- ↑ R. W. Hoffmann; S. Dresely. Preparation of 3-substituted (E)-1-alkenylboronic esters. Synthesis. 1988, s. 103–106. DOI 10.1055/s-1988-27480.
- ↑ H. C. Brown; N. G. Bhat; R. R. Iyer. A novel route to 1,3-dienyl-2-boronic esters providing simple syntheses of conjugated (E,E)-dienes and conjugated (E)-alkenones. Tetrahedron Letters. 1991, s. 3655–3658. DOI 10.1016/s0040-4039(00)79758-9.
- ↑ a b N. A. Petasis; A. Goodman; I. A. Zavialov. A new synthesis of α-arylglycines from aryl boronic acids. Tetrahedron. 1997, s. 16463–16470. DOI 10.1016/S0040-4020(97)01028-4.
- ↑ G. W. Kabalka; B. Venkataiah; G. Dong. The use of potassium alkynyltrifluoroborates in Mannich reactions. Tetrahedron Letters. 2004, s. 729–731. DOI 10.1016/j.tetlet.2003.11.049.
- ↑ J.-P. Tremblay-Morin; S. Raeppel; F. Gaudette. Lewis acid-catalyzed Mannich type reactions with potassium organotrifluoroborate. Tetrahedron Letters. 2004, s. 3471–3474. DOI 10.1016/j.tetlet.2004.03.014.
- ↑ D. E. Portlock; D. Naskar; L. West; M. Li. Petasis boronic acid-Mannich Reactions of substituted hydrazines: synthesis of α-hydrazino carboxylic acids. Tetrahedron Letters. 2002, s. 6845–6847. DOI 10.1016/S0040-4039(02)01511-3.
- ↑ D. Naskar; A. Roy; W. L. Seibel; D. E. Portlock. Hydroxylamines and sulfinamide as amine components in the Petasis boronic acid–Mannich reaction: synthesis of N-hydroxy or alkoxy-α-aminocarboxylicacids and N-(tert-butyl sulfinyl)-α-amino carboxylicacids. Tetrahedron Letters. 2003, s. 8865–8868. DOI 10.1016/j.tetlet.2003.09.179.
- ↑ D. Naskar; A. Roy; W. L. Seibel; D. E. Portlock. Novel Petasis Boronic Acid—Mannich Reactions with Tertiary Aromatic Amines. Tetrahedron Letters. 2003, s. 5819–5821. DOI 10.1016/S0040-4039(03)01405-9.
- ↑ a b D. Naskar; S. Indoles; A. Roy; A. B. Mandal. Novel Petasis boronic acid reactions with indoles: synthesis of indol-3-yl-aryl-acetic acids. Tetrahedron Letters. 2008, s. 6762–6764. DOI 10.1016/j.tetlet.2008.08.029.
- ↑ H. Jourdan; G. Gouhier; L. Van Hijfte; P. Angibaud; S. R. Piettre. On the use of boronates in the Petasis reaction. Tetrahedron Letters. 2005, s. 8027–8031. DOI 10.1016/j.tetlet.2005.09.060.
- ↑ C. Kalinski; M. Lemoine; J. Schmidt; C. Burdack; J. Kolb; M. Umkehrer; G. Ross. Multicomponent Reactions as a Powerful Tool for Generic Drug Synthesis. Synthesis. 2008, s. 4007–4011. DOI 10.1055/s-0028-1083239.
- ↑ A. S. Davis; S. G. Pyne; S. W. Skelton; A. H. White. Synthesis of putative uniflorine A. The Journal of Organic Chemistry. 2004, s. 3139–3143. DOI 10.1021/jo049806y. PMID 15104453.
- ↑ C. W. G. Au; S. G. Pyne. Asymmetric synthesis of anti-1,2-amino alcohols via the Borono-Mannich reaction: A formal synthesis of (−)-swainsonine. The Journal of Organic Chemistry. 2006, s. 7097–7099. DOI 10.1021/jo0610661. PMID 16930074.
- ↑ S. G. Pyne; C. W. G. Au; A. S. Davis; I. R. Morgan; T. Ritthiwigrom; A. Yazici. Exploiting the borono-Mannich reaction in bioactive alkaloid synthesis. Pure and Applied Chemistry. 2008, s. 751–762. DOI 10.1351/pac200880040751.
- ↑ S. Sugiyama; S. Arai; M. Kiriyama; K. Ishii. A convenient synthesis of immunosuppressive agent FTY720 using the petasis reaction. Chemical and Pharmaceutical Bulletin. 2005, s. 100–102. DOI 10.1248/cpb.53.100. PMID 15635240.
- ↑ B. Jiang; C.-G. Yang; X.-H. Gu. A highly stereoselective synthesis of indolyl N-substituted glycines. Tetrahedron Letters. 2001, s. 2545–2547. DOI 10.1016/s0040-4039(01)00229-5.
- ↑ K. K. Nanda; B. W. Trotter. Diastereoselective Petasis Mannich reactions accelerated by hexafluoroisopropanol: a pyrrolidine-derived arylglycine synthesis. Tetrahedron Letters. 2005, s. 2025–2028. DOI 10.1016/j.tetlet.2005.01.151.
- ↑ L. M. Harwood; G. S. Currie; M. G. B. Drew; R. W. A. Luke. Asymmetry in the boronic acid Mannich reaction: diastereocontrolled addition to chiral iminium species derived from aldehydes and (S)-5-phenylmorpholin-2-one. Chemical Communications. 1996, s. 1953. DOI 10.1039/cc9960001953.
- ↑ G. S. Currie; M. G. B. Drew; L. M. Harwood; D. J. Hughes; R. W. A. Luke; R. J. Vickers. Chirally templated boronic acid Mannich reaction in the synthesis of optically active α-amino acids. Journal of the Chemical Society, Perkin Transactions 1. 2000, s. 2982–2990. DOI 10.1039/B003067H.
- ↑ R. A. Batey; D. B. MacKay; V. Santhakumar. Alkenyl and Aryl BoronatesMild Nucleophiles for the Stereoselective Formation of Functionalized N -Heterocycles. Journal of the American Chemical Society. 1999, s. 5075–5076. DOI 10.1021/ja983801z.
- ↑ I. R. Morgan; A. Yazici; S. G. Pyne. Diastereoselective borono-Mannich reactions on cyclic N-acyliminium ions. Tetrahedron. 2008, s. 1409–1419. DOI 10.1016/j.tet.2007.11.046.
- ↑ R. A. Batey; D. B. MacKay. Total synthesis of (±)-6-deoxycastanospermine: an application of the addition of organoboronates to N-acyliminium ions. Tetrahedron Letters. 2000, s. 9935–9938. DOI 10.1016/s0040-4039(00)01790-1.
- ↑ a b Y. Yamaoka; H. Miyabe; Y. Takemoto. Catalytic enantioselective petasis-type reaction of quinolines catalyzed by a newly designed thiourea catalyst. Journal of the American Chemical Society. 2007, s. 6686–6687. DOI 10.1021/ja071470x. PMID 17488015.
- ↑ a b c S. Lou; S. E. Schaus. Asymmetric petasis reactions catalyzed by chiral biphenols. Journal of the American Chemical Society. 2008, s. 6922–6923. DOI 10.1021/ja8018934. PMID 18459782.
- ↑ W.-Y. Han; Z.-J. Wu; X.-M. Zhang; W.-C. Yuan. Enantioselective Organocatalytic Three-Component Petasis Reaction among Salicylaldehydes, Amines, and Organoboronic Acids. Organic Letters. 2012, s. 976–979. DOI 10.1021/ol203109a. PMID 22292670.
- ↑ Naoya Kumagai; Stuart L. Schreiber. Short Synthesis of Skeletally and Stereochemically Diverse Small Molecules by Coupling Petasis Condensation Reactions to Cyclization Reactions. Angewandte Chemie International Edition. 2006, s. 3635–3638. DOI 10.1002/anie.200600497. PMID 16646101.
- ↑ a b G. Muncipinto; P. N. Moquist; S. L. Schreiber; S. E. Schaus. Catalytic Diastereoselective Petasis Reactions. Angewandte Chemie International Edition. 2011, s. 8172–8175. DOI 10.1002/anie.201103271. PMID 21751322.
- ↑ J.-F. Soule; A. Mathieu; S. Norsikian; J.-M. Beau. Coupling the Petasis condensation to an iron(III) chloride-promoted cascade provides a short synthesis of Relenza congeners. Organic Letters. 2010, s. 5322–5325. DOI 10.1021/ol102326b. PMID 20945892.
- ↑ Z. Hong; L. Liu; C.-C. Hsu; C.-H. Wong. Three-Step Synthesis of Sialic Acids and Derivatives. Angewandte Chemie International Edition. 2006, s. 7417–7421. DOI 10.1002/anie.200601555. PMID 17031889.
