Mezimolekulární karbenoidová cyklopropanace
Mezimolekulární karbenoidová cyklopropanace je organická reakce, při níž vzniká cyklopropanový kruh z karbenoidu a alkenu.[1] Zvláštním případem je Simmonsova–Smithova reakce, kde se jako kov využívá zinek.
Cyklopropany lze vytvořit reakcemi karbenoidů (získaných z diazosloučenin, přechodných kovů) a alkenů. Přestože je vnitromolekulární provedení takových reakcí známo od roku 1961,[2] tak byly chemo- a stereoselektivní mezimolekulární cyklopropanace katalyzované kovy vyvinuty později. Nejčastějšími katalyzátory jsou komplexy karboxylátů, například octanu rhodnatého. Enantioselektivní cyklopropanace obvykle využívají předem vytvořené komplexy chirálními ligandy.[3]
Mechanismus a stereochemie[editovat | editovat zdroj]
Přesný mechanismus není znám, na základě rozdělení produktů a stereoselektivity byla ale vytvořena přibližná podoba.[4] Atakem diazosloučeniny na kovové centrum vznikne zwitteriontový alkylový komplex, ze kterého se odštěpí dusík za vzniku karbenového meziproduktu. Adicí tohoto karbenu na alken (aniž by došlo k přímému navázání alkenu na kov) se vytvoří cyklopropanový produkt.[5] Konfigurace alkenu zůstává zachována,[6] ale karbeny, jejichž molekuly mají heterotopní strany, mohou vytvořit směsi několika diastereomerů.
Konfiguraci produktu určuje dráha, po které se alken přibližuje ke karbenu. Při reakcích monosubstitovaných karbenů s koncovými alkeny bývá dvojná vazba uhlík–uhlík u alkenu téměř rovnoběžná s dvojnou vazbou kov-uhlík u karbenu a R skupina alkenu míří směrem od substituentu karbenu.[7] U reaakcí vinylovaných karbenů byl navržen model, kde se alken přibližuje s dvojnou vazbou kolmo na vazbu kov-uhlík v karbenu.[8]
Stereoselektivní provedení[editovat | editovat zdroj]
Stereoselektivní přípravy cyklopropanů z diazokarbonylových sloučenin a alkenů mohou být založeny na předem připravených rhodiových katalyzátorech, nebo na chirálních pomocnících navázaných na diazokarbonyly; vysoce účinným katalyzátorem takových reakcí je například Rh2[S-DOSP]4.[9]
K diastereoselektivním cyklopropanacím s využitím diazoesterů lze použít chirální pomocníky odvozené od chirálních alkoholů (například pantolaktonu).[10]
Rozsah a omezení[editovat | editovat zdroj]
Cyklopropanace alkenů diazokarbonylovými sloučeninami jsou většinou katalyzovány sloučeninami rhodia, ale původně se používaly komplexy mědi.[11] Při katalýze rhodiem lze jako substráty použít alkeny s vysokou,[12] střední,[13] i nízkou elektronovou hustotou.[14]
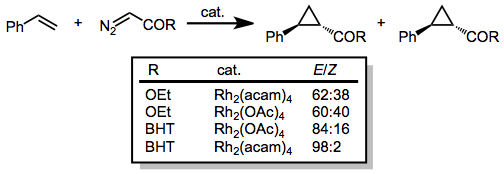
Diazoacetáty obsahující jedinou karbonyl skupinu navázanou na diazouhlík lze použít s mnoha různými alkeny. Diastereoselektivita ve prospěch (E)- cyklopropanů roste s velikostí esterové skupiny. Diastereoselektivitu zlepšuje také zvýšení elektronové hustoty na katalyzátoru (například nahrazením acetátových skupin acetamidovými).[15]
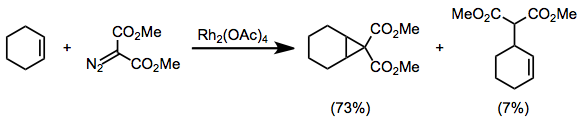
Diazokarbonylové sloučeniny substituované dvěma skupinami odtahujícími elektrony, například diazomalonáty, jsou při cyklopropanacích náchylné k vedlejším reakcím; pozorovány byly produkty [3+2] cykloadicí[16] a C-H insercí.[17]
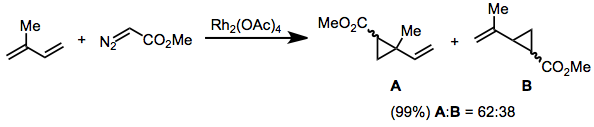
Diazoacetáty s vinylovými nebo arylovými substituenty na diazouhlících nereagují s trans-alkeny. Reakce těchto substrátů jsou velmi selektivní ve prospěch (E)-cyklopropanů.[18]
Vinyldiazoacetaáty reagují s dieny za tvorby divinylcyklopropanů, které vstupují do Copeových přesmyků, vytvářejících cykloheptadieny;[19] přitom přednostně reagují více substituované dvojné vazby dienů.[20]
Furany reagují s vinyldiazoacetátry podobně, ale cyklopropanový meziprodukt se kromě Copeova přesmyku může také přeměnit na otevřenou nenasycenou karbonylovou sloučeninu. Rozdělení produktů je výrazně ovlivňováno substituenty na furanovém kruhu.[21]

Pyrroly s vinyldiazoacetáty vytváří cykloheptadieny obsahující dusíkové můstky. Při použití methyllaktátových chirálních pomocníků lze dosáhnout dobré diastereoselektivity v tandemech cyklopropanací s Copeovými přesmyky na pyrrolech s navázanými terc-butoxykarbonylovými chránicími skupinami.[22]
Využití[editovat | editovat zdroj]
Enantioselektivní mezimolekulární karbenoidové cyklopropanace se používají při výrobě chirálních cyklopropanových antibiotik, jako je cilastatin.[23]
Spojení cyklopropanace a fragmentace je součástí výroby kyseliny 12-hydroxyikosatetraenové.[24]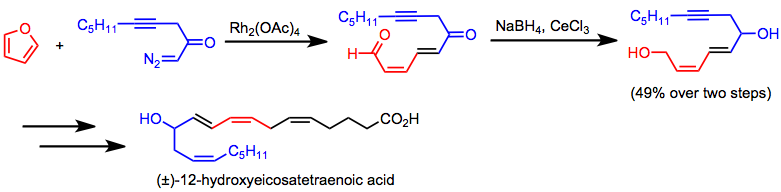
Srovnání s jinými postupy[editovat | editovat zdroj]
Často používanou alternativou cyklopropanací katalyzovaných rhodiem je Simmonsova-Smithova cyklopropanace, využívající karbeny odvozené od diethylzinku a dijodmethanu. Za přítomnosti chirálních diaminů jsou Simmonsovy-Smithovy cyklopropanace enantioselektivní, i když jsou selektivity nižší.[25]
Substituované zinkové karbenoidy je možné připravit z odpovídajících ketonů či aldehydů podobným mechanismem jako u Clemmensenových redukcí. Takovéto cyklopropanace alkenů mívají střední hodnoty diastereoselektivity i výtěžnosti.[26]
Při cyklopropanacích katalyzovaných rhodiem lze použít i jiné diazosloučeniny než diazokarbonyly;[27] avšak s těmito substráty se ale zpravidla obtížněji nakládá, protože jsou méně stálé než diazokarbonyly; z tohoto důvodu se v organické syntéze nepouřívají často.

Podmínky a provedení[editovat | editovat zdroj]
Obvyklé podmínky[editovat | editovat zdroj]
Diazosloučeniny jsou toxické a výbušné, reakce je tak třeba provádět v digestoři.
Komplexy rhodnatých karboxylatů se snadno připravují a na vzduchu jsou neomezeně stálé. Při reakcích často dochází k dimerizacím karbenů, kterému se dá zabránit pomalým přidáváním diazosloučeniny nebo použitím velkého přebytku alkenu. Reakce se provádějí v inertních atmosférách za nepřítomnosti vody a nejčastějším rozpouštědlem je dichlormethan, rozpouštědlo ale může výrazně ovlivnit enantioselektivitu asymetrických cyklopropanací.[28]
Příklad reakce[9][editovat | editovat zdroj]
Směs styrenu (44,2 g, 424 mmol) a Rh2(S-DOSP)4 (1,58 g, 0,85 mmol) v pentanu (350 ml) byla míchána v argonové atmosféře při −78 °C. Do roztoku byl po 30 minutách přidán methyl-(E)-2-diazo-4-fenyl-3-butenoát (17,2 g, 84,8 mmol) v pentanu (0,12 M) a reakční směs byla dále míchána po 24 hodin. Směs byla ve vakuu zakoncentrována a přečištěna na silikagelu pomocí směsi diethyletheru a petroletheru za vzniku (1S,2S)-methyl-2β-fenyl-1β-[2-(Z)-styryl]cyklopropan-1α-karboxylátu (16,05 g, 68 %).
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Intermolecular metal-catalyzed carbenoid cyclopropanations na anglické Wikipedii.
- ↑ Davies, H. M. L.; Antoulinakis, E. G. Organic Reactions 2001, 57, 1. DOI:10.1002/0471264180.or057.01
- ↑ Burke, S. D.; Grieco, P. A. Organic Reactions 1979, 26, 361
- ↑ Singh, V. K.; Arpita, D.; Sekar, G. Synthesis 1997, 137
- ↑ Doyle, M. P. Accounts of Chemical Research 1986, 19, 348
- ↑ Doyle, M. P.; McKervey, M. A.; Ye, T. Modern Catalytic Methods for Organic Synthesis with Diazo Compounds: From Cyclopropanes to Ylides; Wiley: New York, 1998, pp. 163-220
- ↑ Doyle, M. P. Chemical Reviews 1986, 86, 91.
- ↑ Doyle, M. P.; Griffin, J. H.; Bagheri, V.; Dorow, R. L. Organometallics 1984, 3, 53
- ↑ Davies, H. M. L. Current Organic Chemistry 1998, 2, 463
- ↑ a b Davies, H. M. L.; Bruzinski, P. R.; Lake, D. H.; Kong, N.; Fall, M. J. Journal of the American Chemical Society 1996, 118, 6897
- ↑ Davies, H. M. L.; Huby, N. J. S.; Cantrell, W. R., Jr.; Olive, J. L. Journal of the American Chemical Society 1993, 115, 9468
- ↑ Dave, V.; Warnhoff, E. Organic Reactions 1970, 18, 217
- ↑ Ye, T.; McKervey, M. Chemical Reviews 1994, 94, 1091
- ↑ Maas, G. Topics in Current Chemistry 1987, 137, 75
- ↑ Doyle, M.; Dorow, R.; Buhro, W.; Griffin, J.; Tamblyn, W.; Trudell, M. Organometallics 1984, 3, 44
- ↑ Doyle, M.; Bagheri, V.; Wandless, T.; Harn, N. K.; Brinker, D. A.; Eagle, C.; Loh, K. Journal of the American Chemical Society 1990, 112, 1906
- ↑ Pirrung, M. C.; Zhang, J.; Lackey, K.; Sternbach, D. D.; Brown, F. The Journal of Organic Chemistry 1995, 60, 2112
- ↑ Peace, B. W.; Wulfman, D. S. Synthesis 1973, 137
- ↑ Davies, H. M. L.; Clark, T. J.; Church, L. A. Tetrahedron Letters 1989, 30, 5057
- ↑ Davies, H.; Smith, H.; Korkor, O. Tetrahedron Letters 1987, 28, 1853
- ↑ Doyle, M.; Dorow, R.; Tamblyn, W.; Buhro, W. Tetrahedron Letters 1982, 23, 2261
- ↑ Wenkert, E. In New Trends in Natural Products Chemistry, Studies in Organic Chemistry; Rahman, A., Quesne, P. W., Eds.; Elsevier: Amsterdam, 1986; Vol. 26, pp. 557–563
- ↑ Davies, H. M. L.; Huby, N. J. S. Tetrahedron Lett. 1992, 33, 6935
- ↑ Aratani, T. Pure Applied Chemistry 1985, 57, 1839
- ↑ Leblanc, Y.; Fitzsimmons, B. J.; Adams, J.; Perez, F.; Rokach, J. The Journal of Organic Chemistry 1986, 51, 789
- ↑ Denmark, S. E.; O'Connor, S. P. The Journal of Organic Chemistry 1997, 62, 3390
- ↑ Motherwell, W. B.; Roberts, L. R. Journal of the Chemical Society, Chemical Communications 1992, 1582
- ↑ De Meijere, A.; Schulz, T. J.; Kostikov, R. R.; Graupner, F.; Murr, T.; Bielfeldt, T. Synthesis 1991, 547
- ↑ Doyle, M. P.; Zhou, Q.-L.; Charnsangavej, C.; Longoria, M. A.; McKervey, M. A.; Garcia, C. F. Tetrahedron Letters 1996, 37, 4129