Autoionizace vody
Autoionizace vody (nebo autoprotolýza) je chemická reakce, během níž se dvě molekuly vody přemění na hydroxoniový kation H3O+ a hydroxidový anion OH−:
- 2 H2O (l) ⇌ H3O+ (aq) + OH− (aq)
Voda, i ve velmi čistém stavu, není tvořena pouze souborem molekul H2O. Velmi citlivým přístrojem lze i v čisté vodě naměřit slabou konduktivitu 0,055 µS·cm−1. Podle Arrheniovy teorie to musí být způsobeno přítomností iontů.
Koncentrace a frekvence
[editovat | editovat zdroj]Rovnovážná konstanta této reakce je:
Z toho plyne, že konstanta kyselosti je: [1]
Pro reakce ve vodě (nebo zředěných vodných roztocích) je molární koncentrace vody, [H2O], prakticky konstantní a konvenčně se odstraňuje ze vztahu pro konstantu kyselosti vody. Tím získáme rovnovážnou konstantu, která se nazývá konstanta autoprotolýzy vody nebo iontový součin vody a je označena Kw:
- Kw = Ka [H2O] = Keq[H2O]2 = [H3O+][OH−],
kde
- [H3O+] – molární koncentrace hydroxoniových iontů
- [OH−] – molární koncentrace hydroxidových iontů
Za standardních podmínek je Kw = 10−14 Čistá voda poskytuje ekvimolární množství ([H3O+]=[OH−]) obou iontů, tzn. že koncentrace jednotlivých iontů je 10−7: náhodně vybraná molekula bude disociovat během 10 hodin.[2] Protože koncentrace vody je disociací prakticky neovlivněná a je rovna přibližně 56 mol·dm−3, můžeme odvodit, že na každých 5,6×108 molekul vody připadá jeden pár iontů. Každý roztok, který obsahuje stejnou koncentraci obou iontů se označuje jako neutrální. Absolutně čistá voda je neutrální, ale i stopy nečistot mohou posunout rovnováhu mezi ionty. Hodnota Kw je citlivá jak k teplotě, tak i k tlaku a zvyšuje se s nárůstem obou veličin.
Závislost na teplotě a tlaku
[editovat | editovat zdroj]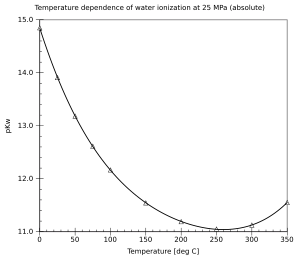
Podle definice je
- pKw = −log Kw
a za standardních podmínek je
- pKw = −log (1,0×10−14) = 14,0
Hodnota pKw je teplotně závislá, s narůstající teplotou její hodnota klesá. To znamená, že ionizace vody narůstá se zvyšující se teplotou.
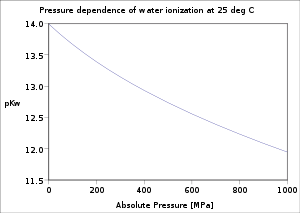
Existuje také tlaková závislost, ionizace vody vzrůstá společně s tlakem, efekt je ale menší než u teploty. Vliv teploty a tlaku na ionizaci vody byl podrobně zkoumán.[3]
pH
[editovat | editovat zdroj]pH je logaritmická stupnice pro kyselost. Je definováno vztahem:
- pH = −log [H3O+]
Protože platí [H3O+] = [OH−], je v neutrálních roztocích za standardních podmínek pH = 7.
Autoionizace vody je proces, který určuje pH vody. Za standardních podmínek je koncentrace hydroxoniových iontů přibližně 1,0×10−7, takže pH čisté vody při této teplotě je sedm. Hodnota Kw narůstá s teplotou, takže v horké vodě bude koncentrace hydroxoniových iontů vyšší než ve studené, ale to neznamená, že se zvyšuje i kyselost vody. Koncentrace hydroxidových iontů se totiž zvyšuje stejným způsobem.
Mechanismus
[editovat | editovat zdroj]Geissler a kolektiv zjistil, že fluktuace elektrického pole v kapalné vodě způsobují disociaci molekul.[4] Předpokládali následující posloupnost událostí, které se odehrají přibližně během 150 fs:
- Systém je v neutrálním stavu.
- Náhodná fluktuace v molekulárním pohybu občas (přibližně jednou za deset hodin na každou molekulu vody) vytvoří elektrické pole, které je dostatečně silné na rozbití vazby mezi kyslíkem a vodíkem, čímž vznikne hydroxidový anion (OH−) a hydroxoniový kation (H3O+).
- Proton z hydroxoniového kationtu putuje přes molekuly vody Grotthussovým mechanismem.
- Vytvoří síť vodíkových vazeb v rozpouštědle, která stabilizuje oba ionty solvatací.
Následná reorganizace sítě vodíkových vazeb umožňuje velmi rychlý (1 ps) transfer protonu k nižšímu elektrickému potenciálu a rekombinaci iontů. Tato časová škála odpovídá času, který potřebují vodíkové vazby ve vodě ke změně orientace.[5][6][7]
Izotopové efekty
[editovat | editovat zdroj]Těžká voda, D2O, je autoionizovaná méně, než obyčejná voda (H2O). Kyslík vytváří s deuteriem trochu silnější vazbu než s obyčejným vodíkem. Důvodem je jeho vyšší hmotnost, která způsobuje nižší energii nulového bodu. V následující tabulce jsou srovnány hodnoty pKw pro H2O a D2O.[8]
| T (°C) | H2O | D2O |
|---|---|---|
| 10 | 14,5346 | 15,439 |
| 20 | 14,1669 | 15,049 |
| 25 | 13,9965 | 14,869 |
| 30 | 13,8330 | 14,699 |
| 40 | 13,5348 | 14,385 |
| 50 | 13,2617 | 14,103 |
Související články
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Self-ionization of water na anglické Wikipedii.
- ↑ McMurry, John. (2004) Organic Chemistry, pg 44
- ↑ Eigen, M.; de Maeyer, L. Untersuchungen über die Kinetik der Neutralisation I. Z. Elektrochem.. 1955, roč. 59, s. 986.
- ↑ International Association for the Properties of Water and Steam (IAPWS)
- ↑ Geissler, P. L.; Dellago, C.; Chandler, D.; Hutter, J.; Parrinello, M. Autoionization in liquid water. Science. 2001, roč. 291, s. 2121–2124. DOI 10.1126/science.1056991. PMID 11251111.
- ↑ Stillinger, F. H. Theory and Molecular Models for Water. Adv. Chem. Phys.. 1975, roč. 31, s. 1. DOI 10.1002/9780470143834.ch1.
- ↑ Rapaport, D. C. Hydrogen bonds in water. Mol. Phys.. 1983, roč. 50, s. 1151. DOI 10.1080/00268978300102931.
- ↑ Chen, S.-H. & Teixeira, J. Structure and Dynamics of Low-Temperature Water as Studied by Scattering Techniques. Adv. Chem. Phys. 1986, roč. 64, s. 1. DOI 10.1002/9780470142882.ch1.
- ↑ Lide, D. R. (Ed.). CRC Handbook of Chemistry and Physics (70th Edn.). [s.l.]: Boca Raton (FL):CRC Press, 1990.
Literatura
[editovat | editovat zdroj]- Klikorka J., Hájek B., Votinský J., Obecná a anorganická chemie, 2. vydání, Praha 1989

![{\displaystyle K_{eq}={\frac {([H_{3}O^{+}][OH^{-}])}{[H_{2}O]^{2}}}=3{,}23\times 10^{-18}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/642ab194b5afac8345bbff0539271595d8c6da39)
![{\displaystyle K_{a}=K_{eq}\times [H_{2}O]={\frac {([H_{3}O^{+}][OH^{-}])}{[H_{2}O]}}=1{,}8\times 10^{-16}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e02daf4342b13ad5d0fedfac1b8a8b6b7b44176)