Fenylpropanoidy



Fenylpropanoidy jsou skupinou organických sloučenin vytvářených rostlinami z aminokyselin fenylalaninu a tyrosinu.[1]
Název je odvozen od šestiuhlíkaté fenylvé skupiny a tříuhlíkatého propenového řetězce kyseliny kumarové, která je meziproduktem biosyntézy fenylpropanoidů. Z 4-kumaroyl-CoA vzniká mnoho různých produktů, například monolignoly (prekurzory ligninů a lignocelulózy), flavonoidy, izoflavonoidy, kumariny, aurony, stilbeny, katechiny a fenylpropanoidy.[2] Kumaroylová skupina pochází z kyseliny skořicové.
Fenylpropanoidy se vyskytují v řadě různých rostlin, kde slouží jako součásti strukturních polymerů, zajišťují ochranu proti ultrafialovému záření a býložravcům a řídí interakce mezi rostlinami a opylovači, například jako součásti pigmentů.
Hydroxyskořicové kyseliny
[editovat | editovat zdroj]
Při syntéze hydroxyskořicových kyselin je nejprve fenylalanin přeměněn na kyselinu skořicovou působením enzymu fenylalanin-amoniaklyázy. Některé rostliny, nejčastěji jednoděložné, používají tyrosin na syntézu kyseliny p-kumarové pomocí bifunkčního enzymu fenylalanin/tyrosin-amoniaklyázy. Sérií enzymatických hydroxylací a methylací se tvoří kyselina kumarová, kyselina kávová, kyselina ferulová, kyselina 5-hydroxyferulová a kyselina sinapová. Přeměnami těchto kyselin na odpovídající estery vznikají některé těkavé složky rostlinných vůní, které mají řadu různých funkcí, například lákají opylovače; příkladem takové sloučeniny je ethylcinnamát.
Skořicové aldehydy a monolignoly
[editovat | editovat zdroj]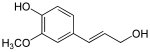
Redukcí karboxylových skupin skořicových kyselin vznikají příslušné aldehydy, jako je cinnamaldehyd. Další redukcí se tvoří monolignoly, například kumarylalkohol, koniferylalkohol a sinapylalkohol, jež se liší pouze v počtu methoxy skupin. Monolignoly slouží jako monomery při syntéze ligninů a suberinů, které se uplatňují jako složky buněčných stěn.

Fenylpropeny, jako jsou eugenol, chavikol, safrol a estragol, jsou také odvozeny od monolignolů. Tyto sloučeniny jsou součástmi řady silic.
Kumariny a flavonoidy
[editovat | editovat zdroj]
Hydroxylací kyseliny skořicové na pozici 4- působením trans-cinamát 4-monooxygenázy vzniká kyselina p-kumarová, která může být dále přeměněna na hydroxylované deriváty, jako je umbeliferon. Kyselina p-kumarová také vytváří thioester s koenzymem A (4-kumaroyl-CoA), který se účastní tvorby chalkonů adicí tří molekul malonyl-CoA a jejich cyklizací za vzniku druhé fenylové skupiny. Chalkony jsou prekurzory flavonoidů.
Stilbenoidy
[editovat | editovat zdroj]
Stilbenoidy, jako například resveratrol, jsou hydroxylované deriváty stilbenu. Vznikají alternativní cyklizací cinamoyl-CoA nebo 4-kumaroyl-CoA.
Sporopolenin
[editovat | editovat zdroj]Fenylpropanoidy a jiné přírodní fenolické sloučeniny jsou součástmi složení sporopoleninu, látky podobné kutinu a suberinu.[2] Tyto látky obsažené v pylu jsou neobvykle odolné vůči rozkladu. Jejich analýzami byly odhaleny směsi biopolymerů, obsahující převážně hydroxylované mastné kyseliny, fenylpropanoidy, fenoly a stopy karotenoidů. Další výzkum vedl ke zjištění, že hlavním prekurzorem je fenylalanin, ovšem do procesu se rovněž zapojují i další zdroje uhlíku. Sporopolenin pravděpodobně vzniká z několika prekurzorů, které dohromady vytvářejí pevnou strukturu.
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Fenylpropanoidy na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fenylpropanoidy na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Phenylpropanoid na anglické Wikipedii.
- ↑ J. Barros; J. C. Serrani-Yarce; F. Chen; D. Baxter; B. J. Venables; R. A. Dixon. Role of bifunctional ammonia-lyase in grass cell wall biosynthesis. Nature Plants. 2016, s. 16050. DOI 10.1038/nplants.2016.50. PMID 27255834.
- ↑ a b T. Vogt. Phenylpropanoid Biosynthesis. Molecular Plant. 2016, s. 16050. DOI 10.1038/nplants.2016.50. PMID 20035037.
