Dekarbonylace
Dekarbonylace jsou organické reakce, při kterých se z molekul odděluje oxid uhelnatý (CO). Často jde o nežádoucí reakce, protože způsobují rozklad. U karbonylů kovů se jedná o substituční reakce, kdy jsou CO ligandy nahrazovány jinými.
V organické chemii
[editovat | editovat zdroj]Dekarbonylace za nepřítomnosti kovových katalyzátorů jsou, na rozdíl od dekarboxylací, vzácné. Výjimkou je dekarbonylace kyseliny mravenčí:
- HCO2H → CO + H2O
Reakci spouští kyselina sírová, která slouží jako katalyzátor a dehydratační činidlo. Prostřednictvím této reakce se kyselina mravenčí občas používá v laboratořích jako zdroj CO.[1] Po zahřátí na vysoké teploty se kyselina mravenčí a některé její deriváty mohou dekarbonylovat samovolně, a to i bez katalyzátoru; například dimethylformamid se po zahřátí na teplotu varu (154 °C) rozkládá na oxid uhelnatý a dimethylamin. Některé deriváty kyseliny mravenčí, například formylchlorid, se samovolně rozkládají i za pokojové (či nižší) teploty.
Reakce, kterých se účastní oxalylchlorid (COCl)2, jako jsou některé hydrolýzy, reakce s karboxylovými kyselinami či Swernovy oxidace, často během rozkladu meziproduktů vytvářejí oxid uhelnatý, společně s oxidem uhličitým.
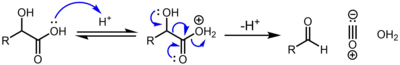
Alfa-hydroxykyseliny, například mléčná a glykolová, se mohou dekarbonylovat koncentrovanou kyselinou sírovou:[2]
Silakarboxylové kyseliny (R3SiCOOH) lze dekarboxylovat zahřátím nebo působením zásady; tyto sloučeniny jsou zkoumány jako zdroje oxidu uhelnatého.[3][4]
Dekarbonylace aldehydů
[editovat | editovat zdroj]Aldehydy lze dekarbonylačními reakcemi převést na alkany.[5]
- RCHO → RH + CO
Dekarbonylace mohou být katalyzovány rozpustnými komplexy kovů;[6][5] jako příklad lze uvést Cudžiovu–Wilkinsonovu dekarbonylaci pomocí Wilkinsonova katalyzátoru. Tato reakce bývá často součástí totálních syntéz přírodních látek, protože při použití stechiometrického množství rhodia probíhá dobře za mírně zvýšených teplot; obnovení katalyzátoru odštěpením CO vyžaduje disociaci stabilního karbonylu rhodia a teploty přes 200 °C. Tato přeměna je cenná v organické syntéze, kde jsou dekarbonylace jinak vzácné.

Dekarbonylace mají využití při přeměnách sacharidů.[7]
Ketony jsou vůči dekarbonylacím odolnější než aldehydy.
Pericyklické reakce
[editovat | editovat zdroj]Některé cyklické ketony vstupují do cheletropních reakcí, při kterých vznikají nové vazby pí mezi atomy uhlíku. Tyto reakce mohou být, například u přípravy hexafenylbenzenu, samovolné. Cyklopropenony lze přeměnit na alkyny odštěpením jednoho a cyklobutendiony odštěpením dvou ekvivalentů CO.[8]
Biochemie
[editovat | editovat zdroj]Při rozkladu hemu působením O2, NADPH a enzymu hemoxygenázy se uvolňuje oxid uhelnatý:[9]
- 2 Hem b + 6 O2 + 7 NADPH + 7 H+ → 2 biliverdin + 2 Fe2+ + 2 CO + 7 NADP+ + 6 H2O
Anorganické a organokovové syntézy
[editovat | editovat zdroj]Mnohé karbonylové komplexy se připravují dekarbonylacemi, například CO ligand Vaskova komplexu vzniká po dekarbonylaci dimethylformamidu:
- IrCl3(H2O)3 + 3 P(C6H5)3 + HCON(CH3)2 + C6H5NH2 → IrCl(CO)[P(C6H5)3]2 + [(CH3)2NH2]Cl + OP(C6H5)3 + [C6H5NH3]Cl + 2 H2O
Přeměny Fe(CO)5 a Mo(CO)6 na jejich deriváty také často probíhají dekarbonylačně, příkladem může být příprava dimeru dikarbonylucyklopentadienyliželeza:
- 2 Fe(CO)5 + C10H12 → (η5-C5H5)2Fe2(CO)4 + 6 CO + H2
Dekarbonylace mohou být spouštěny fotochemicky, případně i vhodnými činidly, jako je trimethylamin-N-oxid:
- Me3NO + L + Fe(CO)5 → Me3N + CO2 + LFe(CO)4
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Decarbonylation na anglické Wikipedii.
- ↑ KOCH, H.; HAAF, W. 1-Adamantanecarboxylic Acid. Org. Synth.. 1973. Dostupné online.; Coll. Vol.. S. 20.
- ↑ Richard Oswald Chandler Norman; James Morriss Coxon. Principles of organic synthesis. London: Blackie Academic & Professional, 1993. Dostupné online. ISBN 0751401269. S. 709.
- ↑ A. G. Brook; Henry Gilman. Base-catalyzed Elimination Reactions of Triphenylsilanecarboxylic Acid and its Derivatives. Journal of the American Chemical Society. 1955, s. 2322–2325. ISSN 0002-7863. DOI 10.1021/ja01613a088.
- ↑ Stig D. Friis; Rolf H. Taaning; Anders T. Lindhardt; Troels Skrydstrup. Silacarboxylic Acids as Efficient Carbon Monoxide Releasing Molecules: Synthesis and Application in Palladium-Catalyzed Carbonylation Reactions. Journal of the American Chemical Society. 2011-11-16, s. 18114-18117. ISSN 0002-7863. DOI 10.1021/ja208652n. PMID 22014278.
- ↑ a b Kreis, M.; Palmelund, A.; Bunch, L.; Madsen, R., A General and Convenient Method for the Rhodium-Catalyzed Decarbonylation of Aldehydes, Advanced Synthesis & Catalysis 2006, 348, 2148-2154 DOI:10.1002/adsc.200600228
- ↑ Hartwig, J. F. Organotransition Metal Chemistry, from Bonding to Catalysis; University Science Books: New York, 2010
- ↑ Geilen, F. M. A.; vom Stein, T.; Engendahl, B.; Winterle, S.; Liauw, M. A.; Klankermayer, J.; Leitner, W., Highly Selective Decarbonylation of 5-(Hydroxymethyl)Furfural in the Presence of Compressed Carbon Dioxide, Angewandte Chemie International Edition 2011, 50, 6831-6834 DOI:10.1002/anie.201007582
- ↑ Yves Rubin; Carolyn B. Knobler; Francois Diederich. Precursors to the cyclo[n]carbons: from 3,4-dialkynyl-3-cyclobutene-1,2-diones and 3,4-dialkynyl-3-cyclobutene-1,2-diols to cyclobutenodehydroannulenes and higher oxides of carbon. Journal of the American Chemical Society. 1990, s. 1607–1617. ISSN 0002-7863. DOI 10.1021/ja00160a047.
- ↑ Ryter, S. W.; Tyrrell, R. M., The Heme Synthesis and Degradation Pathways: Role in Oxidant Sensitivity: Heme Oxygenase Has Both Pro- and Antioxidant Properties, Free Radical Biology and Medicine 2000, volume 28, pages 289-309 DOI:10.1016/S0891-5849(99)00223-3

