2,2,2-trifluorethanol
| 2,2,2-trifluorethanol | |
|---|---|
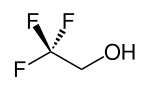 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 2,2,2-trifluorethan-1-ol |
| Ostatní názvy | trifluorethylalkohol, TFE |
| Sumární vzorec | C2H3F3O |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 75-89-8 |
| PubChem | 70297 |
| ChEBI | 42330 |
| SMILES | ClC1=CC(C(OO)=O)=CC=C1 |
| InChI | InChI=1/C2H3F3O/c3-2(4,5)1-6/h6H,1H2 |
| Vlastnosti | |
| Molární hmotnost | 100,04 g/mol |
| Teplota tání | −43,5 °C (229,6 K) |
| Teplota varu | 74,0 °C (347,2 K) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R10 R20/21/22 R36/38 R62 |
| S-věty | S16 S36/37/39 S45 |
Některá data mohou pocházet z datové položky. | |
2,2,2-Trifluorethanol (zkráceně TFE) je organická sloučenina se vzorcem CF3CH2OH. Díky zápornému indukčnímu efektu způsobovanému atomy fluoru, který má vyšší elektronegativitu než uhlík, je silnější kyselinou než ethanol. Díky vodíkovým vazbám vytváří stabilní komplexy i s heterocyklickými sloučeninami.
Výroba
[editovat | editovat zdroj]Průmyslově se 2,2,2-trifluorethanol vyrábí hydrogenací nebo redukcí hydridy z derivátů kyseliny trifluoroctové jako jsou estery nebo acylchloridy.[2]
Také jej lze získat hydrogenolýzou sloučenin s obecným vzorcem CF3−CHOH−OR (kde R je vodík nebo alkylová skupina s jedním až osmi atomy uhlíku) za přítomnosti katalyzátoru obsahujícího palladium uloženého na aktivním uhlí. Jako kokatalyzátor se často používají terciární alifatické aminy, například triethylamin.
Použití
[editovat | editovat zdroj]2,2,2-Trifluorethanol se používá v organické chemii jako rozpouštědlo.[3][4] Lze v něm účinně provádět oxidace sirných sloučenin peroxidem vodíku.[5]
TFE rovněž slouží k denaturaci bílkovin.
Průmyslově se využívá jako rozpouštědlo nylonu a také ve farmacii.
Trifluorethanol je důležitým prekurzorem inhalačního anestetika isofluranu.
TFE se též používá v biochemii jako inhibitor při výzkumu enzymů, jelikož kompetitivně inhibuje například alkoholdehydrogenázu.[6]
Reakce
[editovat | editovat zdroj]Oxidací trifluorethanolu vzniká trifluoracetaldehyd a následně kyselina trifluoroctová. TFE Může být také zdrojem trifluormethylové skupiny v mnoha různých chemických reakcích.
Fluroxen, inhalační léčivo využívané pod obchodním názvem Fluoromar, je vinyletherem trifluorethanolu, připravuje se reakcí TFE s ethynem.[2]
Bezpečnost
[editovat | editovat zdroj]Trifluorethanol je toxický pro krev, rozmnožovací soustavu, močový měchýř, mozek, horní cesty dýchací a oči.[7]
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu 2,2,2-trifluorethanol na Wikimedia Commons
Obrázky, zvuky či videa k tématu 2,2,2-trifluorethanol na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku 2,2,2-Trifluoroethanol na anglické Wikipedii.
- ↑ a b 2,2,2-Trifluoroethanol. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b Günter Siegemund, Werner Schwertfeger, Andrew Feiring, Bruce Smart, Fred Behr, Herward Vogel, Blaine McKusick “Fluorine Compounds, Organic” Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, 2007.
- ↑ J.-P. Bégué; D. Bonnet-Delpon; B. Crousse. Fluorinated Alcohols: A New Medium for Selective and Clean Reaction. Synlett. 2004, s. 18–29. (anglicky)
- ↑ Ivan A. Shuklov; Natalia V. Dubrovina; Armin Börner. Fluorinated Alcohols as Solvents, Cosolvents and Additives in Homogeneous Catalysis. Synthesis. 2007, s. 2925–2943. (anglicky)
- ↑ Kabayadi S. Ravikumar; Venkitasamy Kesavan; Benoit Crousse; Danièle Bonnet-Delpon; Jean-Pierre Bégué. Mild and Selective Oxidation of Sulfur Compounds in Trifluorethanol: Diphenyl Disulfide and Methyle Phenyl Sulfoxide. Organic Syntheses. 2003, s. 184. (anglicky)
- ↑ Richard L. Taber. Wiley Online Library. Biochemical Education. 1998, s. 239–242. (anglicky)
- ↑ Sciencelab MSDS. www.sciencelab.com [online]. [cit. 2019-02-21]. Dostupné v archivu pořízeném dne 2016-03-03.





