β-Butyrolakton
| β-Butyrolakton | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | 4-methyloxetan-2-on |
| Ostatní názvy | beta-butyrolakton |
| Sumární vzorec | C4H6O2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 3068-88-0 |
| EC-no (EINECS/ELINCS/NLP) | 221-330-3 |
| PubChem | 18303 |
| SMILES | CC1CC(=O)O1 |
| InChI | InChI=1/C4H6O2/c1-3-2-4(5)6-3/h3H,2H2,1H3 |
| Vlastnosti | |
| Molární hmotnost | 86,089 g/mol |
| Teplota tání | −43,5 °C (229,6 K)[1] |
| Teplota varu | 71 až 73 °C (344 až 346 K)[1] |
| Hustota | 1,0555 g/cm3 (20 °C)[1] |
| Rozpustnost ve vodě | >10 g/100 ml (23 °C)[1] |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H226 H315 H319 H351[1] |
| P-věty | P201 P202 P210 P233 P240 P241 P242 P243 P264 P280 P281 P302+352 P303+361+353 P305+351+338 P308+313 P321 P332+313 P337+313 P362 P370+378 P403+235 P405 P501[1] |
| Teplota vzplanutí | 60 °C[1] |
Některá data mohou pocházet z datové položky. | |
β-Butyrolakton je organická sloučenina, lakton odvozený od kyseliny beta-hydroxymáselné. Při jeho výrobě vzniká racemická směs. Používá se jako monomer biologicky rozložitelného plastu poly(3-hydroxybutyrát)u (PHB). Polymerizací racemického (RS)-β-butyrolaktonu vzniká polymer kyseliny (RS)-hydroxymáselné, který má ovšem horší vlastnosti (například odolnost vůči rozpadu) než přírodní (R)-poly-3-hydroxybutyrát.[2]
Výroba
[editovat | editovat zdroj]β-Butyrolakton se, s 63% výtěžností, vyrábí adicí acetaldehydu na ethenon (za přítomnosti minerálu montmorillonitu.[3]

Potřebný ethenon lze získat dehydrobromací acetylbromidu diisopropylethylaminem. Ethenon reaguje za přítomnosti chirálního komplexu hliníku enantioselektivně za tvorby (S)-β-butyrolaktonu s výtěžností 92 % a enantiomerním přebytkem nad 98 %.[4]

Hydrogenací diketenu za přítomnosti kontaktního palladiového katalyzátoru vzniká β-butyrolakton při výtěžnosti 93 %.[5]

Asymetrickou hydrogenací diketenu pomocí ruthenium-BINAPového katalyzátoru se tvoří opticky aktivní (R)-β-butyrolakton s účinností 97 % a 92% enantiomerním přebytkem.[6]
Při teplotě 50 °C a tlaku CO okolo 6 MPa se (R)-2-methyloxiran karbonyluje na (R)-β-butyrolakton, přičemž konfigurace zůstává zachována z 95 %,[7] je-li jako katalyzátor použit [(salph)Al(THF)2][Co(CO)4][8] (který lze připravit z komplexu [(salph)AlCl a tetrakobaltnanu sodného Na[Co(CO)4]).

Karbonylací 2-methyloxiranu za přítomnosti homogenních porfyrin-karbonylkobaltnanových katalyzátorů v tetrahydrofuranu při tlakuoxidu uhelnatého 1,4 MPa se tvoří β-butyrolakton s výtěžností 97 %.[9]
Kvůli obtížím při oddělování a recyklaci homogenních katalyzátorů byly zkoumány také jejich heterogenní polymerní analogy, při jejich použití se dosahuje podobné výtěžnosti (až 96 %) za tlaku CO 6 MPa. Tyto katalyzátory ovšem nejsou vhodné pro průmyslové využití, protože mají mnohem nižší katalytickou aktivitu.[10]
Butan-1,3-diol je možné pomocí manganistanu barnatého (BaMnO4) jako oxidačního činidla v acetonitrilu za působení mikrovlnného záření během jedné hodiny přeměnit na β-butyrolakton s účinností 74 %.[11]

Použití
[editovat | editovat zdroj](R)-β-Butyrolakton reaguje v toluenu s oxidem uhelnatým o tlaku 1,4 MPa a teplotě 55 °C za přítomnosti salenového komplexu po 24 h za vzniku opticky čistého (enantiomerní přebytek nad 99 %) (S)-methylsukcinanhydridu s výtěžností 94 %.[12]

Homo- a kopolymery získávané z β-butyrolaktonu
[editovat | editovat zdroj]Výroba kyseliny polyhydroxymáselné (PHB) a homo- a kopolymerních polyhydroxyalkanoátových aerobně biologicky rozložitelných termoplastů zahájená v roce 1983 odstartovala hledání syntetických materiálů, u kterých by se neprojevovaly nedostatky PHB, jako jsou křehkost a tuhost, rozklad již mírně nad teplotami tání (175 až 180 °C) a příliš vysoké náklady[13] v důsledku fermentace, izolace a přečišťování.
Polymerizací s otevíráním kruhu (S)-β-butyrolaktonu pomocí diethylzinku (ZnEt2) se tvoří poly-(S)-3-hydroxybutyrát s enantiomerním přebytkem nad 97 % při zachování konfigurace na chirálním uhlíku:[14]

Pomocí katalyzátorů ze sloučenin cínu nazývaných distannoxany lze polymerizací (R)-β-butyrolaktonu získat syntetické (R)-polyhydroxybutyráty (Mn > 100 000) se zachováním konfigurace, podobné přírodním polyhydroxyalkanoátům.[15] Aniontovou polymerizací opticky aktivního β-butyrolaktonu vznikají krystalické izotaktické polyhydroxybutyráty s obrácenou konfigurací, které mají nízkou nízká polydisperzitu ( Mw/Mn ≈ 1,2).[16][17]

Silnými zásadami, jako jsou diazabicykloundecen (DBU), 1,5,7-triazabicyklo(4.4.0)dec-5-en (TBD) a fosfazen BEMP, je možné katalyzovat polymerizaci β-butyrolaktonu s otevíráním kruhu při 60 °C za vzniků PHB s nízkými molekulovými hmotnostmi (Mn < 21 000) a jejich užším rozdělením.[18]
Kationtová polymerizace β-butyrolaktonu silnými kyselinami, například kyselinou trifluormethansulfonovou, vede ke vzniku produktů s nižšími molekulovými hmotnostmi (Mn < 8 200) s hydroxylovými skupinami na koncích řetězců, které umožňují kopolymerizaci například s kaprolaktonem.[19]

Pomocí yttriových katalyzátorů je možné přeměnit racemický β-butyrolakton na (převážně) syndiotaktický PHB s úzkým rozdělením molekulových hmotností.[20][21]
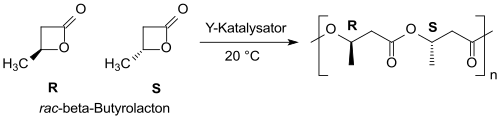
N-heterocyklické karbeny odvozené od imidazol-2-ylidenu jsou silné nukleofily a také vhodné jako iniciátory polymerizace laktonů, jako je β-butyrolakton.[22]

Syntetické PHB, které byly vyvinuté jako homopolymery β-butyrolaktonu nebo jeho kopolymery s ostatními laktony, nemají tak dobré vlastnosti jako biogenní varianty, obzvláště co se týče mechanických a tepelných vlastností a nákladnosti; místo toho se u nich objevují potíže s toxicitou kovů (například cínu, kobaltu či chromu) obsažených v katalyzátorech a atakticitou produktů , které jsou kapalné a obtížně se oddělují.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku β-Butyrolactone na anglické Wikipedii.
- ↑ a b c d e f g h i j beta-Butyrolactone. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ H. Abe; I. Matsubara; Y. Doi. Physical properties and enzymatic degradability of poly(3-hydroxybutyrate) stereoisomers with different stereoregularities. Macromolecules. 1994, s. 6018–6025. DOI 10.1021/ma00099a013.
- ↑ US2580714A Production of beta-hydroxy carboxylic acid lactones from ketene and aldehyde with clay catalyst [online]. 1952-01-01 [cit. 2024-09-24]. Dostupné online.
- ↑ S. G. Nelson; W. S. Cheung; A. J. Kassick. A de novo enantioselective total synthesis of (-)-laulimalide. Journal of the American Chemical Society. 2002, s. 13 654 – 13 655. DOI 10.1021/ja028019k. PMID 12431077.
- ↑ US2763664A [online]. 1956-09-18 [cit. 2024-09-24]. Dostupné online.
- ↑ T. Ohta; T. Miyake; H. Takaya. An efficient synthesis of optically active 4-methyloxetan-2-one: asymmetric hydrogenation of diketene catalysed by binap–ruthenium(II) complexes [binap = 2,2′-bis(diphenylphosphino)-1,1′-binaphthyl]. ChemComm. 1992, s. 1725–1726. DOI 10.1039/C39920001725.
- ↑ Y. D. Y. L. Getzler; V. Mahadevan; E. B. Lobkovsky. Synthesis of β-lactones: a highly active and selective catalyst for epoxide carbonylation. Journal of the American Chemical Society. 2002, s. 1174–1175. DOI 10.1021/ja017434u. PMID 11841278.
- ↑ Catalysts for Carbonylation [online]. Sigma Aldrich, 2007 [cit. 2018-12-20]. Dostupné online.
- ↑ US2012123137A1 PROCESS FOR BETA-LACTONE PRODUCTION [online]. 2012-05-17 [cit. 2024-09-24]. Dostupné online.
- ↑ J. Jiang; S. Yoon. A metalated porous porphyrin polymer with [Co(CO)4]− anion as an efficient heterogeneous catalyst for ring expanding carbonylation. Scientific Reports. 2018. DOI 10.1038/s41598-018-31475-6. PMID 30185794.
- ↑ M. C. Bagley; Z. Lin; D. J. Phillips; A. E. Graham. Barium manganate in microwave-assisted oxidation reactions: synthesis of lactones by oxidative cyclization reactions. Tetrahedron Letters. 2009, s. 6823–6825. DOI 10.1016/j.tetlet.2009.09.117.
- ↑ Y. D. Y. L. Getzler; V. Kundnani; E. B. Lobkovsky; G. W. Coates. Catalytic carbonylation of β-lactones to succinic anhydrides. ournal of the American Chemical Society. 2004, s. 6842–6843. DOI 10.1021/ja048946m. PMID 15174834.
- ↑ ICI reduces cost, ups capacity for Biopol [online]. ICIS, 1991-09-22 [cit. 2018-12-20]. Dostupné online.
- ↑ Y. Zhang; R. A. Gross. Stereochemistry of the ring-opening polymerization of (S)-β-butyrolactone. Macromolecules. 1990, s. 3206–3212. DOI 10.1021/ma00215a002.
- ↑ Y. Hori; M. Suzuki; A. Yamaguchi; T. Nishishita. Ring-opening polymerization of optically active β-butyrolactone using distannoxane catalysts: Synthesis of high molecular weight poly(3-hydroxybutyrate). Macromolecules. 1993, s. 5533–5534. DOI 10.1021/ma00072a037.
- ↑ Z. Jedlinski. First facile synthesis of biomimetic poly (R)-3-hydroxybutyrate via regioselective anionic polymerization of (S)-β-butyrolactone. Macromolecules. 1998, s. 6718–6720. DOI 10.1021/ma980663p.
- ↑ R. Kurcak; M. Smiga; Z. Jedlinski. β-Butyrolactone polymerization initiated with tetrabutylammonium carboxylates: a novel approach to biomimetic polyester synthesis. Journal of Polymer Science. 2002, s. 2184–2189. DOI 10.1021/ma980663p.
- ↑ C. G. Jaffredo; J.-F. Carpentier; S. M. Guillaume. Controlled ROP of β-butyrolactone simply mediated by amidine, guanidine, and phophazene organocatalysts. Macromol. Rapid Comun.. 2012, s. 1938–1944. DOI 10.1002/marc.201200410. PMID 22887774.
- ↑ A. Couffin; B. Martin-Vaca; D. Bourissou; C. Navarro. Selective O-acyl ring-opening of β-butyrolactone catalyzed by trifluoromethane sulfonic acid: application to the preparation of well-defined block copolymers. Polymer Chemistry. 2014, s. 161–168. DOI 10.1039/C3PY00935A.
- ↑ A. Amgoune; C. M. Thomas; S. Illinca; T. Roisnel; J.-F. Carpentier. Highly active, productive, and syndiospecific yttrium initiators for the polymerization of racemic β-butyrolactone. Angewandte Chemie International Edition. 2006, s. 2782–2784. DOI 10.1002/anie.200600058. PMID 16548028.
- ↑ J.-F. Carpentier. Discrete metal catalysts for stereoselective ring-opening polymerization of chiral racemic β-lactones. Macromol. Rapid Commun.. 2010, s. 1696–1705. DOI 10.1002/marc.201000114. PMID 21567583.
- ↑ W. N. Ottou; H. Sardon; D. Mecerryes; J. Vignolle; D. Taton. Update and challenges in organo-mediated polymerization reactions. Progress in Polymer Science. 2016, s. 64–115. Dostupné online. DOI 10.1016/j.progpolymsci.2015.12.001.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu β-butyrolakton na Wikimedia Commons
Obrázky, zvuky či videa k tématu β-butyrolakton na Wikimedia Commons



