Transmembránový protein
Transmembránový protein (TP) je integrální membránový protein, který jednou či několikrát zcela překračuje buněčnou membránu a je trvale integrován do její lipidové dvouvrstvy.
Transmembránové proteiny pronikají membránou a jsou k ní trvale a pevně vázané, nejčastěji navázáním na hydrofobní vnitřek fosfolipidové dvouvrstvy. Obvykle jsou vysoce hydrofobní a srážejí se ve vodě. Takové proteiny mohou být odděleny od biologických membrán pouze pomocí detergentů, nepolárních rozpouštědel nebo některých denaturačních činidel.
Tyto proteiny plní zcela zásadní funkce, neboť umožňují membránový transport, tedy přenos různých látek buněčnou membránou. Patří mezi ně například různé receptory, pumpy a kanály.
Vlastnosti[editovat | editovat zdroj]
Transmembránové proteiny jsou amfipatické, to znamená, že část jejich molekuly je hydrofilní a část hydrofobní.
Hydrofobní části jsou právě ty, které prochází fosfolipidovou biomembránou. Hydrofobní částí je nejčastěji alfa-helix nebo beta-barel složený z beta-skládaných listů.[1] K překročení membrány je v případě alfa-helixu potřeba asi 20 aminokyselin. Celkový hydrofobní charakter transmembránových proteinů může být ještě zvýšen navázáním různých mastných kyselin jako postranních řetězců. Hydrofobicita daného úseku proteinu se počítá podle konkrétní sekvence aminokyselin, pokud činí více 20 kcal⋅mol−1, je pravděpodobné, že se jedná o transmembránovou doménu.[2]
Dělení[editovat | editovat zdroj]

Podle struktury[editovat | editovat zdroj]
Transmembránové proteiny jsou rozděleny podle své struktury v dvojvrstvě membrány na:
- integrální bitopické proteiny procházejí přes membránu pouze jednou.
- Integrální polytopické proteiny procházejí přes membránu více než jednou. Tyto proteiny mají jednu ze dvou struktur:
- Alfa-šroubovice (α-helix), které jsou přítomny ve všech typech biologických membrán. U lidí je 27% všech proteinů alfa-šroubovicového tvaru.
- Beta-skládané listy (β-sheet), které často vytvářejí beta-barely. Nacházejí se pouze ve vnějších membránách gramnegativních bakterií a vnějších membránách mitochondrií a chloroplastů.
- Mezi integrální membránové proteiny patří i monotopické proteiny, které však nejsou transmembránovými proteiny, neboť jsou navázané pouze k jedné straně membrány.
Podle topologie[editovat | editovat zdroj]
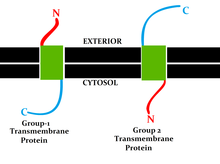
Transmembránové proteiny, především ty bitopické, jsou rozděleny na sedm typů podle polohy proteinu a jeho ukončení na různých stranách lipidové dvojvrstvy:
I. typ – membránou procházejí pouze jednou a C-terminus (C-konec) proteinu je na vnitřní straně membrány. C-terminus je označení pro ten konec polypeptidu nebo proteinu, který končí karboxylovou skupinou –COOH.
II. typ – membránou procházejí pouze jednou a N-terminus (N-konec, také amino-konec) proteinu je na vnitřní straně membrány. N-terminus je označení pro ten konec polypeptidu nebo proteinu, který končí skupinou aminu –NH2.
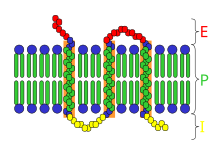
III. typ – membránou procházejí několikrát.
IV. typ – v membráně tvoří transmembránový kanál tvořený několika doménami proteinu.
V. typ – jsou navázané k fosfolipidům membrány, a to pomocí kovalentních vazeb.
VI. typ – zároveň přecházejí membránu a zároveň jsou navázané k fosfolipidům.
Funkce[editovat | editovat zdroj]
Transmembránové proteiny plní řadu funkcí životně důležitých pro přežití organismů.
- Aktivita enzymů - membránové enzymy mohou mít mnoho aktivit, jako je oxidoreduktáza, transferáza nebo hydroláza.
- Signalizace - proteiny membránových receptorů přenášejí signály mezi vnitřním a vnějším prostředím buňky.
- Transport - transportní proteiny přenášejí molekuly a ionty přes membránu.
- Rozpoznávání buněk - molekuly buněčné adheze umožňují buňkám vzájemně se identifikovat a interagovat. Například jsou to proteiny podílející se na imunitní odpovědi
- Ukotvení k cytoskeletu a extracelulární matrici
- Připojení buněk
Reference[editovat | editovat zdroj]
V tomto článku byly použity překlady textů z článků Transmembranprotein na německé Wikipedii a Transmembrane protein na anglické Wikipedii.
- ↑ Alberts, Bruce , et al. The Molecular Biology of the Cell. [s.l.]: Garland Science, 2002. (4th. ed). ISBN 0-8153-3218-1.
- ↑ Robert K. Murray; Daryl K. Granner; Joe C. Davis; Peter A. Mayes; Victor W. Rodwell. Harper’s Illustrated Biochemistry; twenty-sixth edition. [s.l.]: [s.n.], 2003. ISBN 0-07-138901-6.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu transmembránový protein na Wikimedia Commons
Obrázky, zvuky či videa k tématu transmembránový protein na Wikimedia Commons
