Robinsonova anelace
Robinsonova anelace je chemická reakce využívaná v organická syntéze k tvorbě cyklů; objevil ji v roce 1935 Robert Robinson jako metodu tvorby šestičlenných cyklů vytvořením tří nových vazeb C-C.[1] Při této reakci reaguje obecný keton s methylvinylketonem za vzniku α,β nenasyceného cyklického ketonu Michaelovou adicí následovanou aldolovou kondenzací. Jedná se o jeden z hlavních postupů přípravy systémů kondenzovaných cyklů.
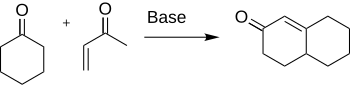
Příprava a výroba cyklohexenonu a jeho derivátů má velký význam pro syntézu řady přírodních produktů a mnoha dalších sloučenin, jako jsou antibiotika a steroidy.[2] Příkladem konkrétní látky, při jejíž výrobě se mimo jiné provádí Robinsonova anelace, může být kortizon.[3]
Robinsonovu anelaci popsali William Rapson a Robert Robinson, když Rapson studoval na Oxfordské univerzitě, kde byl Robinson v té době profesorem. Před touto jejich prací nebyl znám žádný postup přípravy cyklohexenonu z α,β nenasycených ketonů. Nejprve se podařilo provést reakci methylvinylketonu s naftolem za vzniku naftoloxidu, ovšem tento postup nevedl k požadovanému cyklohexenonu, což bylo přičítáno nevhodným podmínkám reakce.[1]
Robinson s Rapsonem roku 1935 zjistili, že cyklohexenon vznikne interakcí cyklohexanonu a α,β nenasyceného ketonu; tento postup je stále jedním z hlavních postupů přípravy sloučenin s šestiuhlíkatými cykly. Díky širokému využívání byly také prozloumány mnohé parametry a varianty této reakce jako například obměny substrátů a reakčních podmínek.[4]
Mechanismus reakce[editovat | editovat zdroj]
Na začátku Robinsonovy anelace je bází odtržen vodík z α-uhlíku cyklohexanonu A, čímž vzniká jeho enolát. Ten vystupuje jako nukleofil při Michaelově adici na konjugovaný keton B. Tento meziprodukt následně podléhá další bazické enolizaci C s následnou intramolekulární aldolizací D. Vzniklý β-hydroxyketon E pak snadno, popřípadě mírným zahřátím poskytuje produkt F tzv. aldolovou kondenzací.

Z důvodu, že je produktem opět konjugovaný keton, může docházet k jeho reakci s dalším enolem. To vede k tomu, že přímá Robinsonova anelace poskytuje zpravidla nízké výtěžky. Tomu lze zabránit izolací aduktů C nebo E s následnou cyklizací a/nebo dehydratací za mírnějších podmínek.[5]
Podmínky reakce[editovat | editovat zdroj]
Přestože Robinsonova anelace probíhá zpravidla za bazické katalýzy, stejného výsledku, lze dosáhnou i přes kysele vytvořený enolát, kdy je katalyzátorem například kyselina sírová.[2] Michaelova reakce může probíhat při neutrálním pH, meziproduktem je poté enamin. Michaelův adukt lze rovněž získat zahříváním Mannichovy zásady za přítomnosti ketonu.[5]
Varianty[editovat | editovat zdroj]
Jako Michaelův akceptor se většinou používá α,β nenasycený keton, ovšem může jím být i aldehyd nebo derivát karboxylové kyseliny; taktéž se dají použít nitrily, nitrosloučeniny, sulfony a některé uhlovodíky.[6]
Wichterlova reakce[editovat | editovat zdroj]
Wichterlova reakce je variantou Robinsonovy anelace, kde se methylvinylketon nahrazuje 1,3-dichlor-cis-2-butenem za účelem zabránění nechtěné polymerizaci či kondenzaci v průběhu Michaelovy adice..[7]

Hauserova anelace[editovat | editovat zdroj]
Při Hauserově anelaci dochází po Michaelově reakci k Dieckmannově kondenzaci a následně k eliminaci; Dieckmannova kondenzace je obdobná vnitromolekulární reakce diesterů se zásadou za tvorby β ketoesterů. Hauserovým donorem je aromatický sulfon nebo methylensulfoxid s karboxylovou skupinou na pozici orto. Hauserův akceptor je stejný jako Michaelův akceptor. V původní Hauserově anelaci reagoval [2-(ethoxykarbonyl)fenyl](fenyl)sulfoxid s pent-3-en-2-onem za přítomnosti diisopropylamidu lithného jako zásady v tetrahydrofuranu při −78 °C.[8]

Asymetrická Robinsonova anelace[editovat | editovat zdroj]
Při asymetrické syntéze produktů Robinsonovy anelace se jako katalyzátor obvykle používá prolin; bylo popsáno využití L-prolinu stejně jako několika dalších chirálních aminů v&nbso;obou fázích Robinsonovy anelace.[9]
Při použití opticky aktivního prolinu jako katalyzátoru je reakce značně stereoselektivní, enantiomerní přebytek dosahuje 60 až 70 %.[10]

Byla popsána příprava chirálních thiochromenů organokatalytickou Robinsonovou anelací.[11]

Využití[editovat | editovat zdroj]
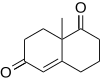
Wielandův–Miescherův keton je produktem Robinsonovy anelační reakce 2-methylcyklohexan-1,3-dionu s methylvinylketonem a používá se při výrobě mnoha steroidů s důležitými vlastnostmi; pomocí prolinových katalyzátorů jej lze získat v enantiomerně čisté formě.[10]
Robinsonova anelace byla též použita k totální syntéze tetracyklického alkaloidu (+)-fawcettiminu, který by bylo možné využít jako inhibitor acetylcholinesterázy.
Enantioselektivní syntéza platensimycinu[editovat | editovat zdroj]

Ve společnosti Merck byla vyvinuta nová látka s potenciálně antibiotickými účinky nazývaná platensimycin (její struktura je na obrázku vpravo).
Při prvních syntézách byla vnitromolekulární etherifikací získávána racemická forma této látky. Později byla popsána alternativní syntéza Robinsonovou anelací, čímž se podařilo dosáhnout enantioselektivní syntézy tetracyklického jádra platensimycinu; jednotlivé dílčí reakce probíhaly v jedné nádobě a jako katalyzátor byl použit L-prolin.[12] Podmínky reakce jsou vyobrazeny na následujícím obrázku:
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Robinson annulation na anglické Wikipedii.
- ↑ a b RAPSON, William Sage; ROBINSON, ROBERT. 307. Experiments on the synthesis of substances related to the sterols. Part II. A new general method for the synthesis of substituted cyclohexenones. Journal of the Chemical Society (Resumed). 1935, s. 1285. DOI 10.1039/JR9350001285.
- ↑ a b HEATHCOCK, Clayton H.; ELLIS, JOHN E.; MCMURRY, JOHN E.; COPPOLINO, ANTHONY. Acid-catalyzed Robinson Annelations. Tetrahedron Letters. 1971, s. 4995–96. DOI 10.1016/s0040-4039(01)97609-9.
- ↑ ACHESON, R. M.; ROBINSON, ROBERT. 198. Experiments bearing on the synthesis of cortisone. Part I. Some cyclopentenone derivatives. Journal of the Chemical Society (Resumed). 1952, s. 1127. DOI 10.1039/JR9520001127.
- ↑ HO, Tse-Lok. Tandem organic reactions. New York: Wiley, 1992. ISBN 0-471-57022-2.
- ↑ a b GAWLEY, Robert E. The Robinson Annelation and Related Reactions. Synthesis. 1976, s. 777–794. DOI 10.1055/s-1976-24200.
- ↑ ADAMS, Roger. Organic Reactions. New York: John Wiley & Sons, Inc., 1959. ISBN 0471007595. S. 179–555.
- ↑ WANG, Zerong. Comprehensive organic name reactions and reagents. Hoboken, N.J.: John Wiley, 2009. Dostupné online. ISBN 978-0-470-63885-9.
- ↑ HAUSER, Frank M.; RHEE, RICHARD P. New synthetic methods for the regioselective annelation of aromatic rings: 1-hydroxy-2,3-disubstituted naphthalenes and 1,4-dihydroxy-2,3-disubstituted naphthalenes. The Journal of Organic Chemistry. 1978, s. 178–180. DOI 10.1021/jo00395a048.
- ↑ EDER, Ulrich; SAUER, GERHARD; WIECHERT, RUDOLF. New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures. Angewandte Chemie International Edition in English. 1971, s. 496–497. DOI 10.1002/anie.197104961.
- ↑ a b BUI, Tommy; BARBAS, CARLOS F. A proline-catalyzed asymmetric Robinson annulation reaction. Tetrahedron Letters. 2000, s. 6951–6954. DOI 10.1016/s0040-4039(00)01180-1.
- ↑ Wang, W.; Li, H.; Wang, J.; Zu, L., J. Am. Chem. Soc. 2006; 128, 10354.
- ↑ LI, Pingfan; PAYETTE, JOSHUA N.; YAMAMOTO, HISASHI. Enantioselective Route to Platensimycin: An Intramolecular Robinson Annulation Approach. Journal of the American Chemical Society. 2007, s. 9534–9535. DOI 10.1021/ja073547n. PMID 17630748.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Robinsonova anelace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Robinsonova anelace na Wikimedia Commons

