Pentamethylcyklopentadien
| Pentamethylcyklopentadien | |
|---|---|
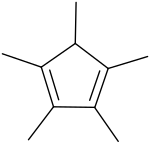 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1,2,3,4,5-pentamethylcyklopenta-1,3-dien |
| Sumární vzorec | C10H16 |
| Identifikace | |
| Registrační číslo CAS | 4045-44-7 |
| EC-no (EINECS/ELINCS/NLP) | 223-743-4 |
| PubChem | 77667 |
| SMILES | CC1C(=C(C(=C1C)C)C)C |
| InChI | 1S/C10H16/c1-6-7(2)9(4)10(5)8(6)3/h6H,1-5H3 |
| Vlastnosti | |
| Molární hmotnost | 136,23 g/mol |
| Teplota varu | 178 až 180 °C (451 až 453 K) |
| Rozpustnost ve vodě | nerozpustný |
| Bezpečnost | |
| [1] | |
| H-věty | H226}[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P280 P303+361+353 P370+378 P403+235 P501[1] |
Některá data mohou pocházet z datové položky. | |
1,2,3,4,5-pentamethylcyklopentadien je organická sloučenina, cyklický dien se vzorcem C5Me5H (Me = CH3).[2]
Pentamethylcyclopentadien slouží jako prekurzor 1,2,3,4,5-pentamethylcyklopentadienylových (Cp* (C5Me5) ligandů. Na rozdíl od méně substituovaných derivátů cyklopentadienu Cp*H nepodléhá dimerizaci.
Příprava a výroba[editovat | editovat zdroj]
Pentamethylcyklopentadien lze zakoupit. Příprava je možná z tiglaldehydu, jako meziprodukt se přitom tvoří 2,3,4,5-tetramethylcyklopent-2-enon.[3]

Další možností je adice 2-butenyllithia na ethylacetát následovaná kysele katalyzovanou dehydrocyklizací:[4][5]


Organokovové deriváty[editovat | editovat zdroj]
Cp*H je prekurzorem oganokovových sloučenin obsahujících C5Me −
5 ligandy, zkráceně označované Cp*−.[6]
| Komplexy Cp* s kovy | |
| Cp*2Fe | žlutý |
| Cp*TiCl3 | červený |
| [Cp*Fe(CO)2]2 | červený |
| [Cp*RhCl2]2 | červený |
| [Cp*IrCl2]2 | oranžový |
| Cp*Re(CO)3 | bezbarvý |
| Cp*Mo(CO)2CH3 | oranžový |
Následující rovnice vyjadřují příklady reakcí vedoucích ke vzniku takových komplexů:[7]
Některé komplexy Cp* lze připravit přesuny silylových skupin:
- Cp*Li + Me3SiCl → Cp*SiMe3 + LiCl
- Cp*SiMe3 + TiCl4 → Cp*TiCl3 + Me3SiCl
Určité komplexy Cp* je možné získat z hexamethylovaného Dewarova benzenu. Tímto způsobem se získával [Rh(C5Me5)Cl2]2, ovšem tento postup byl nahrazen využitím lépe dostupného Cp*H.
- 2 Cp*H + 2 Fe(CO)5 → [η5-Cp*Fe(CO)2]2 + H2 + 6 CO
Z se připravují chloromůstkové dimery [Cp*IrCl2]2 a [Cp*RhCl2]2. Při příslušných reakcích se používají halogenovodíkové kyseliny, které indukují potřebné přesmyky hexamethylovaného Dewarova benzenu[8][9] na substituovaný pentamethylcyklopentadien, po kterém následuje reakce s hydrátem chloridu iriditého[10] nebo rhoditého.[11]
![Příprava [Cp*IrCl2]2 z hexamethylovaného Dewarova benzenu](http://upload.wikimedia.org/wikipedia/commons/thumb/4/48/C5Me5Ir2Cl2viaMe6DewarBen.png/500px-C5Me5Ir2Cl2viaMe6DewarBen.png)
Srovnání s ostatními Cp ligandy[editovat | editovat zdroj]
Pentamethylcyklopentadienylové komplexy jsou v několika oblastech odlišné od cyklopentadienylových (Cp). V důsledku vyšší elektronové hustoty jsou Cp*− komplexy lepšími donory elektronů.[12] Fluorovaný ligand (trifluormethyl)tetramethylcyklopentadienyl, C5Me4CF3, spojuje vlastnosti Cp a Cp*: má sterické efekty Cp*, ale elektronovými vlastnostmi se podobá Cp, dodávání elektronů z methylových skupin je znemožněno elektronakceptorní povahou trifluormethylového substituentu.[13]
Sterické efekty vyvolávané pentamethylcyklopentadienovmi molekulami stabilizují komplexy s méně stabilními ligandy oslabením mezimolekulových sil, což omezuje tvorbu polymerních struktur. Tyto komplexy bývají také lépe rozpustné v nepolárních rozpouštědlech. Methylové skupiny v komplexech Cp* rovněž mohou podstoupit aktivace vazeb C-H. Cyklopentadienylové komplexy s velkými substituenty mohou vytvářet i výrazně silnější sterické efekty než jaké vytvářejí komplexy Cp*.

Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Pentamethylcyclopentadiene na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/77667
- ↑ C. Elschenbroich; A. Salzer. Organometallics: A Concise Introduction. [s.l.]: Wiley-VCH, 1989. Dostupné online. ISBN 9783527278183.
- ↑ L. De Vries. Preparation of 1,2,3,4,5-Pentamethyl-cyclopentadiene, 1,2,3,4,5,5-Hexamethyl-cyclopentadiene, and 1,2,3,4,5-Pentamethyl-cyclopentadienylcarbinol. The Journal of Organic Chemistry. 1960. DOI 10.1021/jo01080a623.
- ↑ THRELKEL, S.; BERCAW, J. E.; SEIDLER, P. F.; STRYKER, J. M.; BERGMAN, R. G. 1,2,3,4,5-Pentamethylcyclopentadiene. Org. Synth.. 1993. Dostupné online.; Coll. Vol.. S. 505.
- ↑ C. M. Fendrick; L. D. Schertz; E. A. Mintz; T. J. Marks. Large-Scale Synthesis of 1,2,3,4,5-Pentamethylcyclopentadiene. Inorganic Syntheses. 1992. ISBN 978-0-470-13260-9. DOI 10.1002/9780470132609.ch47.
- ↑ A. Yamamoto. Organotransition Metal Chemistry: Fundamental Concepts and Applications. [s.l.]: Wiley-Interscience, 1986. Dostupné online. ISBN 9780471891710.
- ↑ R. B. King; M. B. Bisnette. Organometallic chemistry of the transition metals XXI. Some π-pentamethylcyclopentadienyl derivatives of various transition metals. Journal of Organometallic Chemistry. 1967. DOI 10.1016/S0022-328X(00)91042-8.
- ↑ L. A. Paquette; G. R. Krow. Electrophilic Additions to Hexamethyldewarbenzene. Tetrahedron Letters. 1968, s. 2139–2142. DOI 10.1016/S0040-4039(00)89761-0.
- ↑ R. Criegee; H. Gruner. Acid-catalyzed Rearrangements of Hexamethyl-prismane and Hexamethyl-Dewar-benzene. Angewandte Chemie International Edition in English. 1968, s. 467–468. DOI 10.1002/anie.196804672.
- ↑ J. W. Kang; K. Mosley; P. M. Maitlis. Mechanisms of Reactions of Dewar Hexamethylbenzene with Rhodium and Iridium Chlorides. Chemical Communications. 1968, s. 1304–1305. DOI 10.1039/C19680001304.
- ↑ J. W. Kang; P. M. Maitlis. Conversion of Dewar Hexamethylbenzene to Pentamethylcyclopentadienylrhodium(III) Chloride. Journal of the American Chemical Society. 1968, s. 3259–3261. DOI 10.1021/ja01014a063.
- ↑ Takuya Kuwabara; Ryogen Tezuka; Mikiya Ishikawa; Takuya Yamazaki; Shintaro Kodama; Youichi Ishii. Ring Slippage and Dissociation of Pentamethylcyclopentadienyl Ligand in an (η 5 -Cp*)Ir Complex with a κ 3 - O , C , O Tridentate Calix[4]arene Ligand under Mild Conditions. Organometallics. 2018-06-25, s. 1829–1832. ISSN 0276-7333. DOI 10.1021/acs.organomet.8b00257.
- ↑ Paul G. Gassman; John W. Mickelson; Mikiya Ishikawa; John R. Sowa. 1,2,3,4-Tetramethyl-5-(trifluoromethyl)cyclopentadienide: a unique ligand with the steric properties of pentamethylcyclopentadienide and the electronic properties of cyclopentadienide. Journal of the American Chemical Society. 1992-08-01, s. 6942–6944. ISSN 0002-7863. DOI 10.1021/ja00043a065.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Pentamethylcyklopentadien na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pentamethylcyklopentadien na Wikimedia Commons

