Organické sloučeniny iridia




Organické sloučeniny iridia jsou organokovové sloučeniny obsahující vazby iridium-uhlík.[2] Využití mají při řadě významných procesů, jako jsou hydrogenace alkenů a průmyslová výroba kyseliny octové. Díky rozmanitosti reakcí a jejich využitelnosti v syntézách jsou také častými předměty výzkumu.[3]
Rozdělení podle oxidačních čísel[editovat | editovat zdroj]
Organoiridiové sloučeniny mají podobné vlastnosti jako příslušné sloučeniny rhodia, o něco méně se podobají sloučeninám kobaltu. Iridium může zaujímat oxidační čísla od -III do +V, nejčastější jsou I a III. Iridné sloučeniny mají elektronovou konfiguraci d8 a obvykle mají čtvercové nebo trigonálně bipyramidové geometrie, zatímco sloučeniny iridité (d6) jsou nejčastěji oktaedrické.[3]
Ir0[editovat | editovat zdroj]
Oxidační číslo 0 mívá iridium v binárních karbonylech, jako je dodekakarbonyl tetrairidia, Ir4(CO)12. Na rozdíl od podobného Rh4(CO)12, jsou zde všechny CO ligandy koncové; tento rozdíl je obdobný jako u Fe3(CO)12 a Ru3(CO)12.[4]
IrI [editovat | editovat zdroj]
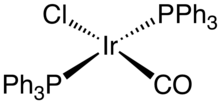
Příkladem iridné sloučeniny je Vaskův komplex, chlorid kabonylu bis(trifenylfosfin)iridia. Iridné komplexy jsou často dobrými homogenními katalyzátory, což však u Vaskova komplexu neplatí; tato sloučenina je ovšem významná širokým spoektrem reakcí, kterých se může účastnit. K dalším komplexům Ir0 patří dimer cyklooktadieniridiumchloridu (Ir2Cl2(cyklooktadien)2) a dimer chlorobis(cyklookten)iridia IrCl(PPh3)3), analog Wilkinsonova katalyzátoru vstupuje do orthometalačních reakcí:
- IrCl(PPh3)3 → HIrCl(PPh3)2(PPh2C6H4)
Tento rozdíl mezi RhCl(PPh3)3 a IrCl(PPh3)3 se projevuje snazším zapojováním iridia do oxidačních adicí. Podobné změny lze pozorovat u RhCl(CO)(PPh3)2 a IrCl(CO)(PPh3)2, kde se pouze na druhou sloučeninu mohou oxidačně adovat O2 a H2.[5] Alkenové komplexy, dimery chlorobis(cyklookten)iridia a cykooktadieniridiumchloridu, se často používají jako zdroje „IrCl“, přičemž se využívá nestálost alkeneových ligandů a možnost jejich odstranění hydrogenacemi. Crabtreeův katalyzátor ([Ir(P(C6H11)3)(pyridin)(cyklooktadien)]PF6) je vhodným katalyzátorem pro řadu hydrogenací alkenů.[6]
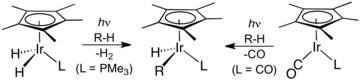
(η5-Cp)Ir(CO)2 se oxidačně aduje na vazby C-H po fotolytické disociaci CO ligandů.
IrII[editovat | editovat zdroj]
Podobně jako rhodnaté jsou i iridnaté sloučeniny vzácné. Jako příklad lze uvést iridocen, IrCp2.[7] Podobně jako u rhodocenu se iridocen dimerizuje za pokojové teploty.[8]
IrIII[editovat | editovat zdroj]
Iridium se nejčastěji dodává v oxidačních číslech III a IV. Na jejich přípravu se používají hydráty chloridu iriditého a hexachloroiridičitanu amonného. Tyto soli se redukují za přítomnosti CO, vodíku a alkenů:
IrCl3(H2O)x + 3 CO → [Ir(CO)2Cl2]− + CO2 + 2 H+ + Cl− + (x-1) H2O
Řadu organoiriditých sloučenin je možné získat z dimeru pentamethylcyklopentadienyliridiumdichloridu. Mnoho z nich obsahuje kineticky netečné cyklometalované ligandy.[9] Obdobné polosendvičové sloučeniny sehrály významnou roli při rozvoji aktivací vazeb uhlík-vodík.[10][11]
IrV[editovat | editovat zdroj]
Oxidační čísla vyšší než III jsou u iridia častější než u rhodia. Jako příklad může sloužit oxotrimesityliridium(V).[12]
Použití[editovat | editovat zdroj]
Hlavní využití organických sloučenin iridia spočívá v katalýze karbonylace methanolu na kyselinu octovou.[13]

Optická a fotoredoxní využití[editovat | editovat zdroj]
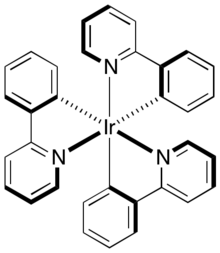
Komplexy iridia, například cyklometalované deriváty 2-fenylpyridinů, se používají ve fosforescenčních OLED.[14]
Iridium obsahují také některé fotoredoxní katalyzátory.
Další možná využití[editovat | editovat zdroj]
Komplexy iridia jsou vysoce účinnými katalyzátory hydrogenací. Vyvíjeny jsou i asymetrické varianty těchto reakcí.
Mnoho polosendvičových sloučenin bylo zkoumáno pro možná využití jako protinádorová léčiva. Podobné komplexy slouží jako elektrokatalyzátory přeměny oxidu uhličitého na kyselinu mravenčí.[9][15]
V laboratořích se zkoumá využití komplexů iridia při aktivacích vazeb uhlík-vodík, které však nemají průmyslové využití.
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Organoiridium compound na anglické Wikipedii.
- ↑ S. M. Bischoff, R. A. Periana. Oxygen and Carbon Bound Acetylacetonato Iridium(III) Complexes. Inorganic Syntheses. 2010, s. 173. DOI 10.1002/9780470651568.
- ↑ Synthesis of Organometallic Compounds: A Practical Guide Sanshiro Komiya Ed. S. Komiya, M. Hurano 1997
- ↑ a b Robert H. Crabtree. The Organometallic Chemistry of the Transition Metals. [s.l.]: Wiley-Interscience, 1994. Dostupné online. ISBN 0-471-66256-9.
- ↑ N. N. Greenwood; A. Earnshaw. Chemistry of the Elements. [s.l.]: Butterworth-Heinemann, 1997. Dostupné online. ISBN 0-7506-3365-4. S. 1113–1143, 1294.
- ↑ ; DILUZIO, J. W. Carbonyl and Hydrido-Carbonyl Complexes of Iridium by Reaction with Alcohols. Hydrido Complexes by Reaction with Acid. Journal of the American Chemical Society. 1961, s. 2784–2785. DOI 10.1021/ja01473a054.
- ↑ Robert H. Crabtree. Iridium Compounds in Catalysis. Accounts of Chemical Research. 1979, s. 331–337. DOI 10.1021/ar50141a005.
- ↑ KELLER, H. J.; WAWERSIK, H. Spektroskopische Untersuchungen an Komplexverbindungen. VI. EPR-spektren von (C5H5)2Rh und (C5H5)2Ir. Journal of Organometallic Chemistry. 1967, s. 185–188. DOI 10.1016/S0022-328X(00)84718-X.
- ↑ FISCHER, E. O.; WAWERSIK, H. Über Aromatenkomplexe von Metallen. LXXXVIII. Über Monomeres und Dimeres Dicyclopentadienylrhodium und Dicyclopentadienyliridium und Über Ein Neues Verfahren Zur Darstellung Ungeladener Metall-Aromaten-Komplexe. Journal of Organometallic Chemistry. 1966, s. 559–567. DOI 10.1016/S0022-328X(00)85160-8.
- ↑ a b Zhe Liu; Peter J. Sadler. Organoiridium Complexes: Anticancer Agents and Catalysts. Accounts of Chemical Research. 2014, s. 1174–1185. DOI 10.1021/ar400266c. PMID 24555658.
- ↑ Andrew H. Janowicz, Robert G. Bergman. Carbon–hydrogen activation in saturated hydrocarbons: direct observation of M + R−H → M(R)(H). Journal of the American Chemical Society. 1982, s. 352–354. DOI 10.1021/ja00365a091.
- ↑ GRAHAM, William A. G. Oxidative addition of the carbon–hydrogen bonds of neopentane and cyclohexane to a photochemically generated iridium(I) complex. Journal of the American Chemical Society. 1982, s. 3723–3725. DOI 10.1021/ja00377a032.
- ↑ R. S. Hay-Motherwell; G. Wilkinson; B. Hussain-Bates; M. B. Hursthouse. Synthesis and X-ray Crystal Structure of Oxotrimesityl-Iridium(V). Polyhedron. 1993, s. 2009–2012. DOI 10.1016/S0277-5387(00)81474-6.
- ↑ Hosea Cheung; Robin S. Tanke; G. Paul Torrence. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: Wiley, 2000. DOI 10.1002/14356007.a01_045. Kapitola Acetic acid.
- ↑ Jaesang Lee, Hsiao-Fan Chen, Thilini Batagoda, Caleb Coburn, Peter I. Djurovich, Mark E. Thompson, Stephen R. Forrest, Olle Inganäs. Deep Blue Phosphorescent Organic Light-Emitting Diodes with Very High Brightness and Efficiency. Nature Materials. 2016, s. 92–98. DOI 10.1038/nmat4446. PMID 26480228.
- ↑ Yuta Maenaka; Tomoyoshi Suenobu; Catalytic interconversion between hydrogen and formic acid at ambient temperature and Pressure. Organoiridium Complexes: Anticancer Agents and Catalysts. Energy & Environmental Science. 2012, s. 7360–7367. DOI 10.1039/c2ee03315a.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Organické sloučeniny iridia na Wikimedia Commons
Obrázky, zvuky či videa k tématu Organické sloučeniny iridia na Wikimedia Commons