Vazba uhlík–fluor
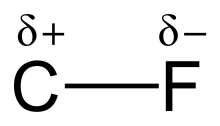
Vazba uhlík–fluor je kovalentní vazba mezi atomy uhlíku a fluoru, obsažená v organických sloučeninách fluoru. Jedná se o jednu z nejsilnějších chemických vazeb - po jednoduchých vazbách B-F , Si-F a H-F; navíc je poměrně krátká, protože má částečně vlastnosti iontové vazby. Vazba je silnější, pokud je na stejný uhlík navázáno více atomů fluoru. Fluoroalkany, jako je tetrafluormethan tak patří k nejméně reaktivním organickým sloučeninám.
Elektronegativita a energie vazeb[editovat | editovat zdroj]
Vysoká elektronegativita fluoru (4,0 oproti 2,5 u uhlíku) dodává vazbě uhlík-fluor značnou polaritu a velký dipólový moment. Elektronová hustota je soustředěna kolem fluoru a uhlík je tak poměrně chudý na elektrony. Vzniklé částečné náboje (Cδ+—Fδ−) dodávají vazbě částečně iontovou povahu a rovněž způsobují neobvyklou sílu vazby. Tato vazba bývá označována jako „Nejsilnější v organické chemii“,[1] protože fluor vytváří nejsilnější jednoduchou vazbu s uhlíkem. Vazby uhlík-fluor mohou mít disociační energie až okolo 540 kJ/mol.[2] Disociační energie C-F jsou vyšší než u jakýchkoliv jiných vazeb uhlík-halogen a uhlík–vodík, například u vazby C-X v molekule CH3-X je postupně 482, 439, 350, 302 a 241 kJ/mol pro X = fluor, vodík, chlor, brom a jod.[3]
Délka vazby[editovat | editovat zdroj]
Délky vazeb C-F bývají obvykle kolem 135 pm (139 pm u fluormethanu).[1] Jsou kratší než ostatní vazby uhlík–halogen a také kratší než jednoduché vazby uhlík-dusík a uhlík–kyslík, i když má fluor větší relativní atomovou hmotnost. Malá délka vazeb je způsobována její částečně iontovou povahou a z ní vyplývajícího elektrostatického přitahování částečných nábojů na uhlíku a fluoru. V závislosti na typu hybridizace uhlíkového atomu a přítomnosti dalších substituentů na uhlíku, nebo i vzdálenějších atomech, se její délka může lišit o několik pm. Tyto změny mohou být vyvolávány změnami v hybridizaci a prostorovými elektronovými interakcemi. V tabulce níže jsou znázorněny různé délky vazeb C-F u různých molekul (atomy uhlíku mají hybridizaci sp3, pokud není uvedeno jinak).
Vazba Průměrná délka (pm)[4] CCH2F, C2CHF 139,9 C3CF 142,8 C2CF2, H2CF2, CCHF2 134,9 CCF3 134,6 FCNO2 132,0 FCCF 137,1 Csp2F 134,0 CarF 136,3 FCarCarF 134,0
Rozdílné délky vazeb a jejich zkracování v důsledku částečně iontových vlastností bylo také pozorováno u vazeb fluoru s jinými prvky a stalo se zdrojem potíží při určování kovalentního poloměru fluoru. Linus Pauling původně uvedl hodnotu 64 pm, která však byla poté upravena na 72 pm, což je polovina délky vazby F–F, je to však příliš mnoho, aby mohlo jít o reprezentativní hodnotu pro vazby fluoru s jinými prvky, a tak byly jinými autory navrženy délky 54 pm a 60 pm.[5][6][7][8]
Síly geminálních vazeb[editovat | editovat zdroj]
S rostoucím počtu atomů fluoru navázaných na stejný (geminální) uhlík se zvyšují energie a snižují délky ostatních vazeb, což je vidět například u fluorovaných derivátů methanu, jak je zobrazeno níže v tabulce; mění se také částečné náboje (qC a qF) na atomech.[2] Částečný kladný náboj na uhlíku při přidávání dalších fluorů zesiluje, čímž se zvýrazňují elektrostatické působení i iontovost vazby mezi atomy fluoru a uhlíku.
Sloučenina Délka vazby C-F (pm) Disociační energie (kJ/mol) qC qF CH3F 138,5 460 ± 4 0,01 −0,23 CH2F2 135,7 500 0,40 −0,23 CHF3 133,2 534 0,56 −0,21 CF4 131,9 546 ± 13 0,72 −0,18
Spektroskopie[editovat | editovat zdroj]
V infračerveném spektru lze pozorovat prodlužování vazeb C-F mezi 1000 a 1360 cm−1. Rozmezí je široké, protože frekvence je ovlivňována ostatními substituenty v molekule. Monofluorované sloučeniny mají široký pás mezi 1000 a 1110 cm−1; jestliže je přítomen více než jeden atom fluoru, tak se pás rozdělí na dva.[9] C-F pásy jsou natolik výrazné, že mohou překonat případné C–H pásy.[10]
Organofluoridy lze také zkoumat pomocí spektroskopie nukleární magnetické rezonance, s využitím uhlíku-13, fluoru-19 nebo (pokud je přítomen) vodíku-1. Chemické posuny při 19-F NMR se, v závislosti na míře substituce a druhu navázaných funkčních skupin vyskytují ve velmi širokém rozmezí. V tabulce níže jsou uvedena rozmezí pro nejběžnější skupiny sloučenin.[11]
Druh sloučeniny Rozmezí chemického posunu (ppm) vzhledem k čistému CFCl3 F–C=O −70 až −20 CF3 +40 až +80 CF2 +80 až +140 CF +140 až +250 ArF +80 až +170
Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Carbon–fluorine bond na anglické Wikipedii.
- ↑ a b D. O'Hagan. Understanding organofluorine chemistry. An introduction to the C–F bond. Chem Soc Rev. February 2008, s. 308–19. DOI 10.1039/b711844a. PMID 18197347.
- ↑ a b Lemal DM. "Perspective on Fluorocarbon Chemistry" J Org Chem. 2004, volume 69, p 1–11. DOI:10.1021/jo0302556
- ↑ S. J. Blanksby, G. B. Ellison. Bond dissociation energies of organic molecules. Accounts of Chemical Research. April 2003, s. 255–63. DOI 10.1021/ar020230d. PMID 12693923.
- ↑ F. H. Allen, O. Kennard, D. G. Watson, L. Brammer, A. G. Orpen. Tables of bond Lengths determined by X-Ray and Neutron Diffraction. Part 1. Bond Lengths in Organic Compounds. J. Chem. Soc. Perkin Trans. II 1987, S1-S19.
- ↑ Ronald Gillespie; EDWARD ROBINSON. Bond Lengths in Covalent Fluorides. A New Value for the Covalent Radius of Fluorine. Inorganic Chemistry. 1992, s. 1960–1963. DOI 10.1021/ic00036a045.
- ↑ Edward Robinson; SAMUEL JOHNSON; TANG TING-HUA; RONALD GILLESPIE. Reinterpretation of the Lengths of Bonds to Fluorine in Terms of an Almost Ionic Model. Inorganic Chemistry. 1997, s. 3022–3030. DOI 10.1021/ic961315b. PMID 11669953.
- ↑ Beatriz Cordero; VERÓNICA GÓMEZ; ANA E. PLATERO-PRATS; MARC REVÉS; JORGE ECHEVERRÍA; EDUARD CREMADES; FLAVIA BARRAGÁN. Covalent radii revisited. Dalton Transactions. 2008, s. 2832–2838. DOI 10.1039/b801115j. PMID 18478144.
- ↑ P. Pyykkö; M. ATSUMI. Molecular Single-Bond Covalent Radii for Elements 1-118. Chemistry: A European Journal. 2009, s. 186–197. DOI 10.1002/chem.200800987. PMID 19058281.
- ↑ George Socrates. Infrared and Raman characteristic group frequencies: tables and charts. [s.l.]: John Wiley and Sons, 2001. ISBN 978-0-470-09307-8. S. 198.
- ↑ Barbara H. Stuart. Infrared Spectroscopy: Fundamentals and Applications. [s.l.]: John Wiley and Sons, 2004. ISBN 978-0-470-85428-0. S. 82.
- ↑ Archived copy [online]. [cit. 2008-11-09]. Dostupné v archivu pořízeném dne 2008-05-15.
