Kyselina nitrosylsírová
| Kyselina nitrosylsírová | |
|---|---|
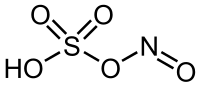 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | kyselina nitrosylsírová |
| Sumární vzorec | HNO5S |
| Vzhled | světle žluté krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 7782-78-7 |
| EC-no (EINECS/ELINCS/NLP) | 231-964-2 |
| PubChem | 82157 |
| SMILES | N(=O)OS(=O)(=O)O |
| InChI | InChI=1S/HNO5S/c2-1-6-7(3,4)5/h(H,3,4,5) |
| Vlastnosti | |
| Molární hmotnost | 127,08 g/mol |
| Teplota tání | 73,5 °C (346,6 K)[2] |
| Teplota varu | rozkládá se |
| Rozpustnost ve vodě | rozkládá se |
| Rozpustnost v polárních rozpouštědlech | rozpustná v kyselině sírové[1] |
| Bezpečnost | |
| [2] Nebezpečí[2] | |
| H-věty | H271 H272 H301 H311 H314 H331[2] |
| P-věty | P210 P220 P221 P260 P261 P264 H270 P280 P283 P301+310 P301+330+331 P302+352 P303+361+353 P304+340 P305+351+338 P306+360 P310 P311 P312 P321 P322 P330 P361 P363 P370+378 P371+380+375 P403+233 P405 P501[2] |
Některá data mohou pocházet z datové položky. | |
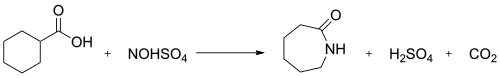
Kyselina nitrosylsírová je anorganická sloučenina se vzorcem NOHSO4. Jedná se o bezbarvou kapalinu používanou na výrobu kaprolaktamu,[3] která se také používala k výrobě kyseliny sírové. Jedná se o smíšený anhydrid kyseliny sírové a dusičné.
V organické chemii slouží k nitrosylacím a jako diazotační a oxidační činidlo.[1]
Příprava a reakce
[editovat | editovat zdroj]Kyselina nitrosylsírová se vyrábí rozpouštěním dusitanu sodného v chladné kyselině sírové:[4][5]
- HNO2 + H2SO4 → NOHSO4 + H2O
Také ji lze získat reakcí kyseliny dusičné s oxidem siřičitým.[6]
Kyselina nitrosylsírová je zde meziproduktem při přípravě chloridu nitrosylu (NOCl).
NOHSO4 se používá k přípravě diazoniových solí z aminů Sandmeyerovou reakcí. Podobnými zdroji nitrososkupiny jsou tetrafluorboritan nitrosonia ([NO]BF4) a chlorid nitrosylu.
V průmyslu slouží nitrosodekarboxylační reakce kyseliny nitrosylsírové a cyklohexankarboxylové k výrobě kaprolaktamu:[3]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Nitrosylsulfuric acid na anglické Wikipedii.
- ↑ a b c George A. Olah, G. K. Surya Prakash, Qi Wang, Xing-Ya Li. Nitrosylsulfuric Acid. [s.l.]: [s.n.], 2001. ISBN 978-0471936237. DOI 10.1002/047084289X.rn060.
- ↑ a b c d e Nitrosylsulfuric acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b J. Ritz; H. Fuchs; H. Kieczka; W. C. Moran. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2002. ISBN 978-3527306732. DOI 10.1002/14356007.a05_031. Kapitola Caprolactam.
- ↑ HODGSON, H. H.; MAHADEVAN, A. P.; WARD, E. R. 1,4-Dinitronaphthalene. Org. Synth.. 1955. Dostupné online.; Coll. Vol.. S. 341.
- ↑ SANDIN, R. B.; CAIRNS, T. L. 1,2,3-Triiodo-5-nitrobenzene. Org. Synth.. 1943. Dostupné online.; Coll. Vol.. S. 604.
- ↑ G. H. Coleman; G. A. Lillis; G. E. Goheen. Nitrosyl Chloride. [s.l.]: [s.n.], 1939. ISBN 9780470132326. DOI 10.1002/9780470132326.ch20. S. 55–59.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Kyselina nitrosylsírová na Wikimedia Commons
Obrázky, zvuky či videa k tématu Kyselina nitrosylsírová na Wikimedia Commons